悦目金蛛和棒络新妇卵袋丝物理化学结构表征及其力学性能研究
2010-09-13蒋平吕太勇肖永红曾建忠周兵郭聪
蒋平,吕太勇,肖永红,曾建忠,周兵,郭聪
1.井冈山大学生命科学学院,江西吉安343009;
2.四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都610064
悦目金蛛和棒络新妇卵袋丝物理化学结构表征及其力学性能研究
蒋平1,吕太勇1,肖永红1,曾建忠1,周兵1,郭聪2
1.井冈山大学生命科学学院,江西吉安343009;
2.四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都610064
蜘蛛丝是一种具有优良机械性能的天然动物蛋白纤维,它特有的结构和性能与其生物学功能密切相关。作者采用氨基酸自动分析仪、傅立叶转换红外光谱仪、扫描电镜和电子单纤强力仪对悦目金蛛(Argiope amoena)和棒络新妇(Nephila clavata)的卵袋丝进行了物理化学结构表征与力学性能的研究,结果表明两种蜘蛛卵袋均由微米级柱状腺丝、大壶状腺丝、亚微米级或纳米级葡萄状腺丝构成。卵袋丝的表面形貌特征、极性氨基酸含量、大侧链与小侧链氨基酸的比值、无定型区、β-折叠结构与结晶结构的含量等氨基酸组成种类与蛋白质二级结构特征,均满足各自生物学功能对断裂强度、延展性、初始模量等力学性能的要求。
蜘蛛;卵袋丝;物理化学结构;力学性能
0 引言
很长一段时间以来,人们一直认为蜘蛛丝和蚕丝都是蛋白质晶体包埋在蛋白质胶体中形成的复合物质[1~3],但现在这种观点早已被否定,研究表明蜘蛛丝和蚕丝包含长的微纤丝和其它微观结构[4~9]。对蜘蛛拖牵丝蛋白基因的测序表明,蜘蛛丝蛋白分子链由多种重复多肽序列组成,多肽序列分为4类:1)(GPGXX)n/(GPGQQ)n;2)An/(GA)n;3)(GGX)n;4)任意序列[10]。
人们采用红外光谱[11]、单纤X晶体衍射[12~14]、拉曼光谱[15~17]、核磁共振[18~21]等研究手段,对蜘蛛拖牵丝蛋白二级结构进行的大量研究分析表明,蜘蛛丝是一种半结晶的高分子聚合物,含有结晶相和非结晶相。结晶相主要由An或(GA)n氨基酸基序构成的、沿丝纤维长轴方向排列的反平行β-折叠构成;肽链分子间相互以氢键结合,形成排列整齐、密集的片层结构,分子间作用力很大,赋予蜘蛛丝的高强度和高模量;非结晶相是由无定型结构和微孔[6]构成,β-折叠片层之间的富含甘氨酸的(GGX)n或(GPGXX)n或(GPGQQ)n基序构成了无定型区。(GGX)n基序可能形成310螺旋结构,而(GPGXX)n或(GPGQQ)n基序形成类似β转角的弹性螺旋结构[18,22],这些结构赋予蜘蛛丝良好的延展性和弹性。由于蜘蛛丝是为蜘蛛的生存与繁殖设计的,因此其特有的结构和性能是与它的生物学功能密切相关的[2,23]。蜘蛛体内有9种丝腺(并不是每种蜘蛛同时都具有这9种丝腺),能纺出多种不同组成、结构、性能和功能的丝蛋白纤维,如园蛛能产生7种不同特性的丝,各具不同的生物学功能[23~26]。
对蜘蛛丝蛋白结构的大量研究主要集中于纺自大壶状腺的拖牵丝,近年来由柱状腺纺出的卵袋丝[27~30]以及其它丝腺[26],如小壶状腺、葡萄状腺等[31~33]纺出的蛛丝蛋白纤维愈来愈受到人们的关注。Casem、Foradori、潘志娟、蒋平等[34~37]的研究表明,蜘蛛卵袋覆盖层丝(特别是内层丝)和卵袋框架丝是分别由柱状腺和大壶状腺纺出的具有不同功能的两种蜘蛛丝,那么与拖牵丝相比,卵袋覆盖层丝氨基酸含量的变化,特别是卵袋内层丝丝氨酸百分含量的骤然增加,以及同时伴随的甘氨酸含量的骤然降低,将怎样影响卵袋丝蛋白的二级结构与力学性能呢?为此,本文采用氨基酸自动分析仪、傅立叶转换红外光谱仪、扫描电镜和电子单纤强力仪对悦目金蛛和棒络新妇的卵袋丝进行了物理化学结构表征与力学性能的研究。探讨了氨基酸组成的改变对蜘蛛丝二级结构与力学性能的影响及与其生物学功能之间的关系。
1 材料与方法
1.1 蜘蛛与卵袋
实验所用的悦目金蛛和棒络新妇均采自米易县安宁河旁的公园(东经102.06°,北纬26.88°)。体长15~21 mm,重300 mg以上,均为成体,放入60 cm×60 cm×60 cm笼中,用蚊虫喂养,饲养条件为:(24.5±2.0)℃,相对湿度50%±5%,L∶D=12∶12(h)。在蜘蛛织制完卵袋后,立即收集卵袋备用。
1.2 卵袋解剖与蜘蛛丝样品的准备
用刀片或剪刀从一个完整的卵袋(图1A,图2A)上将铆钉和支持卵袋的金黄色框架丝取下,然后用镊子小心地将卵袋各层分开,收集不同颜色的卵袋覆盖层丝备用。采用人工抽丝的方法获得悦目金蛛的拖牵丝。收集笼中水平的丝束,获得棒络新妇自然纺出的拖牵丝。
1.3 蜘蛛卵袋丝超微形貌观察
将各卵袋层或丝纤维用双面胶贴在样品台上,用金粉喷镀5 min后,直接送入样品室进行观察(JEOL JSM-5900日本电子株式会社,观察条件:U=20 kV,I=0.6 nA),丝纤维的直径使用Smileview软件进行测量。
1.4 氨基酸组成分析
称取1~2 mg蜘蛛丝,酸水解,然后送到四川省农业科学院分析测试中心使用L8000(Hitachi,Japan)氨基酸自动分析仪进行氨基酸组成分析。
1.5 红外光谱分析
采用KBr固体压片制样的方法[39]:KBr经400℃高温灼烧4 h,在保干器中冷却到室温称重制样,并做了KBr空白对照。共测试8个蛛丝样品:悦目金蛛和棒络新妇的拖牵丝、卵袋框丝、卵袋内层丝、悦目金蛛卵袋灰绿色外层丝和白色外覆盖层丝。在制样前,丝样品进行了干燥的,已排除水分对结构的影响。测试仪器为Nicole公司生产的170SX型红外光谱仪,在中红外区4,000~400 cm-1范围内对样品进行测定。
1.6 力学性能的测试
采用LLY-06B型(莱州市电子仪器有限公司)电子单纤强力仪对两种蜘蛛的卵袋框丝和内层丝进行了拉伸测试,测试条件:夹持距20 mm,下降速度10 mm/min,温度20℃,湿度为65%。将拉伸试验断裂后的样品喷金,用扫描电镜观测样品的外貌,测定其沿丝长轴旋转90°前后两个位置的直径值,然后可通过如下表达式,从实验测得的直径得到其断裂前的任意伸长状态下丝纤维的直径与截面面积[38]:
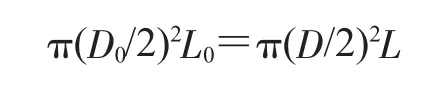
D0和D分别表示断裂前后的蚕丝直径,π(D0/2)2和π(D/2)2,分别表示断裂前后的横截面面积,L0和L分别表示原始和最终样品长度。从等式中可看出,拉伸测试中样品体积保持不变,以前有关蚕丝的研究中也一直利用这一关系[42]。由这些面积把相对应的负载-位移曲线转换成应力-应变曲线,断裂能通过计算应力-应变曲线与横坐标围成的面积获得。上述所有实验过程中均很小心,以避免将丝纤维拉伸。
数据的统计处理使用SPSS13.0软件完成,采用one-way-ANOVA分析,在进行单因素方差分析前,检验了数据正态性和方差齐性,所有数据表示为平均值依标准误。
2 结果
2.1 卵袋丝的物理结构表征
SEM观察表明,悦目金蛛与棒络新妇的卵袋主要是由大壶状腺纺出的框架丝与柱状腺和葡萄状腺纺出的覆盖层丝构成,其中框丝和柱状腺丝直径分别约为8 μm和5~12 μm;而葡萄状腺丝直径为260~800 nm(图1和2)。卵袋框丝与典型蛛丝拖牵丝一样,表面较为光滑细腻,个别丝样品隐约可见纵向的条纹;而卵袋内层丝表面不光滑,较为粗糙,可见沿丝纤维纵向周期性分布的清晰沟槽与条纹(图1F与图2F)。
2.2 氨基酸组成
卵袋框丝与拖牵丝均由大壶状腺纺出,因此它们的氨基酸组成特征相似,甘氨酸和丙氨酸的含量最丰富,共占45%至56%左右;其次分别是谷氨酸、丝氨酸、亮氨酸和脯氨酸。棒络新妇卵袋外覆盖层丝的氨基酸组成也与其卵袋框丝和拖牵丝相似。与拖牵丝和卵袋框丝相比,棒络新妇卵袋内层丝与悦目金蛛卵袋内外层丝的氨基酸组成发生了重要变化:丝氨酸的含量显著增加,占20%左右;与此同时甘氨酸的含量显著减少,只占6.5%左右;丙氨酸的含量变化不大,仍占了22%左右;谷氨酸的含量略有下降;天冬氨酸和苏氨酸的含量较高;脯氨酸的含量较低(表1)。与卵袋框丝相比,由于甘氨酸含量的减少和丝氨酸的含量增加,卵袋内层丝纤维的极性氨基酸含量较高。

图1 悦目金蛛卵袋丝扫描电镜图(A)卵袋;(B)卵袋框架大壶状腺丝;(C,D)灰绿色与白色卵袋外层丝(含有大直径的柱状腺丝与少量的小直径的葡萄状腺丝);(E,F)棕色卵袋内层丝(仅含有大直径的柱状腺丝,可见丝表面的沿丝纤维纵向周期性分布的清晰沟槽和条纹)Fig.1 SEM morphologies ofA.amoenaegg case silks(A)Egg case;(B)Major ampullate silk in the egg case frame;(C,D)Graygreen and white outer cover silk(containing large diameter cylindrical and fine aciniform silk);(E,F)Umber inner cover silk(containing cylindrical silk,the apparentlongitudinalstrandsorstripeswere presented on its surface)

图2 棒络新妇卵袋丝扫描电镜图(A)卵袋;(B)卵袋框架大壶状腺丝;(C)卵袋外层丝(含有大直径的大壶状腺丝与少量小直径其它类型丝纤维,如葡萄状腺丝等);(D,E)白色卵袋内层丝(含有大直径的柱状腺丝与少量小直径其它类型丝纤维,如葡萄状腺丝等);(F)卵袋内层丝(可见丝表面的沿丝纤维纵向周期性分布的清晰沟槽和条纹)Fig.2SEMmorphologiesofN.clavataegg case silks(A)Egg case;(B)Major ampullate silk in the egg case frame;(C)Outer cover silk(mainly containing large diameter major ampullate silk and othersometypesof smalldiametersilk,e.g. aciniform silk);(D,E)Inner cover silk(containing largediametercylindricalsilkandothersome types of small diameter silk,e.g.aciniform silk); (F)Inner cover silk(cylindrical silk,the apparent longitudinal strands or stripes were presented on its surface)
2.3 红外光谱分析
两种蜘蛛卵袋丝红外光谱特征峰的频率范围主要集中在800~1,700 cm-1之间,均出现了酰胺Ⅰ、Ⅱ和Ⅲ的特征谱带(图3~5)。卵袋内层丝和人工抽拖牵丝在约1,626 cm-1和1,695 cm-1处出现了小背;人工抽拖牵丝与棒络新妇卵袋内层丝都在约1,540 cm-1出现了小背;只有悦目金蛛和棒络新妇的卵袋框丝及棒络新妇的拖牵丝在约960 cm-1处出现了明显的多聚丙氨酸吸收峰。
2.4 力学性能
表2汇总了两种主要卵袋丝的力学性能参数,表明棒络新妇卵袋框架丝具有较大的初始模量、断裂强度和断裂能,但其延展性较差,屈服点较低;而卵袋内层丝的初始模量和断裂强度较低,但其断裂能与延展性较好,屈服点较高。悦目金蛛卵袋框丝与内层丝都表现出较高的模量、断裂强度和断裂能,但内层丝比框丝具有较高的屈服点、延展性与断裂能。此外,卵袋框架丝单丝纤维的拉伸行为的重复性较差;而卵袋内层丝单丝纤维的拉伸行为具有良好的重复性。
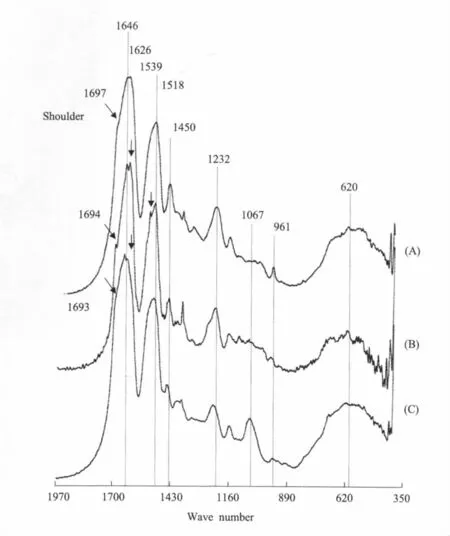
图3 悦目金蛛网丝的红外光谱图(A)卵袋金黄色框架大壶状腺丝;(B)人工抽拖牵丝与;(C)卵袋棕色内层丝Fig.3FTIR spectra of web silk form theA.amoena(A)Golden major ampullate silk from the egg case frame;(B)White dragline silk(artificially reeled);(C)Egg case umber inner cover silk

图4 悦目金蛛卵袋丝的红外光谱图(A)灰绿色外覆盖层丝;(B)白色外覆盖层丝;(C)棕色内层丝Fig.4FTIR spectra of theA.amoenaegg case silk(A)Greygreen outer cover silk;(B)White outer cover silk;(C)Umber inner cover silk
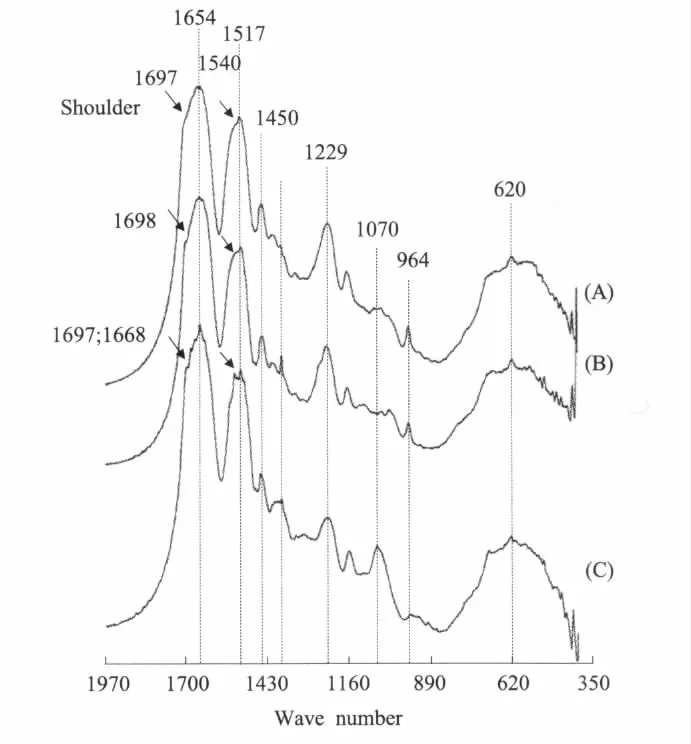
图5 棒络新妇网丝的红外光谱图(A)卵袋金黄色框架大壶状腺丝;(B)金黄色拖牵丝;(C)卵袋内层丝Fig.5FTIR spectra of web silk form theN.clavata(A)Golden major ampullate silk from the egg case frame;(B)Golden dragline silk(naturally spun);(C)Egg case inner cover silk
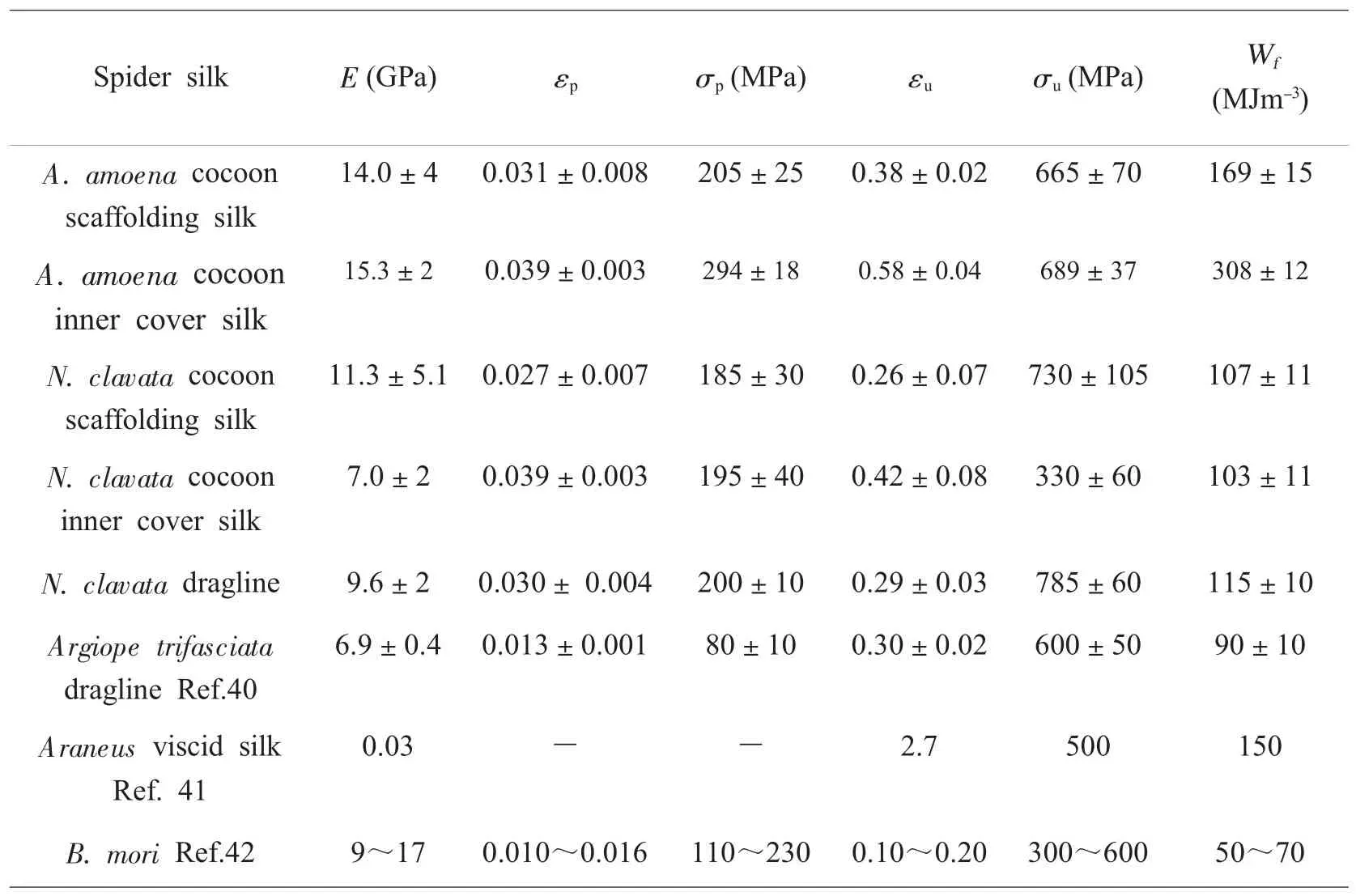
表2 悦目金蛛和棒络新妇卵袋框丝与内层丝的力学性能Table 2Tensile parameters of the scaffolding silk and inner cover silk of theN.clavataand A.amoenaegg case
3 讨论
3.1 卵袋丝的物理结构表征
棒络新妇卵袋覆盖层的丝纤维种类比悦目金蛛较为复杂,含有除大直径柱状腺丝、大壶状腺丝与小直径葡萄状腺丝以外的其它类型的蛛丝,其丝腺来源还需进一步研究确定。与框丝和拖牵丝相比,卵袋覆盖层丝具有截然不同的物理结构表征,其主要组成纤维柱状腺丝表面不光滑,较为粗糙,具有沿丝纤维纵向周期性分布的清晰沟槽和条纹,这些沟槽和条纹可能是在成丝过程中液态丝蛋白流动而形成的,同时具有原纤结构的特征[44]。这一结构一方面减小了丝的横截面面积,可增强丝的力学性能,如断裂强度等[45];另一方面增加了丝的表面积和粗糙度,可能有助于刚孵化的若蛛攀附,有利于其发育生长。其它种类的蜘蛛,如大腹园蛛(Araneus ventricosus)[44]、金蛛(Argiope argentata)[45]、园蛛(Zygiella x-notata)[46]、横纹金蛛(Argiope bruennichi)、肩斑银鳞蛛(Leucauge blanda)、摩鹿加云斑蛛(Cyrtophora moluccensis)(蒋平等,未发表),卵袋内层丝也呈现出相似的微观形貌结构,暗示这一结构是这类丝的普遍特征。微米级的柱状腺丝(5~12 μm)与少量的纳米级的葡萄状腺丝(260~800 nm)混合在一起构成了卵袋外覆盖层,这保证了卵袋具有相对较好的密闭性,为卵块或若蛛提供了安全的庇护所与稳定的微环境,以避免胚胎发育、孵化和蜕皮过程中受到温度和湿度波动的影响,直到它们爬出卵袋(出蛰)[37]。
3.2 氨基酸组成
Garb等[28]的研究表明,丝心蛋白在进化上是保守的。本研究中两种蜘蛛卵袋覆盖层丝(棒络新妇卵袋外层丝除外)的氨基酸组成,与亲缘关系较近的其它种类蜘蛛的丝心蛋白TuSp1的组成相似,因此,我们认为丝心蛋白TuSp1是这两种蜘蛛卵袋覆盖层丝的主要蛋白成分。棒络新妇卵袋内层丝和悦目金蛛卵袋外层丝的氨基酸组成与典型的柱状腺丝相似,而棒络新妇卵袋外层丝的氨基酸组成与典型的大壶状腺丝相似,结合扫描电镜图片分析,表明它们分别主要由大直径的柱状腺丝与大壶状腺丝构成,中小直径丝纤维的含量比较少;而悦目金蛛卵袋内覆盖层只含有柱状腺丝。Vasanthavada等[47]从Latrodectus hesperus(黑寡妇)卵袋中分离鉴定到了葡萄状腺丝心蛋白AcSp1-like,为葡萄状腺细丝参入蜘蛛卵袋覆盖层提供了直接的分子生物学证据。氨基酸组成与扫描电镜的结果分析表明,本文研究的两种蜘蛛的卵袋也含有葡萄状腺细丝。根据氨基酸R-基的性质将两种蜘蛛卵袋丝与拖牵丝所含的氨基酸分类汇总于表3。可以看出,与拖牵丝和卵袋框丝相比,尽管柱状腺丝蛋白小侧链丝氨酸的含量增加了,但同时一些大侧链氨基酸(如天冬氨酸、苏氨酸、缬氨酸、亮氨酸、苯丙氨酸)的含量也都增加了。因此,柱状腺丝的LC∶SC的比值为1.0左右(表3),均比拖牵丝和卵袋框丝的大。而家蚕蚕丝小侧链氨基酸的含量高达73.7%,远远高于蜘蛛拖牵丝,其LC∶SC比值远比蜘蛛丝小。小侧基氨基酸有利于结晶的形成,因此,计算LC∶SC比值的方法已被应用于预测丝蛋白结晶区与无定型区的相对含量[48]。根据这一方法,可预知卵袋丝(柱状腺丝)比拖牵丝和卵袋框丝含有更多的无定型区。此外,本文研究的悦目金蛛和棒络新妇卵袋框丝的LC∶SC比值分别为0.79和0.85(表3),比Casem等[34]报道的L.hesperus圆网框丝的0.37要大,表明了不同种类蜘蛛的大壶状腺丝氨基酸组成和蛋白结构的多样性。虽然卵袋框丝与拖牵丝氨基酸组成相似,但卵袋框丝中小侧基氨基酸的含量较拖牵丝少而极性氨基酸的含量高于拖牵丝,脯氨酸的含量也比拖牵丝低。分子生物学的研究[10,22,41]表明,络新妇蛛(Nephila clavipes)大壶状腺至少含有两种上皮细胞,分别分泌MaSp1与MaSp2这两种丝心蛋白家族成员,MaSp1不含有脯氨酸,MaSp2富含脯氨酸。当MaSp2流经膨大区时,MaSp1分泌出来与MaSp2以不同比例混合,再流经导管至纺管最后纺出[49]。因此,从脯氨酸的含量来看,棒络新妇卵袋框丝比拖牵丝含有较多的MaSp1。而十字园蛛(Araneus diadematus)的MaSp1与MaSp2都富含脯氨酸,因此与十字园蛛亲缘关系较近的悦目金蛛的拖牵丝比卵袋框丝可能含有较多低含量脯氨酸的其它丝心蛋白。
3.3 红外光谱分析
酰胺Ⅰ(约1,650 cm-1)和Ⅱ(约1,540 cm-1)的峰通常被认为是无序结构的贡献,表明可能含有自由卷曲结构和/或α-螺旋,这些结构形成无定型区,这种非结晶结构赋予丝纤维的延展性;而酰胺Ⅱ(约1,520 cm-1)和酰胺Ⅲ(约1,230 cm-1)的峰则被认为与β-折叠有关,而1,690 cm-1附近的吸收峰可能是与β-折叠结构有关的β-转角(β-turn)或β-弯曲(β-bend)的吸收峰,这些结构形成结晶区,这种结晶结构赋予丝纤维的高模量和高强力[50,51]。另外,β折叠分子的酰胺Ⅴ特征谱带[17]约在700 cm-1处,而α-螺旋分子的酰胺Ⅴ特征谱带约在600 cm-1。
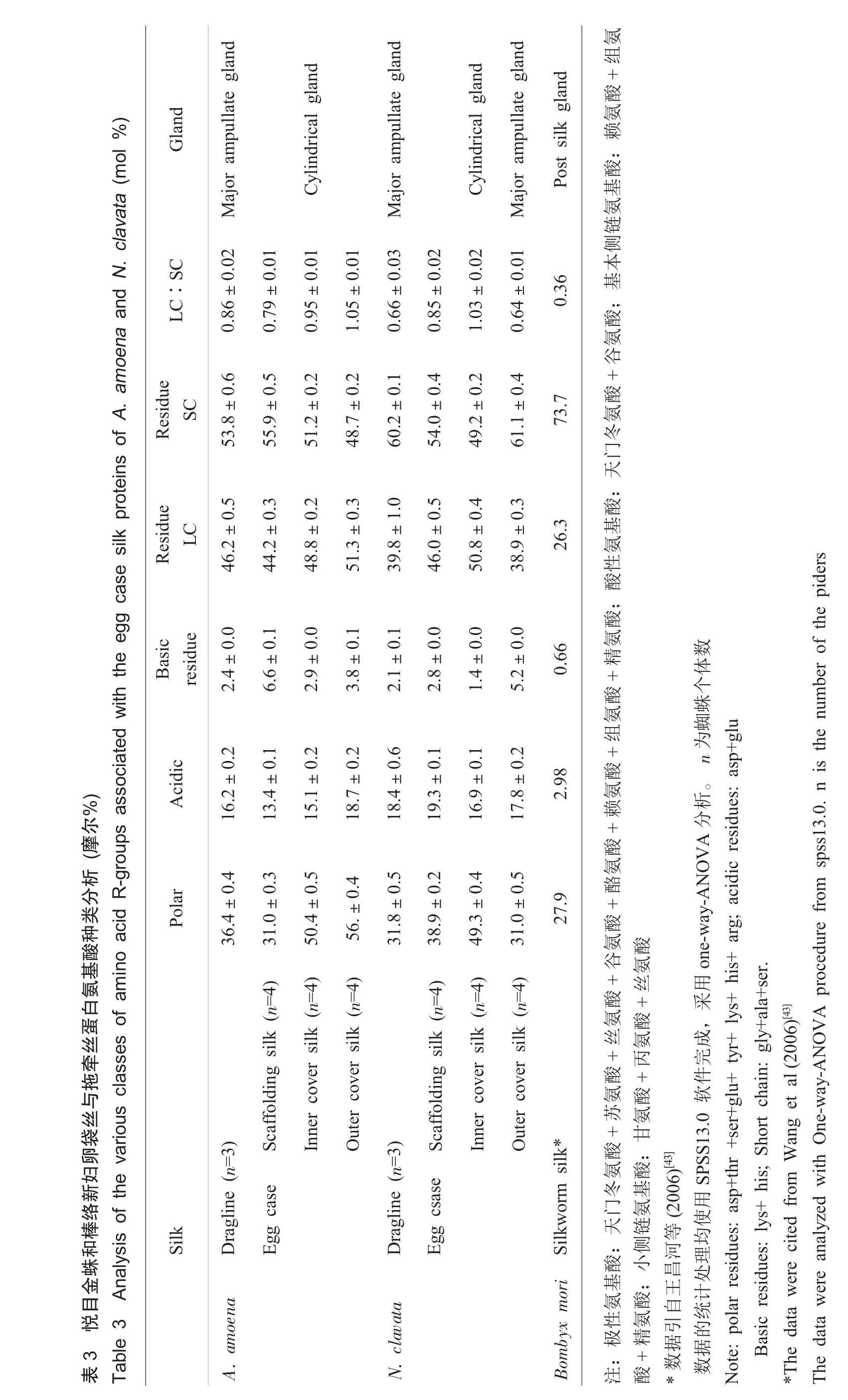
表3悦目金蛛和棒络新妇卵袋丝与拖牵丝蛋白氨基酸种类分析(摩尔%) T a b le 3 A n a lysis o f th e va rio u s c la sse s o f a m in o a cid R -g ro u p s a s so cia te d w ith th e e g g ca se s注:极性氨基酸:天门冬氨酸+苏氨酸+丝氨酸+谷氨酸+酪氨酸+赖氨酸+组氨酸+精氨酸;酸性氨酸+精氨酸;小侧链氨基酸:甘氨酸+丙氨酸+丝氨酸*数数据引自王昌河等(2006)[43]据的统计处理均使用SP SS 13.0软件完成,采用on e-way-AN OV A分析。n为蜘蛛个体数N o te: p olar residues: asp + thr + ser+ glu + tyr+ lys+ his+ arg; acidic resid ues: asp+ glu B asic resid ues: lys+ his; S ho rt ch ain: gly+ ala+ ser. *T he data w ere cited fro m W an g et al (200 6) [43] T h e d ata w ere analyzed w ith O ne-w ay-A N O V A procedu re from spss13 .0 . n is the nu m ber of the p id ers S ilk P olar A cid ic B asic residue R e N . clavata D ragline (n = 3 ) 3 1.8± 0.5 1 8.4± 0.6 2 .1± 0.1 3 9.8 3 8.9± 0.2 19.3± 0.1 2 .8± 0.0 46.0 49.3± 0.4 16.9± 0.1 1 .4± 0.0 50.8 31.0± 0.5 17.8± 0.2 5 .2± 0.0 38.9 B om byx m ori S ilkw orm silk * 27 .9 2.98 0.66 2 A . am oena D ragline (n = 3) 36.4± 0.4 31.0± 0.3 50.4± 0.5 5 6.± 0.4 16.2± 0.2 13.4± 0.1 15.1± 0.2 18.7± 0.2 2 .4± 0.0 6 .6± 0.1 2 .9± 0.0 3 .8± 0.1 46.2 44.2 48.8 51.3 S caffo lding silk (n = 4) In ner co ver silk (n = 4 ) O uter cover silk (n = 4) S caffo lding silk (n = 4) In ner co ver silk (n = 4 ) O uter cover silk (n = 4) E gg case E gg csase
日本丰桥大学的Yasumasa Fukushima[50]设计了以X-Gly-Gly(X分别为Ala,Ty,Gln和Leu)为基序的4个肽链分子,作为蜘蛛拖牵丝富含Gly序列的模型。4种聚合分子的红外光谱研究表明,随着分子中β折叠含量的增加poly(Leu-Gly-Gly)<poly(Ala-Gly-Gly)<poly(Gln-Gly-Gly)=poly(Tyr-Gly-Gly),在波谱数约为1,695、1,520和1,626 cm-1处的吸收峰也随之增强;随着分子中无序结构的增加,酰胺Ⅰ(约1,650 cm-1)和酰胺Ⅱ(约1,540 cm-1)的吸收峰增加。以此为依据,悦目金蛛和棒络新妇袋框丝及棒络新妇拖牵丝(图3和5)均是由大壶状腺放出的,都有较强的多聚丙氨酸(polyA)吸收峰(约960 cm-1),在1,695 cm-1处均出现了吸收小峰,这表明它们具有相似的蛋白质二级结构,含有较多的β折叠和/或其它有序结构,如与β-折叠结构有关的β-转角(β-turn)或β-弯曲(β-bend)[51],以适应其高强力和高模量的功能要求,为卵袋提供了很好的固定与支持[37,39]。与卵袋框丝和拖牵丝相比,主要由柱状腺丝组成的卵袋覆盖层的多聚丙氨酸(polyA)吸收峰(约960 cm-1)很弱(图4),这表明其含有较多的自由卷曲结构和/或α-螺旋等无序结构,但在约1,695 cm-1处均不同程度地出现了吸收小峰;悦目金蛛卵袋内层丝与灰绿色外层丝还在1,626 cm-1处有吸收小峰;这又表明它们结构的有序性似乎也不差。与棒络新妇卵袋框丝和拖牵丝相比,棒络新妇的卵袋内层丝与悦目金蛛浅棕色外覆盖层丝在1,540 cm-1左右有明显的吸收小峰,这可能是卵袋覆盖层中葡萄状腺丝或梨状腺丝的贡献[33,47]。悦目金蛛人工抽拖牵丝的多聚丙氨酸(polyA)吸收峰(约960 cm-1)较弱,而在1,540与1,626 cm-1处出现了小峰,表明抽丝的条件对其蛋白质二级结构有重要影响。
Tian等[27]对金蛛(Argiope aurantia)和络新妇属蜘蛛(N.clavipes)的柱状腺丝蛋白的分子生物学研究表明,柱状腺丝主要成分丝心蛋白TuSp1含有Sn、(SA)n、(SQ)n和GX氨基酸基序,而几乎不含有大壶状腺丝所具有的An、(GA)n或(GPGXX)n、(GGX)n等基序。此外,虽然柱状腺丝蛋白ADF-2主要含有An和(GGX)n基序[23],但柱状腺丝氨基酸组成与其基序不符合,表明它是一种表达量很低的蛋白。本文中,悦目金蛛和棒络新妇的主要由柱状腺丝构成的卵袋覆盖层丝的酰胺Ⅲ(约1,230 cm-1)特征带的吸收峰强度都降低了,而且多聚丙氨酸(polyA)的吸收峰(约960 cm-1)都很弱,表明柱状腺丝几乎不含有纺自大壶状腺的拖牵丝和卵袋框丝所具有的poly-Ala基序,非结晶结构含量较丰富,β-折叠结构的含量也降低,这与前面预测结果一致。此外,柱状腺丝的丝氨酸的含量有较大幅度的增加,而甘氨酸的含量同时大幅度减少(表1),脯氨酸的含量也很少,从而在化学结构表征上支持了上述分子生物学的研究结果。
3.4 卵袋丝力学性能
影响丝纤维力学性能的因素主要有两方面:1)丝纤维的结构,包括分子间/内的结构[38]。谷氨酸和脯氨酸对分子结构有重要作用。谷氨酸为酸性氨基酸,其侧基上的氨基和羧基使分子间的键合作用加强,而脯氨酸的存在将有利于分子链形成类似于β-转角的弹性螺旋状结构,使纤维的弹性增大[52]。大侧基氨基酸含量增加,会导致蛛丝结晶度下降;极性氨基酸含量增加,会导致分子间的作用力增强。由于卵袋内层丝含有比大壶状腺丝较多的大侧链氨基酸,而Pro的含量很少,因而在悦目金蛛和棒络新妇卵袋内层丝中,呈类似于β-转角的弹性螺旋状结构可能很少。虽然卵袋内层丝小侧基氨基酸含量少,几乎不含有poly-Ala基序,β-折叠结构的含量也降低,不利于结晶的形成,结晶度降低,非结晶结构含量较丰富,但大量的极性氨基酸使分子间的作用力增大。因此,从表2的力学性能参数可以看出,卵袋内层丝(特别是悦目金蛛卵袋内层丝)表现出良好的延展性、断裂强度和断裂能,屈服点也较高,增加了弹性形变区的投入,其力学性能并不逊色于卵袋框丝与拖牵丝。2)丝纤维的尺寸大小,即尺寸效应[38]。卵袋框丝直径变化大,且含有除大壶状腺丝以外的其它类型的细丝纤维,拉伸行为变化也较大,其单丝的拉伸行为的重复性较差,这表明蜘蛛除了能通过改变蛋白质分子结构,还能通过改变直径来调节丝纤维的力学性能,以适应卵袋所处的异质环境;而卵袋内层丝均为单丝纤维,且直径变化较小,其拉伸行为也表现出良好的重复性,这表明蜘蛛能通过某种机制来精确控制丝纤维的分子结构,以使其力学性能具有良好的重复性,适应卵块所处的同质稳定的微环境。
4 结论
纺自大壶状腺的拖牵丝和卵袋框丝的大侧链氨基酸含量低,甘氨酸和脯氨酸含量高,极性氨基酸和丝氨酸含量低,LC与SC比值小,多聚丙氨酸吸收峰较强,含有较多的β折叠和/或其它有序结构,结晶结构含量较丰富,以适应其高强力和高模量的功能要求,为卵袋提供了很好的固定与支持;而主要由柱状腺丝构成的卵袋覆盖层丝的大侧链氨基酸含量高,甘氨酸含量较低,脯氨酸的含量很低,极性氨基酸和丝氨酸含量较高,LC∶SC的值较高,多聚丙氨酸吸收峰很弱,β-折叠结构的含量降低,非结晶结构含量较丰富,满足其高延展性、高断裂能和较高强力的功能要求,为卵块或若蛛营造了稳定的微环境和安全的庇护所。因此,柱状腺丝是一种具有与大壶状腺丝完全不同的物理化学结构表征与力学性能的新型蛛丝纤维。
致谢:感谢四川省农业科学院分析测试中心氨基酸分析室的胡继楫研究员和罗晓梅老师。感谢四川大学分析测试中心红外光谱室的祝晓红老师和电镜室的王辉老师。感谢四川大学高分子科学与工程学院化纤研究所所长叶光斗教授、李守群高级工程师、刘晓慧老师对本研究提供的帮助。
1.Gosline J,Denny M,DeMont M.Spider silk as rubber. Nature,1984,309:551~552
2.Vollrath F.Spider webs and silk.Science,1992,266: 70~76
3.Hinman MB,StaufferSL,LewisRV.Mechanicaland chemical properties of certain spider silks.In:Kaplan D, Adams WW et al,Eds.Silk Polymers.Materials Science andBiotechnology.Washington:AmericanChemical Society,1994.222~233
4.Mahoney DV,Vezie DL,Eby RK,Adams WW,Kaplan D. Aspects of the morphology of dragline ofNephila clavipes. Materials Science and biotechnology,1994,544:196~210
5.Vollrath F,Holtet T,Thogersen H,Frische S.Structural organization of spider silk.Proc R Soc Lond,1996,263: 147~151
6.Frische S,Maunsbach AB,Vollrath F.Elongate cavities and skin-core structure inNephilaspider silk observed by electron microscopy.Journal of Microscopy,1998,189: 64~70
7.Miller L,Putthanarat S,Eby R,Adams W.Investigation of the nanofibrillar morphology in silk fibers by small angle X-ray scattering and atomic force microscopy.Int J Biol Macromol,1999,24:159~165
8.Putthanarat S,Eby RK.Aspects of the morphology of the silk of bombyx mori.J Macromol Sci Pure Appl Chem, 1996,A33:899~911
9.Robson RM.Microvoids in Bombyx mori silk.An electron microscopestudy.InternationalJournalofBiological Macromolecules,1999,24:145~150
10.Himan MB,Jones J A,Lewis RV.Synthetic spider silk:a modular fiber.TIBTECH,2000,18:374~379
11.Dong Z,Lewis RV,Middaugh CR.Molecular mechanisms of spider silk elasticity.Arch Biochem Biophys,1991,284: 53~57
12.Bram A,Branden CI,Craig C,Snigireva I,Riekel C.X-ray diffraction from single fibres of spider silk.J Appl Cryst, 1997,30:390~392
14.Valluzzi R,Jin HJ.X-ray evidence for a"super"-secondary structureinsilkfibers.Biomacromolecules,2004,5: 696~703
15.Shao ZZ,Vollrath F,Sirichaisit J,Young RJ.Analysis of spidersilkinnativeandsupercontractedstatesusing Raman spectroscopy.Polymer,1999,40:2493~2500
16.Sirichaisit J,Young RJ,Vollrath F.Molecular deformation in spider dragline silk subjected to stress.Polymers,1999, 41:1223~1227
17.Sirichaisit J,Brookes VL,Young RJ,Vollrath F.Analysis of structure/property relationships in silkworm(Bombyx mori) and spider dragline(Nephila edulis)silks using Raman spectroscopy.Biomacromolecules,2003,387(4):387~394
18.Beek JV,Kümmerlen D,Vollrath F,Meier BH.Solid state NMR on supercontracted spider dragline silk.Int J Biol Macromol,1999,24:173~178
19.Simmons A,Ray E,Jelinski LW.Solid state 13C NMR of N.cla6ipes dragline silk establishes structure and identity of crystalline regions.Macromolecules,1994,27:5235~ 5237
20.Simmons A,Michal C,Jelinski L.Molecular orientation and two-component nature of the crystalline fraction of spider dragline silk.Science,1996,271:84~87
21.Eles PT,Michal CA.A decoder NMR study of backbone orientation inNephila clavipesdragline silk under varying strain and draw rate.Biomacromolecules,2004,5:661~665
22.Hayashi CY,Shipley NH,Lewis RV.Hypotheses that correlatethesequence,structure,andmechanical properties of spider silk proteins.Int J Biol Macromol, 1999,24:271~275
23.Vollrath F.Strength and structure of spider'silks.Biological Macromolecules,2000,74:67~83
24.Vollrath F,Knight DP.Liquid crystalline spinning of spider silk.Nature,2001,410:541~548
25.尹长民(主编).中国动物志(蛛形纲:蜘蛛目:园蛛科).北京:科学出版社,1997 Yin CM(Eds).FaunaSinica:Araneidae.Beijing:Science Press,1997
26.蒋平,卓春晖,杨文博,郭聪.棒络新妇和悦目金蛛丝腺形态初步观察.蛛形学报,2006,15(2):90~97 Jiang P,Zhuo CH,Yang WB Zhuo CH,Guo C.Primary study on the morphologies of spiderNephila clavataand Argiope amoena silk glands.Acta Arachnologica Sinica, 2006,15(2):90~97
27.Tian M,Lewis RV.Tubuliform silk protein:a protein with unique molecular characteristics and mechanical properties in the spider silk fibroin family.Appl Phys A,2006,82: 265~273
28.Garb JE,Cheryl YH.Modular evolution of egg case silk genesacrossorb-weavingspidersuperfamilies.PNAS, 2005,102(32):11379~11384
29.BarghoutJYJ,ThielBL,VineyC.Spider(Araneus diadematus)cocoon silk:a case of non-periodic lattice crystals with a twist?International Journal ofBiological Macromolecules,1999,24:211~217
30.BarghoutJYJ,CzernuszkaJT,VineyC.Multiaxial anisotropyofspider(Araneusdiadematus)cocoonsilk fibres.Polymer,2001,42:5797~5800
31.Hayashi CY,Lewis RV.Evidence from flagelliform silk cDNA for the structural basis ofelasticity and modular nature of spider silks.J Mol Biol,1998,275:773~784
32.Guerette PA,Ginzinger DG,Weber BH,Gosline JM.Silk propertiesdeterminedbygland-specificexpressionofa spider fibroin gene family.Science,1996,272:112~115
33.Hayashi CY,Blackledge TA,Lewis RV.Molecular andmechanical characterization of aciniform silk:uniformity of iteratedsequencemodulesinanovelmemberofthe spider silk fibroin gene family.Mol Biol Evol,2004,21(10): 1950~1959
34.Casem ML,Turner D,Houchin K.Protein and amino acid compositionofsilksfromthecobweaver,Latrodectus hesperus(black widow).International Journal of Biological Macromolecules,1999,24:103~108
35.Foradori MJ,Kovoor J,Moon MJ,Tillinghast EK.Relation betweentheoutercoveroftheeggcaseofArgiope aurantia(Araneae:Araneidae)and the emergence of its spiderlings.Jounal of Morphology,2002,252:218~226
36.潘志娟,李春萍,刘敏,盛家镛.李栋高.大腹园蛛包卵丝的化学组成与物理机械性能.东华大学学报(自然科学版),2002, 28(4):34~39 Pan ZJ,Li CP,Liu M,Sheng JY,Li DG.Amino acid composition and physical mechanical properties ofAraneus ventricosusspideregg-casesilk.JournalofDonghua University,Natural Science,2002,28(4):34~39
37.蒋平,肖永红,周兵,廖信军,郭聪.悦目金蛛卵袋结构与组成.动物学报,2008,54(5):918~927 Jiang P,Xiao Y.H,Zhou B,Liao XJ,Guo C.Structure and compositionofthespiderArgiopeamoenaeggcase. China Acta zoology,2008,54(5):918~927
38.Jiang P,Liu HF,Wang CH,Huang JG,Wu LZ,Guo C. Tensile behavior and morphology of differently degummed silkworm cocoon silk fibres.Materials letters,2006,(60): 919~925
39.蒋平,沈丽,杨孔,冉丹,郭聪.三种类型蜘蛛丝的结构及生物学功能.动物学杂志,2003,38(5):10~14 Jiang P,Shen L,Yang K,Ran D,Guo C.Structure and biological function of three types of spider silk.Chinese Journal of Zoology,2003,38(5):10~14
40.Pe'rez-Rigueiro J,Elices M,Llorca J,Viney C.Tensile properties ofArgiope trifasciatadrag line silk obtained from the spider's web.Journal ofApplied Polymer Science, 2001,82:2245~2251
41.Gosline JM,Guerette PA.The mechanical design of spider silk:from fibroin sequence to mechanical function.Journal of Experimental Biology,1999,202:3295~3303
42.Pe'rez-Rigueiro J,Elices M,Llorca J,Viney C.Effect of degumming on the tensile properties of silkworm(Bombyx mori)silk fiber.Journal of Applied Polymer Science,2002, 84:1431~1437
43.王昌河,蒋平,刘辉芬,吴灵芝,郭聪.转蜘蛛拖牵丝蛋白基因家蚕蚕丝氨基酸组成及其机械性能.四川动物,2006,25: 451~454 Wang CH,Jiang P,Liu HF,Wu LZ,Guo C.Amino acid compositionandtensilepropertiesofcocoonsilkfrom transgenic silkworm(Bombyx mori)with synthetic MaSpI gene.Sichuan Journal of Zoology,2006,25:451~454
44.潘志娟,朱美男.原子力显微镜下蚕丝及蜘蛛丝的微观结构.材料科学与工程学报,2005,23(3):365~368 Pan ZJ,Zhu MN.Microstructures of bombyx mori silk and spider silk revealed by atomic force microscopy.Journal of Materials Science&Engineering,2005,23(3):365~368
45.Blackledge TA,Hayashi CY.Silken toolkits:biomechanics of silk fibers spun by the orb web spiderArgiope argentata (Fabricius 1775).Journal of Experimental Biology,2006, (209):2452~2461
46.Gheysens T,Beladjal L,Gellynck K,van Nimmen E,van Langenhove L,Mertens J.Egg sac structure ofZygiella x-notata(arachnid,araneid).The Journal of Arachnology, 2005,33:549~557
47.Vasanthavada K,Hu X,Falick AM,La Mattina C,Moore AM,Jones PR,Yee R,Reza R,Tuton T,Vierra C. Aciniform spidroin,a constituent of egg case sacs and wrappingsilkfibersfromtheblackwidowspider Latrodectus hesperus.J Biol Chem,2007,30,282(48): 35088~35097
48.Lombardi SJ,Kaplan DL.The amino acid composition of major ampullate gland silk(dragline)ofNephilacla6ipes (Araneae,Tetragnathidae).J Arachnol,1990,18:297~306
49.Dicko C,Vollrath F,Kenney JM.Spider silk protein refolding is controlled by changing pH.Biomacromolecules, 2004,5:704~710
50.Fukushima Y.Secondary structural analysis in the solid state for analogous sequential polypeptides of glycine-rich sequence of spider dragline silk.Polymer Bulletin,2000, 45:237~244
51.周文,陈新,邵正中.红外和拉曼光谱用于对丝蛋白构象的研究.化学进展,2006,18(11):1514~1522 Zhou W,Chen X,Shao ZZ.Conformation studies of silk proteins with infrared and Raman spectroscopy.Progress In Chemistry,2006,18(11):1514~1522
52.Savage KN,Gosline JM.The effect of proline on the network structure of major ampullate silks as inferred from their mechanical and optical properties.The Journal of Experimental Biology,2008,211:1937~1947
Abstract:Spider silk is the result of 400 million years of evolution and an attractive natural animal protein fibers for its excellent mechanical properties.The biological function and spider life history have shaped the silk structures and mechanical properties.Here the authors examined the egg case silks from the orb web spider,Argiope amoenaandNephila clavataby the automatic amino acid analyzer,SEM,FTIR and electric single-fiber tensile apparatus with the goal of expanding our understanding of the relationship between the structure,mechanical performance and biological function of these unique biomaterials.The results indicated that the egg case of these two spiders was composed of the micron-sized cylindrical and major ampullate silk and submicron-sized or nanoscale aciniform silk.The physical(e.g.diameter,morphologies),amino acid composition(e.g.polar,glycine,serine,proline,large and small side chains amino acid)and secondary structure(e.g.β-sheet crystalline,amorphous domains)characteristics of egg case silk all matched to the mechanical(e.g.break strength,extensibility,initial modulus)requirements for their biological or ecological functions respectively.
Key Words:Spider;Egg case silk;Physico-chemical structure;Mechanical properties
Physico-Chemical Structural Characterizations and Mechanical Properties of Egg Case Silk from The Two Spiders:Argiope amoena andNephila clavata
JIANG Ping1,LV Taiyong1,XIAO Yonghong1,ZENG Jianzhong1, ZHOU Bing1,GUO Cong2
1 College of Life Sciences,Jinggangshan University,Ji'an,Jiangxi 343009,China;
2 Key Laboratory of Bio-resources and Eco-environment,Ministry of Education,College of Life Sciences, Sichuan University,Chengdu 610064,China
Q957,Q956
2009-08-14;接受日期:2010-01-04
国家自然科学基金项目(30760041);江西省教育厅科技项目(GJJ08422,GJJ08423);江西省自然科学基金项目(2007GQN1690)
蒋平,电话:(0796)8100493,E-mail:jping412@yahoo.com.cn
Thisworkwassupportedby grantsfromTheNationalNaturalScienceFoundationofChina(30760041),TheEducation Department of Jiangxi province(GJJ08422,GJJ08423)and The Natural Science Foundation of Jiangxi province(2007GQN1690)
Received:Aug 14,2009Accepted:Jan 4,2010
Corresponding author:JIANG Ping,Tel:+86(796)8100493,E-mail:jping412@yahoo.com.cn