围产期食物限制对子代成年大鼠海马CA1区突触可塑性的影响
2010-09-13张引国李宁杨佳佳张涛杨卓
张引国,李宁,杨佳佳,张涛,杨卓
1.南开大学生命科学学院,生物活性材料教育部重点实验室,天津300071;
2.南开大学医学院,天津300071
围产期食物限制对子代成年大鼠海马CA1区突触可塑性的影响
张引国1,李宁2,杨佳佳1,张涛1,杨卓2
1.南开大学生命科学学院,生物活性材料教育部重点实验室,天津300071;
2.南开大学医学院,天津300071
围产期食物限制导致子代大鼠学习和记忆能力等的神经生物学变化,但其机制并不清楚。将成年Wistar雌性大鼠与雄性大鼠同笼,受孕后随机分为对照组(n=9)和食物限制组(n=8)。对照组母鼠在妊娠期和哺乳期自由进食和饮水,食物限制组母鼠从妊娠的第7天到子代大鼠出生后21天进行食物限制,食物限制量为对照组大鼠的50%。子代雄性大鼠成年后,通过Morris水迷宫测试空间学习和记忆能力。之后,在海马CA1区在体记录场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP),并采用免疫组织化学方法观察海马CA1区神经元型一氧化氮合酶(nNOS)阳性细胞密度的变化。结果表明,围产期食物限制降低了子代大鼠出生后第1、7、10、14和21天的体重,并减弱了成年子代大鼠的学习和记忆能力,海马CA1区fEPSP的斜率和nNOS阳性细胞的密度也明显降低。结果提示,围产期食物限制可能通过抑制NO的产生降低了海马突触可塑性,从而影响了子代大鼠的学习和记忆能力。
海马;学习和记忆;长时程增强;一氧化氮;食物限制;围产期
0 引言
成年和老年食物限制可以产生许多有益的生物学效应,包括延长生命周期[1,2]、延缓衰老和疾病的进程[3,4]、提高学习和记忆能力[5,6]及降低药物毒性等。然而,围产期食物限制可导致胎儿宫内发育受限(intrauterine growth restriction,IUGR),主要表现为动物出生后体重降低、生长缓慢、神经发育延迟[7,8],以及成年社会行为[9]和空间学习能力下降[10]等。
在中枢神经系统中,海马属边缘系统,与学习和记忆能力密切相关。有证据表明,海马CA1区对于空间信息的获得、巩固和存储是必需的[11,12]。长时程增强(long-term potentiation,LTP)是中枢神经系统重要的可塑性形式,一直被认为是学习与记忆的神经基础之一[13]。LTP作为衡量海马神经突触可塑性的重要指标,己被广泛应用。
海马CA1区LTP的诱导和维持需要兴奋性神经递质谷氨酸的释放。一氧化氮(nitric oxide,NO)作为一种逆向信使,促进突触前神经元谷氨酸的释放,从而易化了在突触后神经元上记录的LTP[14]。
本研究采用Morris水迷宫测试和电生理实验方法,分别观察围产期食物限制对子代成年大鼠学习与记忆能力和海马CA1区LTP的影响,并进一步用免疫组化方法观察海马CA1区神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)阳性细胞的密度,以期从突触可塑性的角度研究围产期食物限制影响子代空间学习和记忆能力的机制。
1 材料与方法
1.1 实验对象
健康成年13周龄Wistar大鼠,购于军事医学科学院实验动物中心。动物适应3天后,将雌鼠与雄鼠同笼(雌雄比为2~3∶1)饲养。之后,每日早晨检查雌鼠阴道口或阴道涂片,若发现阴道栓或涂片中有大量的精子存在,则记为大鼠妊娠第0天(gestation day 0,E0)。称其体重,分笼喂养。此后于妊娠的E7、E14和E21测定孕鼠体重,妊娠期共测4次体重。
1.2 分组及模型制备
妊娠大鼠随机分为对照组(n=9)和食物限制组(n=8)。对照组自由摄食,并记录每日饲料消耗量。食物限制组从妊娠的E0到E6自由摄食,从妊娠的E7到仔鼠出生的21天(postnatal day 21,PD21)进行食物限制,食物限制量为对照组大鼠每日平均饲料消耗量的50%[7]。两组孕鼠均予充足饮水。大鼠自然分娩的当天记为仔鼠出生的PD0,分别于仔鼠出生的PD1、PD7、PD10、PD14和PD21称重。
1.3 空间学习与记忆能力测试
子代大鼠成年(PD70)后进行水迷宫行为学实验。Morris水迷宫装置为一直径150 cm、高60 cm的圆形水池。水温保持在(24±1)℃。将水池等分为东、南、西、北四个象限,以其中一个象限作为目标象限,在其正中放有一个直径10 cm的圆形平台,平台低于水面2 cm。将安装好的摄像装置与计算机连接,大鼠的运动轨迹及测试结果均显示在计算机上。训练期间水迷宫外参照物保持不变,即视觉线索保持不变。Morris水迷宫的测试包括定位航行(place navigation test)和空间探索(probe trial performance)两个实验。定位航行实验历时5天,每天分上、下午两个时间段训练。在每个时间段训练4次,分别从4个坐标象限的中点将大鼠面向池壁放入水中,记录大鼠找到平台的时间,即逃避潜伏期(escape latency)。若在120 s内找不到平台,则将大鼠引导到平台上并保持15 s。每次训练结束后擦干大鼠身体,放入各自的鼠笼内并适当给予保暖。第6天撤除平台作空间探索实验,选与平台象限相对象限的中点为入水点,将大鼠放入水中,记录120 s内大鼠跨越平台的次数及在目标象限的搜索时间百分比。
1.4 海马CA1区LTP记录
大鼠腹腔注射戊巴必妥钠(50 mg/kg)麻醉后,固定于立体定位仪上,用电热毯保温。记录电极和刺激电极均用直径75 μm的不锈钢绝缘丝制成,尖端裸露。单极记录电极垂直插入海马CA1区锥体细胞树突丛(前囟后3.4 mm,中线旁开2.5 mm),双极刺激电极插入同侧海马Schaffer侧枝(前囟后4.2 mm,中线旁开3.5 mm)[15]。调整记录电极和刺激电极的深度,直至记录到最大场兴奋性突触后电位(覱eld excitatory postsynaptic potential,fEPSP)为止。
以波宽0.2 ms、频率0.033 Hz的测试刺激,作用于大鼠海马CA3区Schaffer侧枝,诱导海马CA1区锥体细胞树突丛fEPSP。以fEPSP幅度的50%的电流强度作为最适刺激强度。记录30 min fEPSP后进行高频刺激。高频刺激由10串200 Hz的方波组成,串间隔2 s。之后,用相同的波宽(频率0.033 Hz)记录120 min fEPSP。用Clampfit 9.0软件分析fEPSP的斜率。
1.5 nNOS免疫组织化学检测
大鼠经左心室先后灌入0.9%生理盐水和含4%多聚甲醛的0.1 mol/L磷酸缓冲液(pH 7.4)固定液,取出全脑,入上述固定液中后固定。连续冠状切片(厚50 μm)。采用链霉亲合素-生物素-过氧化物酶复合物(ABC)法进行免疫组织化学染色。切片移入37℃0.3%H2O2和1%Triton X-100中孵育30 min,磷酸缓冲液漂洗后,以5%的羊血清封闭30 min,然后加nNOS抗体(1∶200,Santa Cruz公司),4℃温盒内孵育72 h。磷酸缓冲液漂洗后加生物素标记的兔抗羊血清(1∶200),于37℃孵育1 h,ABC液(1∶100,Vector公司)37℃孵育1 h。之后用0.5 ml/L的DAB显色。镜下控制反应时间5~10 min。常规裱片,脱水,透明,封片。置光学显微镜下观察海马CA1区nNOS阳性神经元密度。
1.6 统计学分析
所有数值用平均数±标准误(M±SEM)表示。采用SPSS 16.0统计软件进行分析。体重和逃避潜伏期采用重复方差分析,其它(跨越平台的次数、在目标象限的搜索时间、游泳速度、fEPSP斜率及nNOS阳性神经元密度)采用t检验。fEPSP斜率表示为基准值的百分比(基准值为高频刺激前30 min fEPSP斜率的平均值)。P<0.05被认为有显著性差异。
2 结果
2.1 围产期食物限制对孕鼠和子代大鼠体重的影响
由表1可知,食物限制组孕鼠在E1和E7的体重与对照组无明显差异,但在E14和E21呈负增长,与对照组有显著性差异。这显然与食物摄入限制开始时间密切相关。另外,食物限制组子代大鼠在PD1、PD7、PD10、PD14和PD21的体重也明显小于对照组(表2)。
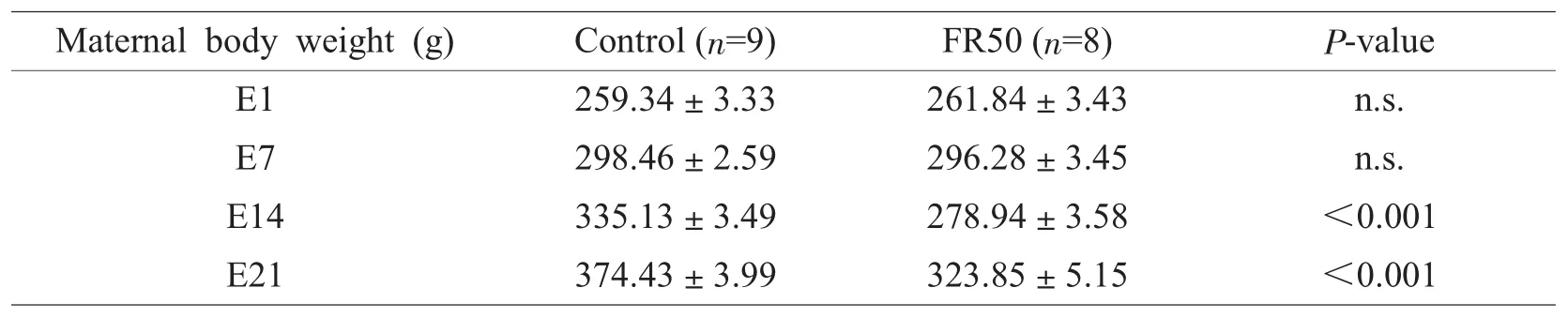
表1 围产期食物限制(FR50)对孕鼠体重(克)的影响Table 1Effect of perinatal food restriction(FR50)on body weight(g)of dam
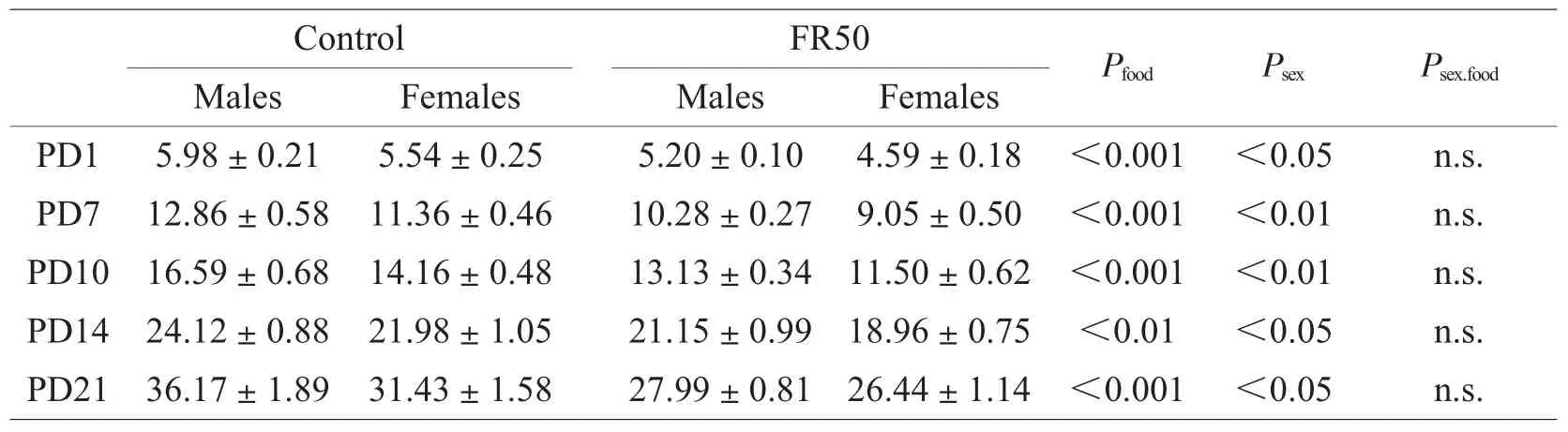
表2 围产期食物限制(FR50)对仔鼠体重(克)的影响Table 2Effect of perinatal food restriction(FR50)on mean pup body weights(g)
2.2 围产期食物限制对子代成年大鼠水迷宫学习与记忆行为的影响
实验在对照组雄性子代大鼠(n=9)和食物限制组雄性子代大鼠(n=8)上进行。大鼠经连续5天训练,无论是对照组还是食物限制组子代大鼠,其逃避潜伏期均呈缩短趋势(图1),这一现象表明大鼠空间学习能力随训练次数增加而有所增强。食物限制组子代大鼠的逃避潜伏期在训练的第2、3、4和5天均明显大于对照组,表明围产期食物限制明显减弱子代大鼠的空间学习能力。
为进一步观察围产期食物限制对子代大鼠记忆能力的影响,检测了大鼠跨越平台的次数及在目标象限的搜索时间百分比。二者均反映大鼠对平台所在位置的记忆保持能力。正常组子代大鼠跨越平台(6.3±0.75)次,而食物限制组跨越平台(4.2±0.41)次,两者有显著差异(P<0.05)(图2)。正常组子代大鼠在目标象限的搜索时间百分数为44.6%±2.1%,而食物限制组在目标象限的搜索时间百分数为36.2%±2.5%,显然两者差异明显(P<0.01)(图3)。结果表明围产期食物限制对子代大鼠空间记忆能力也有显著的抑制作用。
两组大鼠6天的平均游泳速度无明显差异,表明子代大鼠学习和记忆能力的变化并非运动能力差异及其它非特异性因素造成的(图4)。
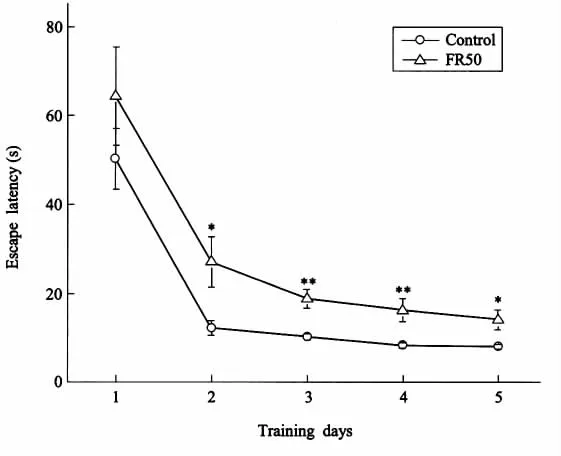
图1 定位航行中的平均逃避潜伏期围产期食物限制(FR50)引起成年子代大鼠在训练的第2(P<0.05)、3(P<0.01)、4(P<0.01)和5天(P<0.05)需较长的时间到达隐蔽平台。在训练的第1天到达平台的时间与对照组相比无明显差异。*P<0.05,**P<0.01,食物限制组与对照组比较Fig.1Mean escape latency in place navigationPerinatal food restriction(FR50)caused adult offspring rats to spend longer time(second)to escape onto a hidden platform on training day 2(P<0.05),day 3(P<0.01),day 4(P<0.01)and day 5(P<0.05).There was no difference on training day 1 compared with the control group,*P<0.05,**P<0.01,FR50 group vs.control group
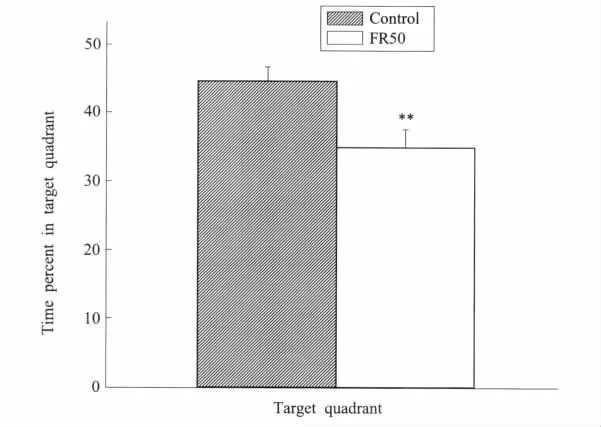
图2 空间探索中目标象限的平均搜索时间百分比围产期食物限制(FR50)子代大鼠在目标象限明显停留较少的时间。**P<0.01,食物限制组与对照组比较Fig.2Mean percent of time spent in the target quadrant in spatial probeThe offspring rats in perinatal food restriction(FR50)rats spent significantly less time in target quadrant,**P<0.01,FR50 group vs.control group
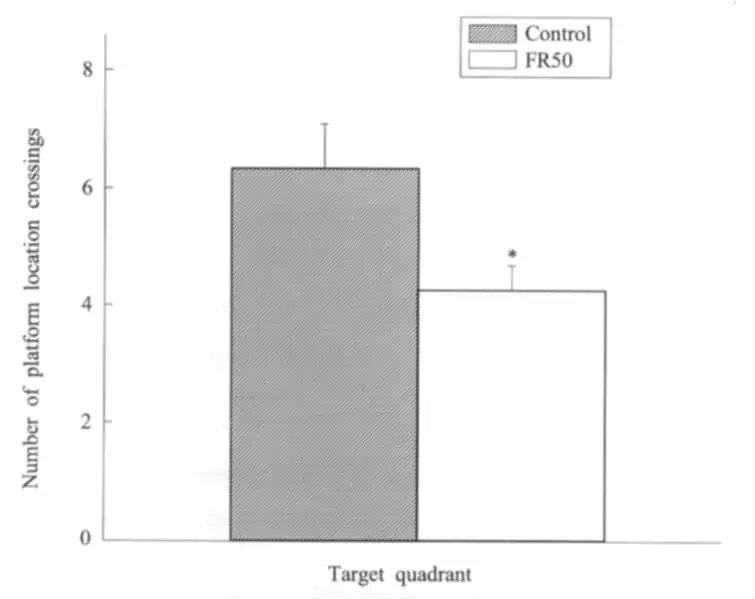
图3 空间探索中跨越平台位置的次数围产期食物限制(FR50)子代大鼠与对照组相比跨越平台位置的次数较少。*P<0.05,食物限制组与对照组比较Fig.3The mean of number of platform location crossings in spatial probeThe offspring rats in perinatal food restriction(FR50)group crossed the location of platform fewer times than the control group,*P<0.05,FR50 group vs.control group
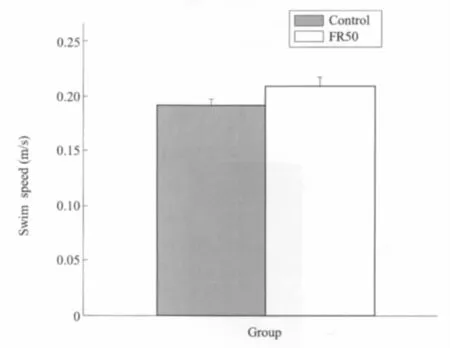
图4 Morris水迷宫中的平均游泳速度围产期食物限制(FR50)子代大鼠与对照组相比无明显差异Fig.4Mean swim speed in the Morris water mazeThere was no difference in mean swim speed of offspring rats between perinatal food restriction(FR50)group and the control group
2.3 围产期食物限制对海马CA1区LTP的影响
实验分别在6只对照组和食物限制组子代大鼠上进行。在高频刺激前,正常组大鼠fEPSP斜率的基准值为100.8%±1.4%,食物限制组大鼠fEPSP斜率的基准值为100.1± 3.4%,二者均无显著差异(P>0.05)。高频刺激后,正常组大鼠fEPSP斜率为150%±14%,食物限制组大鼠fEPSP斜率为119%±11%,二者有显著差异(P<0.01)(图5)。
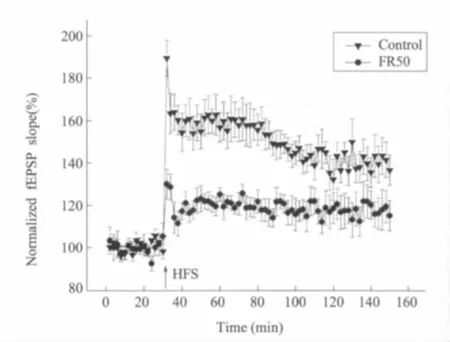
图5 围产期食物限制(FR50)和对照组子代成年大鼠海马CA1区长时程增强的场兴奋性突触后电位斜率的比较箭头(在30分钟时)表示应用高频刺激,以波宽为0.2 ms、频率为0.033 Hz的刺激作用于Schaffer侧枝诱发场兴奋性突触后电位(fEPSP)。fEPSP的斜率表示为基准值的百分比,每只动物每两分钟记录的fEPSP斜率平均为一个点,误差线为平均数的标准误,食物限制的子代大鼠其海马CA1区长时程增强的fEPSP斜率降低Fig.5The fEPSP slopes of LTP in the hippocampcal CA1 area of adult control and perinatal food restriction(FR50)offspring ratsArrow at 30 min indicates application of HFS,fEPSPs were evoked by a 0.2 ms stimulus to the Schaffer collaterals at 0.033 Hz,fEPSP slopes were normalized as percent of baseline values and averaged in 2-min bins for individual animals,error bars represent standard errors of the group means,FR50 offspring rats showed a decreased fEPSP slope of LTP in hippocampal CA1 area
2.4 围产期食物限制对子代大鼠海马CA1区nNOS阳性神经元密度的影响
实验在9只对照组雄性子代大鼠和8只食物限制组雄性子代大鼠上进行。对照组子代大鼠海马CA1区nNOS阳性神经元密度为(17.78±3.76)/mm2,食物限制组大鼠海马CA1区nNOS阳性神经元密度为(12.73±1.72)/mm2,差异有统计学意义(P<0.01)(图6,图7)。
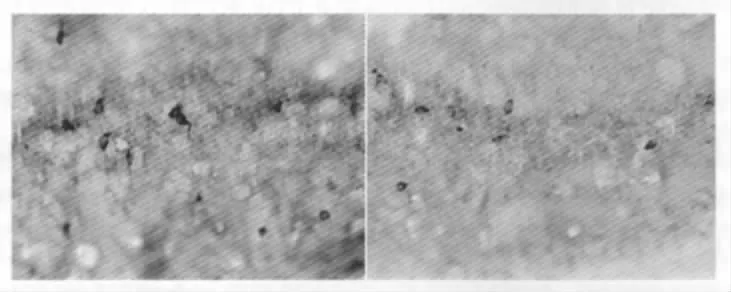
图6 用免疫组化方法观察的成年子代雄性大鼠海马CA1区神经元型一氧化氮合酶(nNOS)阳性细胞的分布(×400)左光镜图示对照组的nNOS阳性细胞;右光镜图示食物限制组的nNOS阳性细胞。食物限制降低了海马CA1区nNOS阳性细胞密度Fig.6The distribution of neuronal NOS(nNOS)-positive cells in the CA1 of the hippocampus in adult male offspring rat using immunohistochemical method(×400)(Left)Light field photomicrographshowingthenNOS-positivecellsinthecontrolgroup;(Right)Lightfield photomicrograph showing the nNOS-positive cells in the FR50 group.FR50 decreased the density of nNOS-positive cells in CA1 area of hippocampus
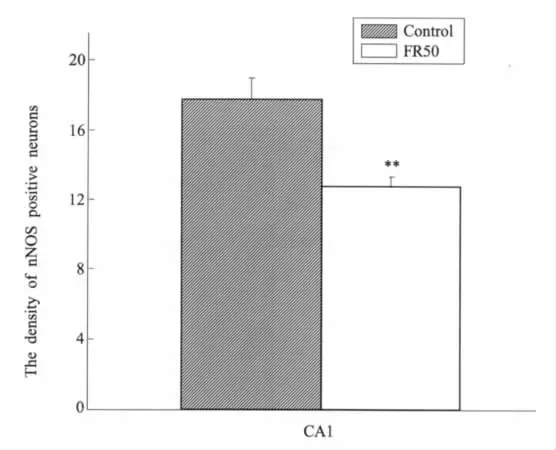
图7 海马CA1区nNOS阳性细胞密度(数目/mm2)食物限制组海马CA1区nNOS阳性细胞密度低于正常组。**P<0.01,食物限制组与正常组比较Fig.7The density of nNOS positive cells(the number/per mm2)in the CA1 areas of hippocampusThere was less density in nNOS-positive cells within CA1 area of hippocampus in FR50 group than those of the control group.**P<0.01,FR50 group vs.control group
3 讨论
Morris水迷宫所检测的是,大鼠在多次训练中学会寻找位置固定的隐蔽平台,形成稳定的空间位置认知的能力。这种空间认知是通过加工空间信息(外界参照物)形成的,是一种以空间坐标系为参照的认知(allocentric cognition),所形成的记忆是一种空间参考记忆(reference memory)。从信息的加工和提取方式来看,这种空间参考记忆进入意识系统,其储存的机制主要涉及边缘系统(如海马)和大脑皮层相关脑区。因此,Morris水迷宫是一种研究与海马功能直接相关的空间学习和记忆的模型,能较准确地反映动物的空间学习和记忆能力。
本研究中,对两组子代成年大鼠所进行的Morris水迷宫行为检测结果显示,围产期食物限制可明显抑制子代大鼠的学习与记忆能力。学习和记忆不是一种有或无的现象,而是一个过程。大鼠在水迷宫训练中,刺激(被放入水池中)与反应(辨认空间物体寻找平台)之间形成了联系,并产生相关记忆。本实验结果显示,两组大鼠经过多次的水迷宫训练后,其逃避潜伏期都明显缩短。与对照组子代成年大鼠相比,食物限制组子代大鼠在训练的第2、3、4和5天寻找平台的潜伏期明显延长,表现了较弱的学习能力。食物限制组子代大鼠跨越平台的次数及在目标象限的搜索时间也均明显小于对照组子代大鼠,表明围产期食物限制同样降低了子代的记忆能力。
LTP作为突触可塑性的一种表现,具有时程长和联合的性质。不少学者把LTP与学习和记忆联系起来,认为它是学习和记忆功能的可能机制之一。在海马的三突触联系环路中,CA1区LTP与通过Morris水迷宫检测的空间学习和记忆能力高度相关。在本研究中,食物限制组子代大鼠空间学习和记忆能力的下降及海马CA1区LTP抑制,表明围产期食物限制造成子代大鼠空间学习和记忆能力的下降与海马CA1区突触可塑性降低有关。
LTP的诱导和维持需要多种物质,NO作为细胞内信使被认为参与了这一复杂过程。NOS是NO产生的限速酶。不同的NOS催化产生的NO在不同组织细胞中发挥着不同的生物学作用。由nNOS产生的NO在学习和记忆过程中起着重要作用[16]。NO从突触后神经元释放后扩散到突触前神经元,增加突触前神经元谷氨酸的释放,导致突触后膜上的NMDA受体和AMPA受体激活,从而易化了LTP的诱导和维持。由于NO半衰期很短,直接测定尚存在技术困难,因此多采用检测NOS的方法间接反映细胞中的NO含量。本研究中,食物限制组子代大鼠海马CA1区nNOS密度降低,提示海马CA1区神经元合成NO的能力下降,这可能是食物限制组子代大鼠海马CA1区LTP抑制的原因之一。
营养是生命与健康的物质基础。充足的营养是保证机体正常发育和行使正常功能的前提。围产期是机体生长发育的关键时期,也是生命过程中对营养状况最为敏感的时期。若该期营养不良,会导致子代长期的甚至不可逆的损害效应[17,18]。我们的研究结果表明,围产期食物限制可能通过抑制NO的产生降低了海马突触可塑性,从而对大鼠学习和记忆能力产生影响。由于动物的学习和记忆能力的形成与人类具有一定的相似性,因此本研究可为认识围产期食物限制对人类智力的影响提供参考。
1.Fontana L.The scientific basis of caloric restriction leading to longer life.Curr Opin Gastroenterol,2009,25(2): 144~150
2.Bonorden MJ,Rogozina OP,Kluczny CM,Grossmann ME, Grambsch PL,Grande JP,Perkins S,Lokshin A,Cleary MP.Intermittent calorie restriction delays prostate tumor detection and increases survival time in TRAMP mice.Nutr Cancer,2009,61(2):265~275
3.DuanW,MattsonMP.Dietaryrestrictionand 2-deoxyglucose administration improve behavioral outcome andreducedegenerationofdopaminergicneuronsin models of Parkinson’s disease.J Neurosci Res,1999, 57(2):195~206
4.Yu ZF,Mattson MP.Dietary restriction and 2-deoxyglucose administrationreducefocalischemicbraindamageand improve behavioral outcome:evidence for a preconditioning mechanism.J Neurosci Res,1999,57(6):830~839
5.Ingram,DK,Weindruch R,Spangler EL,Freeman JR, Walford RL.Dietary restriction benefits learning and motor performance of aged mice.J Gerontol,1987,42(1):78~81
6.Stewart J,Mitchell J,Kalant N.The effects of life-long foodrestrictiononspatialmemory inyoungandaged Fischer 344 rats measured in the eight-arm radial and the Morriswatermazes.NeurobiolAging,1989,10(6): 669~675
7.Carney EW,Zablotny CL,Marty MS,CrissmanJW, Anderson P,Woolhiser M,Holsapple M.The effects of feed restriction during in utero and postnatal development in rats.Toxicol Sci,2004,82(1):237~249
8.Simonson M,Sherwin RW,Anilane JK,Yu WY,Chow BF. Neuromotor development in progeny of underfed mother rats.J Nutr,1969,98(1):18~24
9.Govic A,Kent S,Levay EA,Hazi A,Penman J,Paolini AG.Testosterone,social and sexual behavior of perinatally andlifelongcalorierestrictedoffspring.PhysiolBehav, 2008,94(3):516~522
10.Ranade SC,Rose A,Rao M,Gallego J,Gressens P, Mani S.Different types of nutritional deficiencies affect different domains of spatial memory function checked in a radial arm maze.Neuroscience,2008,152(4):859~866
11.Okada T,Yamada N,Tsuzuki K,Horikawa HP,Tanaka K, Ozawa S.Long-term otentiation in the hippocampal CA1 areaanddentategyrusplaysdifferentrolesinspatial learning.Eur J Neurosci,2003,17(2):341~349
12.Remondes M,Schuman EM.Role for a cortical input to hippocampal area CA1 in the consolidation of a long-term memory.Nature,2004,431(7009):699~703
13.Bliss TV,Collingridge GL.A synaptic model of memory: long-term potentiation in the hippocampus.Nature,1993, 361(6407):31~39
14.Bon CL,Garthwaite J.On the role of nitric oxide in hippocampallong-termpotentiation.JNeurosci,2003,23(5):1941~1948
15.Cao J,Chen N,Xu T,Xu L.Stress-facilitated LTD induces outputplasticitythroughsynchronized-spikesand spontaneous unitary discharges in the CA1 region of the hippocampus.Neurosci Res,2004,49(2):229~239
16.刘辉,陈俊抛,田时雨,谭盛,高曲文.神经元型一氧化氮合酶在学习记忆过程中的变化和作用.中国神经免疫学和神经病学杂志,2000,7(2):116~122 LIU H,CHEN JP,TIAN SY,TAN S,GAO QW.The changes and possible role of neuronal nitric oxide synthase in learning and memory.Chin J Neuroimmunol&Neurol, 2000,7(2):116~122
17.Morgane PJ,Austin-LaFrance R,Bronzino J,Tonkiss J, Díaz-Cintra S,Cintra L,Kemper T,Galler JR.Prenatal malnutritionanddevelopmentofthebrain.Neurosci Biobehav Rev,1993,17(1):91~128
18.Morgane PJ,Mokler DJ,Galler JR.Effects of prenatal protein malnutrition on the hippocampal formation.Neurosci Biobehav Rev,2002,26(4):471~483
Abstract:Perinatal food restriction induces neurobiological changes,including deficiency in learning and memory,in rat offspring.However,the mechanism is still unclear.The females were paired with the males. Afterwards,the pregnant rats were assigned radomly into two groups:the control group and the model group.In the control group(n=9),dams had free access to diet and water during gestation and lactation.In the model group,dams(n=8)received 50%of the daily food intake of control mothers from gestation day 7 until the postnatal day 21.Spatial learning and memory ability was tested in Morris water maze in adult offspring rats.Afterwards,thein vivofield excitatory postsynaptic potential(fEPSP)was observed in the hippocampal CA1 area.In addition,the density of nNOS neurons in hippocampal CA1 area was recorded using immunohistochemistry.The results showed that the perinatal food restriction reduced body weight of offsprings on postnatal day(PD)1,PD7,PD10,PD14 and PD21,and impaired learning and memory of adult male offspring rats.This type of food restriction also decreased fEPSP slope of long-term potentiation(LTP) in hippocampal CA1 area.Importantly,the density of nNOS positive cells in hippocampal CA1 area was decreased by this type of food restriction.These findings suggested that perinatal food restriction impaired synaptic plasticity by reducing the product of NO in hippocampal CA1 area,and induced learning and memory disturbances in offspring rats.
Key Words:Hippocampus;Learning and memory;Long-term potentiation;Nitric oxide;Food restriction; Perinatal period
Effects of Perinatal Food Restriction on Synapticity in Hippocampal CA1 Area in Adult Offspring Rats
ZHANG Yinguo1,LI Ning2,YANG Jiajia1,ZHANG Tao1,YANG Zhuo2
1.College of Life Science,The Key Laboratory of Bioactive Materials,Ministry of Education, Nankai University,Tianjin 300071,China;
2.School of Medicine,Nankai University,Tianjin 300071,China
Q426
2009-12-07;接受日期:2010-01-14
国家自然科学基金项目(30870827)
杨卓,电话:(022)23504364,E-mail:zhuoyang@nankai.edu.cn
This work was supported by a grant from The National Natural Science Foundation of China(30870827)
Received:Dec 7,2009Accepted:Jan 14,2010
Corresponding author:YANG Zhuo,Tel:+86(22)23504364,Fax:+86(22)23502554,E-mail:zhuoyang@nankai.edu.cn