美洛昔康对铝负荷致大鼠海马神经元损伤的保护作用Δ
2010-09-11谢灵瑶杨俊卿重庆医科大学药学院药理学教研室重庆市400016
谢灵瑶,杨俊卿,黄 砚(重庆医科大学药学院药理学教研室,重庆市 400016)
环氧化酶(Cyclooxygenase,COX)是催化花生四烯酸(Arachidonic acid,AA)生成系列前列腺素衍生物(Prostaglandins,PGs)的限速酶,COX可分为结构型COX-1和可诱导型COX-2。越来越多的研究[1,2]证明炎症因子COX-2在造成脑损伤过程中有着十分重要的位置,且在炎症或损伤时,COX-2在神经元上高表达。另有研究[3]表明,中枢神经系统炎症因子PGs及COX-2的表达与神经元损伤退变有密切关系,它们参与了神经退行性疾病的发病过程。美洛昔康是COX-2选择性抑制剂。本课题组前期研究[4,5]表明,美洛昔康对铝负荷所致急、慢性脑组织损伤具有明显的改善作用,但由于在体实验影响因素较多,为进一步证实美洛昔康对脑损伤的保护作用,本文采用海马神经元原代培养,在细胞水平观察美洛昔康对铝盐致神经元损伤的作用,并且初步探讨其作用机制。
1 材料与方法
1.1 动物与试药
新生24 h内SD(Sprague-Dawley)乳鼠,由重庆医科大学实验动物中心提供,动物许可证号SCXK(渝)2002000。
美洛昔康(昆山龙灯瑞迪制药有限公司,批号:07050,纯度:100.5%);DMEM/F12培养基(批号:1361834)、B27培养基(批号:1290007)均由美国Gibco公司提供;特级胎牛血清(天津灏洋公司,批号:XA070621HY);多聚-L-赖氨酸(批号:AR0003)、MTT(批号:SP1090,使用时以磷酸盐缓冲液(PBS)制备成5 mg·mL-1溶液备用)均由美国Sigma公司提供;兔抗神经元特异性烯醇化酶(NSE)多克隆抗体(批号:BA0535)、抗体稀释液(批号:AR1016)均由武汉博士德生物工程有限公司提供;免疫组化SP(Streptavidin-perosidase)试剂盒(批号:K86922E)、DAB(3,3′-diaminobenzidine)显色剂(批号:375230AJ)均由北京中杉生物技术有限公司提供;乳酸脱氢酶(LDH)试剂盒(批号:20090226)、超氧化物岐化酶(SOD)试剂盒(批号:20090318)、丙二醛(MDA)试剂盒(批号:20090318)均由南京建成生物工程研究所提供;氯化钠(NaCl)、六水三氯化铝(AlCl3·6H2O)均为国产分析纯。
1.2 海马神经元原代培养
出生24 h内的乳鼠,以75%乙醇消毒后分离出海马,尽量除去血管,以D-Hank’s液洗3次,放入冰袋上装有D-Hank’s的烧杯中,用眼科剪将组织尽量剪碎。加入5倍组织体积的0.125%胰酶,37℃消化30 min,期间每10 min振摇1次。加入等体积的20%培养液终止消化。200目细胞筛过滤。取细胞悬液800 r·min-1离心8 min,除去胰酶。2次离心后,加入一定量的20%培养液分散沉淀,配成细胞密度为每升1×106个的细胞悬液,种植于赖氨酸处理过(爬片浸于赖氨酸溶液中2 h,超净台内风干备用)的24孔板或96孔板中,37℃、5%CO2培养箱中培养。培养24 h神经元贴壁后,换B27无血清培养液进行培养,每2 d半量换液1次,神经元培养至第7天可以长到较好的状态。
1.3 NSE免疫细胞化学鉴定
取24孔板中培养7 d的神经元爬片(10 mm×10 mm),PBS洗3次,用95%乙醇固定40 min后,按下列操作顺序进行:(1)PBS洗3次,每次5 min;(2)3%H2O2去离子水孵育20 min;(3)PBS洗3次,每次5 min;(4)正常山羊血清工作液中孵育1 h;(5)NSE多克隆抗体-抗体稀释液(1∶75)滴于爬片上细胞表面,4 ℃放置过夜;(6)PBS洗3次,每次5 min;(7)生物素标记羊抗兔IgG中孵育2 h;(8)PBS洗3次,每次5 min;(9)辣根酶标记链霉卵白素工作液中孵育20 min;(10)PBS洗3次,每次5 min;(11)DAB 显色,10 min;(12)流水终止染色 10 min;(13)反应终止后,加入苏木精复染细胞核。胞浆内成弥漫性棕色,胞核着色蓝色者为神经元。
1.4 MTT法测定
96孔板中大鼠神经元培养第7天后分成空白对照组、铝模型组、美洛昔康大、中、小剂量组。空白对照组加入200 μmol·L-1的NaCl培养液,铝模型组加入200 μmol·L-1的AlCl3培养液,美洛昔康小、中、大剂量组分别加入200 μmol·L-1的AlCl3+10-8mol·L-1、10-7mol·L-1、10-6mol·L-1的美洛昔康(均为终浓度)。在药物作用24 h后,每孔加入5 mg·mL-1的MTT溶液20 μL。继续培养4 h后,除去上清液,加入150 μL二甲基亚砜(DMSO)振荡以溶解结晶。于570 nm波长处读取光密度(OD)值,从OD值判断神经元存活力高低,OD值越高,神经元存活力越高。
1.5 LDH活性测定
接种于24孔培养板的海马神经元培养至第7天,药物处理及分组同“1.4”项方法。在加入药物处理作用24 h后,收集培养液上清0.03 mL(设为A溶液),用于测定释放入培养液的LDH总活性。再用胰酶消化各孔细胞,加入生理盐水1 mL,超声波细胞粉碎机破碎细胞(冰上进行)1 min,低温离心收集上清液0.03 mL(设为B溶液),用于测细胞内的LDH总活性。测定方法按照LDH测定试剂盒中操作说明书进行。于440 nm波长处检测OD,计算LDH活性和漏出率:LDH活性(IU·g-1prot)=(测定管OD值-测定空白管OD值)/(标准管OD值-标准空白管OD值)×2(μmol·mL-1)/蛋白浓度(mg·mL-1);LDH漏出率=A溶液LDH活性/(A溶液LDH活性+B溶液LDH活性)×100%。蛋白定量采用考马斯亮蓝法。通过计算LDH漏出率判断神经元损伤情况,LDH漏出率越高,说明神经元损伤越明显。
1.6 SOD活性和MDA含量测定
接种于24孔培养板的海马神经元培养至第7天,药物处理及分组同“1.4”项方法。在药物作用24 h后,加入胰酶消化细胞,加入生理盐水220 μL,低温下超声波破碎细胞、收集上清液0.2 mL,分别按SOD、MDA试剂盒中操作说明书进行测定,测定波长分别为550、532 nm,SOD活性、MDA含量计算公式如下:SOD活性(IU·mg-1prot)=(对照管OD值-测定管OD值)/对照管OD/50%×反应液总体积/取样量(mL)/蛋白含量(mg·mL-1);MDA含量(nmol·mg-1prot)=(测定管OD值-测定空白管OD值)/(标准管OD值-标准空白管OD值)×10(nmol·mL-1)/蛋白浓度(mg·mL-1)。蛋白定量采用考马斯亮蓝法。
1.7 神经元病理形态学观察
接种于置有载玻片(10×10 mm)的24孔培养板的海马神经元培养至第7天,药物处理及分组同“1.4”项方法。取药物作用24 h后的神经元爬片,PBS洗3次,95%乙醇固定40 min,中性树脂固定,PBS冲洗3次,HE染色,光镜下观察神经元病理形态学变化。
1.8 统计学分析
2 结果
2.1 NSE鉴定结果
倒置相差显微镜下观察,培养7 d的神经细胞胞体饱满,树突与轴突明显,细胞突起连接成网状。NSE免疫细胞化学染色后,阳性细胞胞体及轴突呈棕黄色,苏木精复染后细胞核呈蓝色。随机计数100个细胞中NSE阳性细胞数,阳性百分率超过95%,见图1。

图1 原代大鼠海马NSE免疫鉴定Fig1 Immunocytochemistry staining of NSE in primary cultured hippocampal neurons in rats
2.2 MTT法结果
各组OD值见表1。
表1 各组OD值比较(±s)Tab 1 Comparison of OD value in each group(±s)

表1 各组OD值比较(±s)Tab 1 Comparison of OD value in each group(±s)
与空白对照组比较:*P<0.01;与铝模型组比较:#P<0.05,##P<0.01compared with blank control group:*P<0.01;compared with aluminum model group:#P<0.05,##P<0.01
OD 0.76±0.05 0.58±0.05*0.64±0.03#0.67±0.06#0.69±0.06##组别空白对照组铝模型组美洛昔康小剂量组(10-8mol·L-1)美洛昔康中剂量组(10-7mol·L-1)美洛昔康大剂量组(10-6mol·L-1)n6 6 6 6 6
由表1可见,与空白对照组比较,铝模型组OD值明显降低(P<0.01)。与铝模型组比较,美洛昔康小剂量组、中剂量组OD值显著升高(P<0.05),而大剂量组OD值升高更明显(P<0.01),提示美洛昔康各剂量组神经元存活力提高。
2.3 LDH活性测定
各组LDH漏出率结果见表2。
由表2可见,与空白对照组比较,铝模型组LDH漏出率明显升高(P<0.01)。与铝模型组比较,美洛昔康小剂量组LDH漏出率显著降低(P<0.05),而中剂量组、大剂量组的显著性差异更明显(P<0.01)。说明美洛昔康各剂量组能减少神经元的损伤。
表2 各组LDH漏出率比较(±s)Tab 2 Comparison of LDH leakage in each group(±s)

表2 各组LDH漏出率比较(±s)Tab 2 Comparison of LDH leakage in each group(±s)
与空白对照组比较:*P<0.01;与铝模型组比较:#P<0.05,##P<0.01compared with blank control group:*P<0.01;compared with aluminum model group:#P<0.05,##P<0.01
组别空白对照组铝模型组美洛昔康小剂量组(10-8mol·L-1)美洛昔康中剂量组(10-7mol·L-1)美洛昔康大剂量组(10-6mol·L-1)n6 6 6 6 6 LDH漏出率/%17.13±5.02 35.70±6.02*28.00±5.49#23.33±4.02##19.20±4.12##
2.4 SOD活性、MDA含量
各组SOD活性和MDA含量测定结果见表3。
表3 各组SOD活性及MDA含量比较(±s)Tab 3 The activity of SOD and content of MDA in each group(±s)
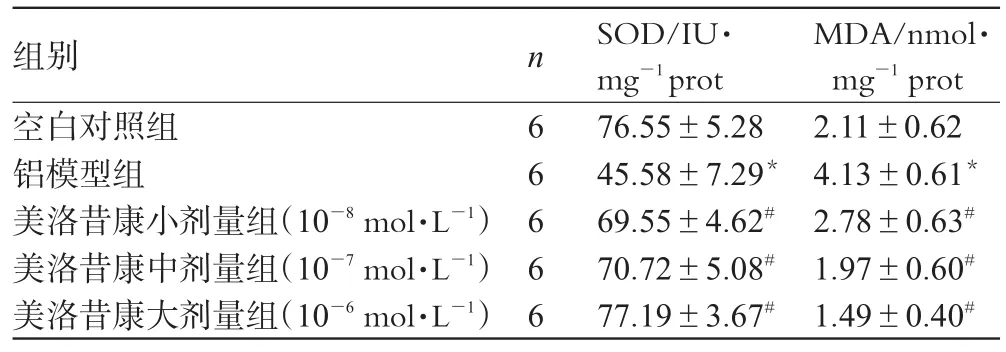
表3 各组SOD活性及MDA含量比较(±s)Tab 3 The activity of SOD and content of MDA in each group(±s)
与空白对照组比较:*P<0.01;与铝模型组比较:#P<0.01compared with blank control group:*P<0.01;compared with aluminum model group:#P<0.01
组别空白对照组铝模型组美洛昔康小剂量组(10-8mol·L-1)美洛昔康中剂量组(10-7mol·L-1)美洛昔康大剂量组(10-6mol·L-1)n 6 6 6 6 6 SOD/IU·mg-1prot 76.55±5.28 45.58±7.29*69.55±4.62#70.72±5.08#77.19±3.67#MDA/nmol·mg-1prot 2.11±0.62 4.13±0.61*2.78±0.63#1.97±0.60#1.49±0.40#
由表3可见,与空白对照组比较,铝模型组SOD活性明显降低、MDA含量明显升高(P<0.01)。与铝模型组比较,美洛昔康各剂量组SOD活性明显升高、MDA含量明显降低(P<0.01),并呈剂量依赖性。
2.5 神经元病理形态学
各组神经元病理形态学光镜下观察结果见图2。
由图2可见,空白对照组的海马神经元结构完整、清晰,细胞数目多,突起明显,连接成网。铝模型组的神经元细胞数目明显减少,突起萎缩,有部分神经元聚集在一起,甚至破裂死亡。美洛昔康各剂量组与铝模型组比较神经元数目增加,胞体和突起结构明显改善。
3 讨论
随着全球人口老龄化的趋势越来越明显,以阿尔茨海默病(Alzheimer’s disease,AD)等为代表的神经元退行性疾病越来越引起人们的广泛关注。
铝元素是目前公认导致体内氧化应激反应的重要因素之一,也是引起AD等老年性痴呆的重要诱因。铝是一种可在大脑内诱导生成自由基的神经毒性介质,而自由基的不断累积会使细胞膜和蛋白质变性,神经元死亡,从而引起如AD等神经退行性疾病的发生。由于铝所引起的神经生化变化与AD患者的神经化学变化相似,因此实验中常采用铝盐建立体内和体外神经元损伤模型。MTT法间接反映的是活细胞数量的多少,其活细胞数量与检测出来的OD值呈正比;而LDH的漏出率反映的是细胞受损的情况,LDH漏出率越大,说明细胞受损越严重。SOD可以清除机体内自由基,从而保护细胞免受损伤,因此SOD活性的强弱间接反映了机体清除氧自由基的能力。MDA的含量反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度,所以MDA含量的高低反映的是细胞受自由基攻击的严重程度。
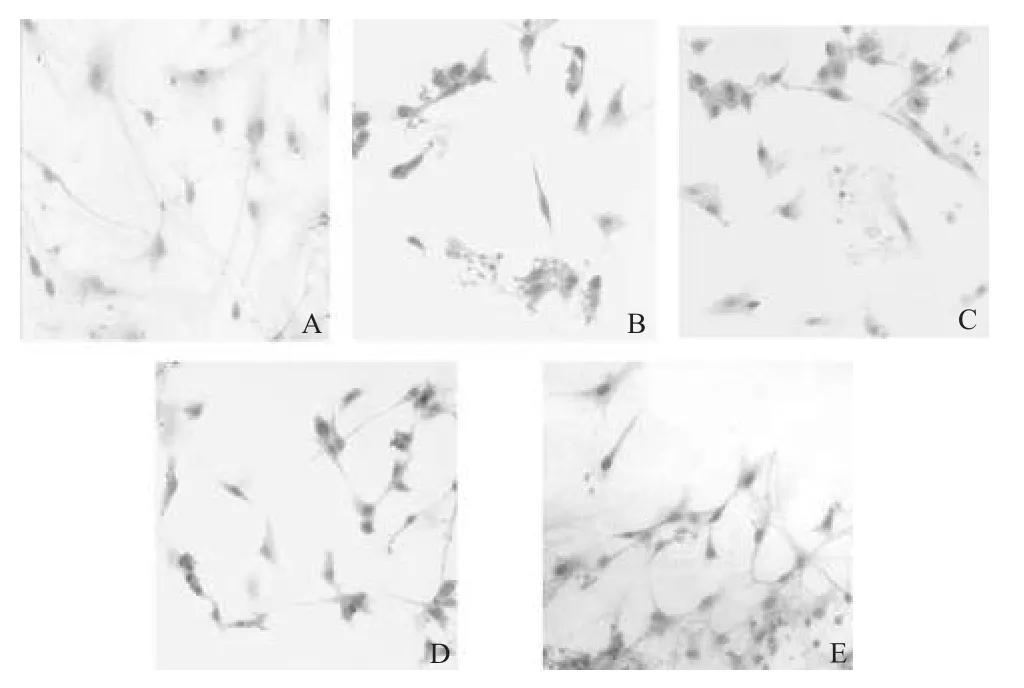
图2 各组神经元病理形态学观察(HE染色,×200)Fig 2 Pathomorphology of neurons in each group(HE staining,×200)
NSE是位于神经元胞浆内的一种可溶性酸性蛋白,是神经元特异性标志物之一。原代神经元培养7 d时进行鉴定,神经元纯度达到95%,故可以用于进行原代神经元的实验研究。本课题中,笔者采用铝盐(200 μmol·L-1)处理原代培养神经元24 h,以病理形态学、MTT、LDH为观察指标,体外模拟铝盐致神经元损伤模型。结果发现,与空白对照组比较,模型组神经元数目明显减少,突起变短,MTT值和SOD活性降低,LDH漏出率和MDA含量明显升高,提示笔者的模型建立是成功的,可以用于神经元损伤的机制研究以及药物作用的观察。
有报道[6,7]COX-2抑制剂Rofecoxib和Celecoxib对兴奋毒所致脑损伤、神经元退变有明显保护作用。同时有研究[8]证明Aβ1-40肽在成神经瘤细胞中的聚集会诱导COX-2的表达,且增强COX-2的活性,导致炎症反应进一步严重,因此COX-2在以AD为代表的神经元退变疾病中有着十分密切的关系。在本体外细胞实验中笔者发现,美洛昔康能剂量依赖性改善铝负荷导致的神经元胞体和突起的损伤、增加神经元数目,不同程度地提高MTT值,降低LDH漏出率,同时增强细胞内SOD活性、降低MDA含量。本研究结果从细胞水平进一步证实了美洛昔康对于因铝负荷导致原代神经元的损伤有着明显的保护作用。
美洛昔康改善铝负荷导致的离体大鼠海马神经元损伤的机制则可能是由于其抑制了COX-2活性,减少了炎症性因子前列腺素的合成,降低了炎症反应,进而抑制氧化应激反应,从而发挥对损伤神经元的保护作用。
本实验结果表明,美洛昔康对于铝盐导致的神经元损伤具有一定的保护作用。而以美洛昔康为代表的COX-2抑制剂对于一些神经元退变疾病如AD等,可能有一定的临床应用前景。
[1]Jadhav V,Ostrowski RP,Tong W,et al.Cyclooxygenase-2 mediates hyperbaric oxygen preconditioning-induced neuroprotection in the mouse model of surgical brain injury[J].Stroke,2009,40(9):3 139.
[2]范红杰,于维东,何志义.大鼠大脑中动脉局灶脑缺血环氧酶-2蛋白的表达及其意义[J].中国医科大学学报,2003,32(4):338.
[3]Yermakova A,O’Banion MK.Cyclooxygenases in the central nervous system:implications for treatment of neurological disorders[J].Curr Pharm Des,2000,6(17):1 755.
[4]Yang JQ,Liu BZ,He BC,et al.Protective effects of meloxicam on aluminum overload-induced cerebral damage in mice[J].Eur J Pharmacol,2006,547(1~3):52.
[5]苏 强,杨俊卿,张 鹏.美洛昔康对慢性铝超负荷致神经元退变大鼠海马环氧化酶2表达的影响[J].中国药理学与毒理学杂志,2009,23(1):6.
[6]Gobbo OL,Mara OSM.Post-treatment,but not pre-treatment,with the selective cyclooxygenase-2 inhibitor celecoxib markedly enhances functional recovery from kainic acid-induced neurodegeneration[J].Neurosci,2004,125(2):317.
[7]Manish N,Aryamitra B,Harish P.Cyclooxygenase inhibitors:a novel direction for Alzheimer’s management[J].Pharmacol Rep,2008,60(5):692.
[8]Pasinetti GM,Aisen PS.Cyclooxygenase-2 expression is increased in frontal cortex of Alzheimer’s disease brain[J].Neuroscience,1998,87(2):319.
