不同土炒白术中白术内酯Ⅲ和白术多糖的含量比较Δ
2010-09-10陈鸿平刘友平刘承萍成都中医药大学药学院中药材标准化教育部重点实验室成都市610075
陈鸿平,刘友平,刘承萍,李 萍(成都中医药大学药学院中药材标准化教育部重点实验室,成都市 610075)
不同土炒白术中白术内酯Ⅲ和白术多糖的含量比较Δ
陈鸿平*,刘友平,刘承萍,李 萍(成都中医药大学药学院中药材标准化教育部重点实验室,成都市 610075)
目的:探讨不同辅料土炮制白术对其主要有效成分的影响,为辅料土的筛选提供依据。方法:采用同批药材,用5种不同品种的辅料土炮制;采用高效液相色谱法测定白术内酯Ⅲ的含量,紫外分光光度法测定白术多糖的含量。结果:白术内酯Ⅲ的含量高低为赤石脂炒白术>壁土炒白术>灶心土炒白术>窑土炒白术>黄土炒白术>生白术;多糖含量高低为灶心土炒白术>黄土炒白术>赤石脂炒白术>窑土炒白术>壁土炒白术>生白术。结论:白术经不同辅料土炒炮制后,白术内酯Ⅲ和白术多糖含量均有增高,但不同炮制品之间无显著性差异。
白术;土炒炮制;白术内酯Ⅲ;白术多糖
Δ四川省教育厅青年基金项目(2006B024)
*实验师,博士研究生。研究方向:中药药效物质基础及质量标准。电话:028-61800231。E-mail:chen_hongping@126.com
白术为菊科植物白术Atractylodes macrocephalaKoidz.的干燥根茎,具有健脾益气、燥湿利水、止汗、安胎等功效[1]。传统认为,白术生品燥湿力强,炮制后可缓和药性,增强健脾和胃、补脾止泻的功效。白术历代炮制方法主要有熬制、土制、炒制、泔制、麸炒、醋制、煨制、焙制等,现代炮制方法多为清炒、土炒、麸炒、蜜炙等,其中土炒是最常见的炮制方法之一。白术土炒起源于晋、唐时期,常用的辅料土有黄土、壁土、灶心土,2005年版《中国药典》(一部)规定使用灶心土。随着社会发展,灶心土越来越难以获得,各地出现的替代品种类不一,常使用的主要有黄土、窑土和赤石脂,均缺乏系统研究,严重影响了土炒炮制品的质量。而不同种类辅料土对土炒白术的质量影响尚未见文献报道。本试验采用历代常用的灶心土、壁土、窑土、黄土、赤石脂等不同“土”作为辅料来炮制白术,对白术生品及各种土炮制品进行化学成分的定性定量比较研究,以白术多糖和白术内酯Ⅲ的含量为测定指标,对各种土炮制白术前后及相互之间的化学成分影响进行初步研究,以探讨白术土炒炮制的意义,同时为辅料土的种类筛选提供依据。
1 仪器与材料
1.1 仪器
LC10-ATVP型高效液相色谱(HPLC)仪,包括紫外检测器、色谱工作站(日本岛津公司);UV-1100型紫外-可见分光光度计(上海天美科技有限公司);BP211D(十万分之一)、BP121S(万分之一)型电子分析天平(德国Sartorius公司);BUG25-12型超声波清洗机(25 kHz,500 W,上海必能信超声波有限公司)。
1.2 试药
白术内酯Ⅲ标准品(成都曼思特生物科技有限公司,批号:200810,纯度>98%);葡萄糖标准品(成都市科龙化工试剂厂,批号:20081023);赤石脂于2008年3月购于成都市西南药都;灶心土来自四川广元市剑阁县某农家;窑土来自四川乐山市夹江县某农家;壁土来自四川乐山市夹江县某农家;黄土采自成都市温江区;白术于2008年3月购于西南药都,经成都中医药大学裴瑾教授鉴定为植物白术A.macrocephalaKoidz.的干燥根茎;甲醇、乙腈为色谱纯,水为高纯水,其余试剂均为分析纯。
2 方法与结果
2.1 不同土炒白术炮制品的制备
取上述各种土过120目筛的细粉,分别投入热锅中,加热至呈滑利状态时,投入净白术片,迅速翻炒,炒至白术表面均匀挂土色时,取出,筛去土粉,放凉,备用。即得赤石脂炒白术、灶心土炒白术、窑土炒白术、壁土炒白术、黄土炒白术5种白术炮制品。每100 g药材用辅料土20 g。
2.2 不同土炒白术炮制品中白术内酯Ⅲ的含量比较
2.2.1 色谱条件与系统适用性试验 色谱柱:Hypersil-ODS C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(65∶35);柱温:30 ℃;流速:1.0 mL·min-1;检测波长:220 nm。在此色谱条件下,供试品溶液中白术内酯Ⅲ与其余成分完全分离;理论板数以白术内酯Ⅲ峰计算应不低于3 000。色谱见图1。
2.2.2 标准品溶液的制备 精密称取白术内酯Ⅲ标准品10.6 mg,置于10 mL量瓶中,加甲醇溶解并稀释至刻度,得标准品贮备液。精密量取标准品贮备液1 mL,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得标准品溶液。
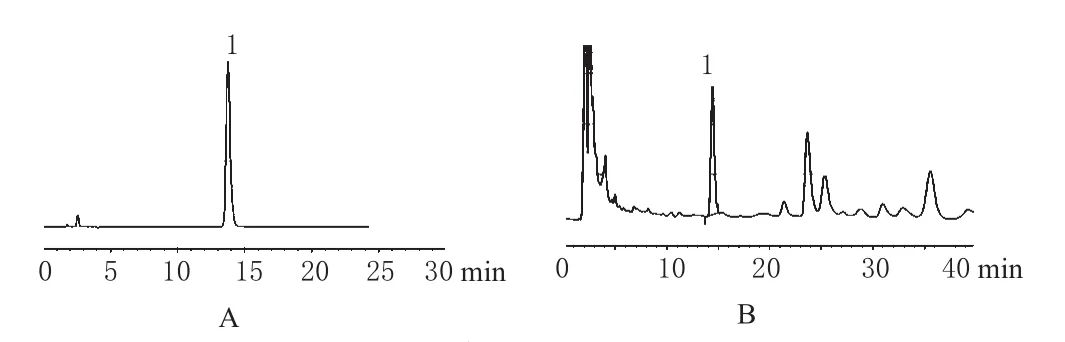
图1 高效液相色谱图A.白术内酯Ⅲ标准品;B.供试品;1.白术内酯ⅢFig 1 HPLC chromatogramsA.atractylodeⅢ standard substance;B.test sample;1.atractylodeⅢ
2.2.3 供试品溶液的制备 分别取白术生品及5种土炒炮制品细粉约1 g,精密称定,置于具塞锥形瓶中,精密加入甲醇20 mL,密塞,称重,超声40 min,放冷,再称重,用甲醇补足失重,摇匀,滤过,精密量取续滤液10 mL,蒸干,残渣加甲醇溶解并定容至2 mL量瓶中,摇匀,以微孔滤膜(0.45 μm)滤过,即得。
2.2.4 线性关系考察 分别精密吸取标准品贮备液0.25、0.50、0.75、1.00、1.50、2.00 mL,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,取上述溶液各10 μL,按上述色谱条件测定。以峰面积积分值(Y)为纵坐标,白术内酯Ⅲ进样量(X,μg)为横坐标,进行线性回归,得回归方程为Y=3×106X+12 090(r=0.999 8)。结果表明,白术内酯Ⅲ进样量在0.265~2.120 μg范围内与峰面积积分值呈良好的线性关系。
2.2.5 重复性试验 取白术生品细粉约1 g,共6份,精密称定,按“2.2.3”项下方法制备供试品溶液,各吸取10 μL,照上述色谱条件测定。结果,RSD=1.32%(n=6),表明方法重复性良好。
2.2.6 精密度试验 精密吸取白术内酯Ⅲ标准品溶液适量,按上述色谱条件重复进样测定6次。结果,RSD=0.97%(n=6),表明仪器精密度良好。
2.2.7 稳定性试验 精密吸取同一灶心土炒白术供试品溶液10 μL,按上述色谱条件分别于0、12、24、48、72、96 h测定。结果,RSD=1.23%(n=6),表明供试品溶液在96 h内稳定。
2.2.8 加样回收率试验 取已知含量的生白术细粉约0.5 g,共6份,精密称定,分别加入白术内酯Ⅲ标准品溶液0.5 mL,按“2.2.3”项下方法制备供试品溶液,各精密吸取10 μL,按上述色谱条件测定,计算加样回收率,结果见表1。

表1 加样回收率试验结果(n=6)Tab 1Results of recovery test(n=6)
2.2.9 样品含量测定 取各种土炒白术,按“2.2.3”项下方法制备供试品溶液,分别精密吸取各供试品溶液10 μL,按上述色谱条件测定,计算白术内酯Ⅲ含量。结果,白术经不同土炒后白术内酯Ⅲ含量均显著增高,除黄土炒白术含量稍低外,其余4种炮制品无显著性差异。样品含量测定结果见表2。
2.3 不同土炒白术炮制品中多糖的含量比较
2.3.1 标准品溶液的制备 精密称取葡萄糖标准品(于105℃干燥至恒重)50.0 mg,置于50 mL量瓶中,加蒸馏水溶解并稀释至刻度,得葡萄糖标准品贮备液。精密吸取贮备液5 mL,置于50 mL量瓶中,用蒸馏水稀释至刻度,摇匀,得葡萄糖标准品溶液。

表2 样品含量测定结果Tab 2 Content determination of samples
2.3.2 供试品溶液的制备 分别取白术生品及5种土炒炮制品粗粉(过2号筛)约1 g,精密称定,置于250 mL具塞锥形瓶中,加入70%的乙醇50 mL,冷浸2 h,超声提取20 min,滤过,药渣用70%的热乙醇洗涤后挥干乙醇,加入50 mL蒸馏水回流提取1 h,趁热过滤,药渣及烧瓶用少量热蒸馏水洗涤,洗涤液并入滤液,置于100 mL量瓶中,冷却至室温后加蒸馏水稀释至刻度,摇匀,得供试品贮备液。精密吸取贮备液1 mL,置于100 mL量瓶中,加蒸馏水释至刻度,摇匀,即得供试品溶液。
2.3.3 显色条件的考察及最大吸收波长的确定 文献报道[2],苯酚-浓硫酸法测定多糖含量时影响因素主要有显色温度、显色时间和显色剂(10 mL蒸馏水加入50 mL浓硫酸中,于冰水浴中冷却,再加入0.6 g苯酚晶体,超声溶解,即得)用量,故本试验对这3个影响因素进行了考察。
(1)显色温度的考察:分别考察了45、70、100℃3种温度对供试品、标准品溶液的最大吸收波长和吸光度的影响。结果,100℃时,标准品、供试品溶液均在490 nm波长处有最大吸收,故选用100℃为显色温度,490 nm波长为测定波长。紫外吸收光谱见图2。

图2 紫外吸收光谱图a.葡萄糖标准品;b.生白术供试品Fig 2 UV absorption spectruma.standard glucose;b.A.macrocephala samples
(2)显色时间的考察:精密移取生白术供试品溶液2 mL,共4份,置于具塞试管中,各组分别以2 mL蒸馏水为空白、1 mL葡萄糖标准品溶液精密加蒸馏水至2 mL为对照品,分别加显色剂5 mL,摇匀,放置10 min,分别于100℃水浴显色10、20、30、40 min,取出,静置20 min,于490 nm波长处测定吸光度。结果,显色30 min后吸光度不再增加,故确定显色时间为30 min。
(3)显色剂用量的考察:精密移取生白术供试品溶液2 mL,共5份,置于具塞试管中,各组分别以2 mL蒸馏水为空白,分别加显色剂3、4、5、6、7 mL,摇匀,放置10 min,分别于100℃水浴显色30 min,取出,静置20 min,于490 nm波长处测吸光度。结果,当显色剂用量为5 mL后吸光度不再增加,故确定显色剂用量为5 mL。
最终确定测定白术多糖的显色条件为供试品溶液2 mL,加显色剂5 mL,摇匀,放置10 min,于沸水浴加热30 min,取出,冷却至室温,于490 nm波长处测定吸光度。
2.3.4 标准曲线的制备 精密吸取葡萄糖标准品溶液0.0、0.4、0.6、0.8、1.0、1.2、1.6 mL,置于具塞试管中,蒸干,精密加入蒸馏水2 mL溶解残渣,加显色剂5 mL,摇匀,放置10 min,沸水浴加热30 min,取出,冷却至室温,于490 nm波长处测定吸光度。以吸光度(A)为纵坐标,葡萄糖检测浓度(C,g·L-1)为横坐标,制备标准曲线,得回归方程为A=13.363C+0.023 9(r=0.999 3)。结果表明,葡萄糖检测浓度在0.02~0.08 g·L-1范围内与吸光度呈良好线性关系。
2.3.5 稳定性试验 精密移取生白术供试品溶液2 mL,置于具塞试管中,按“2.3.4”项下自“加显色剂5 mL”起操作,每隔30 min测定吸光度,共测定5次。结果,RSD=1.25%(n=5),表明供试品溶液在120 min内稳定。
2.3.6 精密度试验 精密移取葡萄糖标准品溶液0.8 mL,共6份,分别置于具塞试管中,按“2.3.4”项下自“加显色剂5 mL”起操作,在490 nm波长处测定吸光度。结果,平均吸光度为0.575,RSD=1.05%(n=6),表明方法精密度良好。
2.3.7 不同土炒白术炮制品中精制多糖的制备 分别称取白术生品及各种土炮制品粗粉(过2号筛)50 g,加6倍量70%乙醇回流提取2次,每次2 h,滤过,以除去单糖、低聚糖、苷类及生物碱等干扰性成分。药渣加8倍量水煎煮2次,每次1.5 h,合并水煎液,浓缩至100 mL(相当于药材0.5 g·mL-1),静置过夜,取上清液,3 500 r·min-1离心30 min,取离心后上清液加入95%乙醇调至乙醇浓度为70%,冰箱静置24 h,滤过,沉淀用蒸馏水溶解,3 500 r·min-1离心30 min,上清液再加入95%乙醇调至乙醇浓度为70%,冰箱静置24 h,滤过,沉淀用无水乙醇反复洗涤,60℃真空干燥,即得不同土炒白术的精制多糖。
2.3.8 换算因子的测定 精密称取精制多糖50 mg,置于50 mL量瓶中,加蒸馏水溶解并稀释至刻度,摇匀,精密吸取1 mL,置于25 mL量瓶中,加蒸馏水稀释至刻度,摇匀。精密吸取该溶液2 mL,置于具塞试管中,在490 nm波长处测定吸光度,计算以葡萄糖计的质量,按下式计算换算因子(f):f=W/W1(式中:W为多糖的质量(g);W1为多糖供试液中以葡萄糖计的质量(g))。
2.3.9 加样回收率试验 取已知多糖含量的生白术细粉约0.5 g,共6份,精密称定,分别精密加入葡萄糖标准品0.25 g,按“2.3.2”项下方法制备供试品溶液,在490 nm波长处测定吸光度,计算加样回收率,结果见表3。
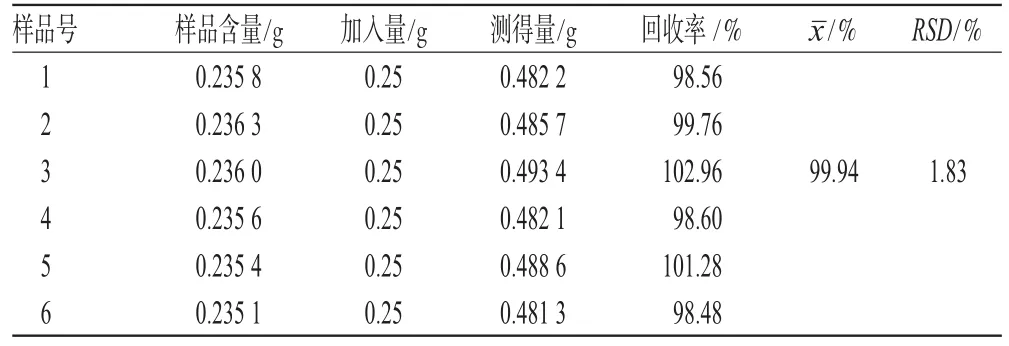
表3 加样回收率试验结果(n=6)Tab 3Result of recovery experiment(n=6)
2.3.10 样品含量测定 精密吸取各供试品溶液2 mL,置于具塞试管中,按“2.3.4”项下方法测定吸光度,计算以葡萄糖计的浓度,按下式计算样品中多糖的含量:多糖含量(%)=W1f1/W2×100%(式中:W1为多糖供试液中以葡萄糖计的质量;f为换算因子;W2为白术取样量(g))。结果表明,土炒后白术多糖含量略有增高,但不同土炒品之间无显著差异。样品多糖含量测定结果见表4。
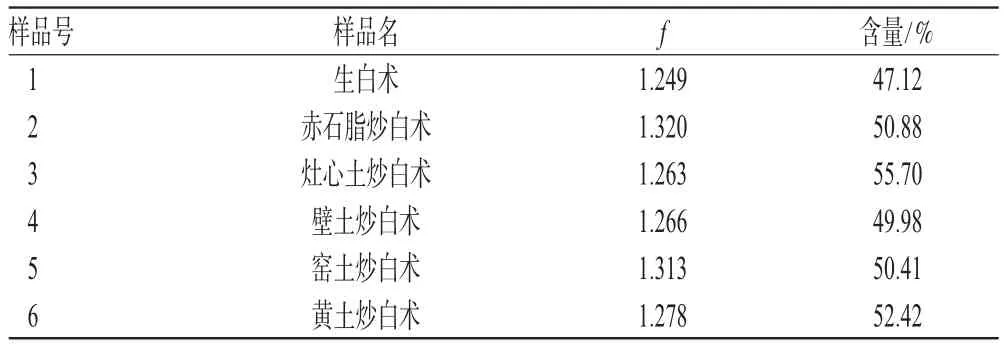
表4 样品多糖含量测定结果(n=3)Tab 4 Content determination of polysacchenide in samples(n=3)
3 讨论
试验结果表明,白术土炒炮制后白术内酯Ⅲ和多糖的含量均显著增高,其中白术内酯Ⅲ含量增加尤为明显,约为生品的3至4倍,与文献报道[3]一致。白术多糖具有提高机体免疫能力、增强机体对自由基的清除、抗氧化的作用;白术内酯Ⅲ则具有抗炎和抗癌作用,二者含量在炮制后均明显提高,可为土炒炮制这一方法提供一定的科学依据。
不同土炒白术中白术内酯Ⅲ的含量高低为赤石脂炒白术>壁土炒白术>灶心土炒白术>窑土炒白术>黄土炒白术,除黄土炒白术含量稍低外,其余4种炮制品无显著性差异。不同土炒白术中多糖的含量高低为灶心土炒白术>黄土炒白术>赤石脂炒白术>窑土炒白术>壁土炒白术,但均无显著性差异。结果表明,不同种类的辅料土炮制对白术多糖和内酯类成分的影响不大,但并不能就此说明这几种土均能替代灶心土使用,还应对其药理作用和毒理进行系统比较研究,以最终筛选和确定辅料土的种类,保证土炒饮片的临床疗效和用药安全。
[1]国家药典委员会编.中华人民共和国药典(一部)[S].2005年版.北京:化学工业出版社,2005:68.
[2]李 辉,罗佳波.苯酚-硫酸法测定围乐颗粒中总多糖的含量[J].中国药房,2008,19(9):685.
[3]于永明,宋长义,贾天柱.白术炮制品的质量标准研究[J].中成药,2005,27(6):669.
Content Comparison of AtractylodeⅢand Soluble Polysaccharide ofAtractylodes macrocephalaProcessed with Different Kinds of Soils
CHEN Hong-ping,LIU You-ping,LIU Cheng-ping,LI Ping(Key Lab of TCM Standardization,Ministry of Education,Pharmacy College of Chengdu University of TCM,Chengdu 610075,China)
OBJECTIVE:To discuss on the effect of processedAtractylodes macrocephalawith different kinds of soils as excipient on the main effective ingredients ofA.macrocephala,and to provide the basis for screening soils as processing excipient.METHODS:The same batches ofA.macrocephalawere processed with 5 kinds of soils.The content of atractylodeⅢ was determined by HPLC and polysaccharide ofA.macrocephalaby UV spectrophotometry.RESULTS:The contents of atractylodeⅢ in processedA.macrocephalaby halloysitum rubrum was the highest,followed by processedA.macrocephalaby wall soil,by kitchen range soil,by kiln soil,by loess and raw material.The contents of soluble polysaccharide in processedA.macrocephalaby kitchen range soil was the highest,followed by processedA.macrocephalaby loess,by halloysitum rubrum,by kiln soil,by wall soil and raw material.CONCLUSION:The contents of atractylodeⅢ and polysaccharide increase afterA.macrocephalahas been processed by different kinds of soil.However,there is no significant difference among the processedA.macrocephalawith different kinds of soils.
Atractylodes macrocephala;Processed by soil;AtractylodeⅢ;Polysaccharide ofAtractylodes macrocephala
R284.2;R284.1
A
1001-0408(2010)39-3680-04
2009-10-03
2010-05-06)
