激光共聚焦显微镜检测紫花地丁水浸出物对HBV的影响
2010-09-10吴中明王美丽
王 玉,吴中明,罗 果,王美丽
(遵义医学院,贵州 遵义563003)
紫花地丁(Viola Yedoensis Makino)属堇菜属,传统医学认为紫花地丁味苦、性寒,具有清热解毒,抗菌消炎的功效。临床上,紫花地丁及含有紫花地丁的方剂主要用于治疗各种病原体感染,特别是慢性感染和自身免疫性疾病[1]。激光共聚焦显微镜(laser confocal scanning microscopy,LSCM)是一种新型高精度的激光源加共聚焦显微镜,可对活的或固定的细胞及组织标本的荧光定量分析,离子含量的实时动态分析检测等。本实验利用LSCM与间接免疫荧光结合,观察紫花地丁对乙型肝炎病毒 (Hepatitis B virus,HBV)DNA全基因转染的HepG2.2.15细胞[2,3]内的HBsAg、HBeAg和HBcAg的影响。
1 材料与方法
1.1 材料
1.1 实验细胞 HepG2.2.15细胞株,购于解放军302医院传染病研究所病毒所。
1.2 主要仪器 激光共聚焦显微镜(Leica TCS SP2)。
1.3 主要试剂 ①MTT(华美生物工程公司);②羊抗人-IgG-FITC(华美生物工程公司);③抗-HBs、抗-HBe和抗-HBc免疫血清(华美生物工程公司)。
1.4 实验药物 ①紫花地丁水提取物储存液:称取100 g紫花地丁,切碎后加适量超纯水浸没紫花地丁,置于4℃冰箱浸泡过夜。次日加热煮沸,保持微沸浸出一定时间,重复煎煮3次,分离并收集各次煎出液,浓缩至250 mL溶液,浓度相当于每mL含400mg生药量,过滤除菌分装,置-20℃冰箱保存备用。②使用DMEM完全培养液配制各实验浓度药物。
1.5 实验方法
1.5.1 细胞培养 HepG2.2.15细胞用含10%婴牛血清、380mg/L G418(实验用培养液不加)、100U/mL青霉素、100U/mL链霉素、用0.238%HEPS的DMEM培养液培养,每4~5天换1次培养液,约7d传代1次。HepG2.2.15细胞为贴壁生长细胞,传代时用0.25%胰酶消化。
1.5.2 MTT法测细胞毒性 ①接种细胞:将生长良好的HepG2.2.15细胞以5×104个/孔的密度接种于96孔培养板,置于37℃、5﹪CO2培养箱中培养。②药物作用:HepG2.2.15细胞贴壁后经血清饥饿法进行细胞同步化后分组,实验组分别加入含有3、0.6和0.12mg/ml紫花地丁水浸出物的培养液;阳性对照3TC组的终浓度为50μg/mL;不加药物细胞对照组加入完全培养液。每孔均加入0.1 mL。每一浓度设5个平行孔。空白孔不加细胞,只加培养液。继续培养3d、6d和9d后,每3天更换含药培养液1次。③MTT法检测:实验结束后,采用酶标仪波长为490 nm(参考波长630nm)测定各孔A值[1]。按下列公式计算细胞破坏率和半数毒性剂量(TC50)。细胞破坏率(%)=[(细胞对照组平均A值-实验组平均A值)/细胞对照组平均A值)]×100%。TC50=Antilog[A+(50-50%抑制百分率)×C/>50%抑制百分率-<50%抑制百分率]注:(A=log<50%药物浓度,B=log>50%药物浓度,C=B-A)。
1.5.3 细胞爬片的制备 将生长良好的HepG2.2.15细胞用0.25﹪胰酶消化后制成细胞悬液,以3.5×105个/孔的密度接种于放有灭菌盖玻片的6孔培养板,置于37℃、5﹪CO2培养箱中培养。贴壁后经血清饥饿法细胞同步化处理后,进行实验分组:实验组加入3mg/mL紫花地丁水浸出物,阳性药物对照组3TC浓度为50 μg/mL;细胞对照组加入完全培养液,每孔均加入2.0 mL。继续培养3d后,取出爬片用PBS洗一次,冷丙酮固定10 min后,免疫荧光染色后上机检测。
1.5.4 细胞爬片荧光染色法 已固定的细胞爬片用PBS洗5 min,在标本上覆盖1:5的抗-HBe、抗-HBs免疫血清,4℃冰箱中孵育过夜→用PBS漂洗3×3 min→细胞未干前复加二抗(羊抗人IgG-FITC 1:8)37℃湿盒1h→用PBS漂洗3×3 min→PI室温避光作用15 min→用PBS漂洗3×3 min→封片剂封片后用LSCM观察,并进行荧光强度的定量分析。FITC和PI的激发波长分别是488nm和535nm。FITC检测HB sAg、HBeAg和 HBcAg;PI检测细胞核酸。
加抗-HBc前先用0.1﹪Triton X-100+10﹪小牛血清PBS溶液37℃孵育15 min,余步骤同上。
计算抗原抑制率,公式如下:抗原抑制率=(细胞对照组荧光强度-药物处理组荧光强度)/细胞对照组荧光强度×100%。
1.6 统计学处理 采用SPSS 13.0统计软件分析数据,组间比较采用方差分析,各均数两两比较。
2 结果
2.1 紫花地丁的细胞毒性作用 在加入不同浓度的紫花地丁水浸出物和50μg/ml 3TC作用3d、6d和9d后,在倒置显微镜下观察各紫花地丁水浸出物组细胞生长良好。MTT实验发现紫花地丁水浸出物各浓度组均有不同程度促细胞生长作用 (P<0.05),50μg/mL 3TC在第9天有明显细胞毒性作用(P<0.05)。
2.2 HBsAg、HBeAg和 HBcAg在 HepG2.2.15细胞内的定位 LSCM下,HBsAg主要存在于细胞的胞浆、核膜和胞膜上;HBeAg主要在核内和胞浆内,核膜上没有分布;HBcAg分布在胞浆和核内(见图1)。
表1 紫花地丁水浸出物、3TC在HepG2.2.15细胞培养中对细胞的作用(OD 490nm,±s,n=5)Tab.1 The cell toxicity of the different concentrations of Viola Yedoensis Makino extract and 3TC on HepG2.2.15 cells.(OD 490nm,±s,n=5)
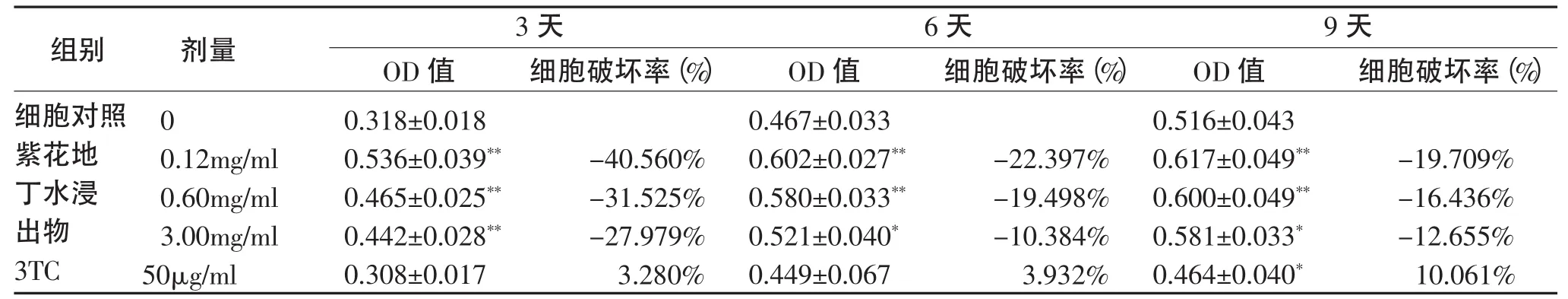
表1 紫花地丁水浸出物、3TC在HepG2.2.15细胞培养中对细胞的作用(OD 490nm,±s,n=5)Tab.1 The cell toxicity of the different concentrations of Viola Yedoensis Makino extract and 3TC on HepG2.2.15 cells.(OD 490nm,±s,n=5)
注:与细胞对照组比较:*P<0.05,**P<0.01;紫花地丁水浸出物各浓度组与3TC组比较:△P<0.05,△△P<0.01
?
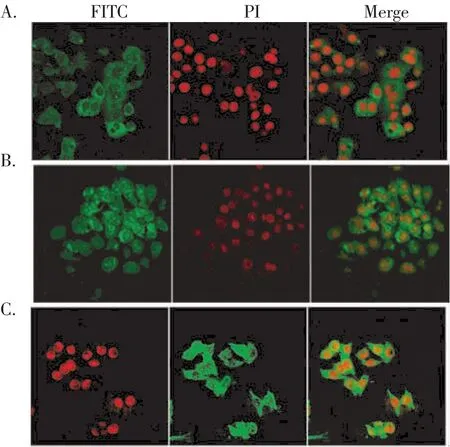
图1 激光共聚焦显微镜下HepG2.2.15细胞内HBsAg、HBeAg和HBcAg的分布(×200)Fig 1 Location of HBsAg,HBeAg and HBcAg in HepG2.2.15 cells by LSCM(×200)
2.3 药物对细胞内HBsAg、HBeAg和HBcAg的影响 药物处理3d后采用间接免疫荧光法标记HBs Ag、HBeAg和HBcAg,并随机选取5个视野,记录100个细胞的荧光强度。结果表明,紫花地丁水浸出物3mg/ml组对三种抗原均有抑制作用(P<0.01);3TC 50μg/mL组对HBsAg和HBeAg有明显抑制作用(P<0.01),但对 HBcAg无抑制作用(P>0.05)。两种药物对HBsAg抑制作用无显著差异(P>0.05),紫花地丁水浸出物对HBeAg和HBcAg抑制作用更强(P<0.05)。
3 讨论
本试验主要研究紫花地丁水浸出物对HepG2.2.15细胞内HBsAg、HBeAg和HBcAg的影响以及三种抗原在细胞内的分布,为进一步了解紫花地丁对HBV的作用打下实验基础。本研究将紫花地丁作用的细胞爬片,用抗-HBs、抗-HBe和抗-HBc特异性标记细胞内的相应抗原,再用羊抗人IgG-FITC标记一抗,在LSCM下直接观察HBV抗原含量的变化。LSCM的激发光源为单波长的激光,因而能有效地避免细胞的自发荧光和非特异性荧光的出现,使所采集的图像更清晰可靠[4,5];同时,由于LSCM采集的是一个光学层面的图像,所以能够准确地定位出三种抗原在HepG2.2.15细胞内的分布。结果表明HBsAg主要分布在胞浆和胞膜,HBeAg分布在核内、胞浆和胞膜,HBcAg主要分布在核内和胞浆内。
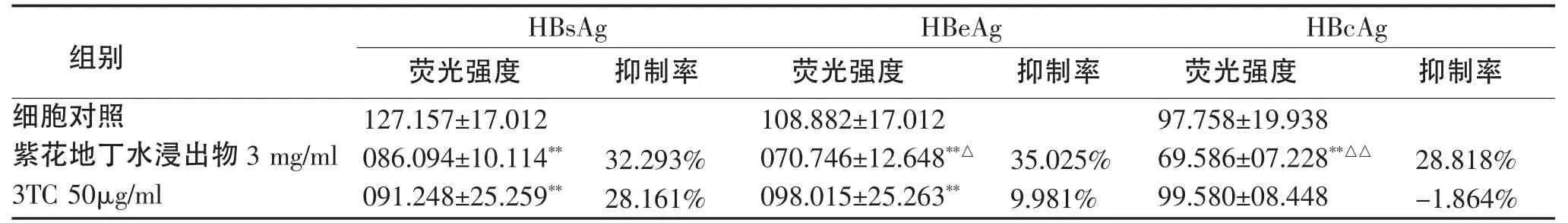
表2 紫花地丁水浸出物和3TC在第3天对HepG2.2.15细胞内的HBsAg、HBeAg和HBcAg的影响Tab 2 The effect of Viola Yedoensis Makino estract and 3TC on HBsAg,HBeAg and HBcAg in HepG2.2.15 cells at 3th day.
我们曾证实紫花地丁对HepG2.2.15细胞分泌的HBsAg和HBeAg具有抑制作用[6],本研究拟观察紫花地丁对HepG2.2.15细胞内 HBsAg、HBeAg和HBcAg的影响。结果表明紫花地丁对细胞内三种抗原均有明显抑制作用,其中对HBeAg的抑制作用优于拉米夫定。HBeAg是HBV复制及具有强感染性的一个指标,对于病毒在感染宿主中的生命周期至关重要,同时也是病毒基因的辅助产物。紫花地丁对胞内外HBeAg均有抑制作用,表明紫花地丁对HBV复制具有一定的抑制作用。本研究发现紫花地丁对HBcAg具有抑制作用,而拉米夫定无抑制HBcAg作用,HBcAg较HBsAg和HBeAg更能反映HBV的存在及其复制程度,它是HBV颗粒存在的直接标志,其与HBV DNA呈正相关,都可反映HBV的活动性复制。紫花地丁对HBcAg具有抑制作用,进一步说明其对HBV具有抑制作用。紫花地丁作用导致HBsAg、HBeAg和HBcAg含量减少说明其具有一定的抗HBV作用,但其作用机制还需进一步研究。
激光共聚焦显微镜现已广泛用于病毒的荧光定量测量,共焦图像分析等方面的研究,今后必将在抗病毒药物筛选中发挥越来越重要的作用。
[1]李海涛,杨琳,章广玲,等.紫花地丁煎剂调节小鼠巨噬细胞功能的体内实验研究 [J].华北煤炭医学院学报,2004,6(5):553-554.
[2]Jia-Ming Chang,Kai-Ling Huang,Thomas Ta-Tuan,et al.The anti-hepatitis B virus activity of Boehmeria nivea extract in HBV-viremia SCID mice[J].eCAM,2007,1-7.
[3]张玮,王育群,季光,等.芪黄冲剂体外(2.2.15细胞)抗病毒的药效学研究 [J].现代中西医结合杂志,2005,14(9):1137-1140.
[4]周继凯,李焕德.激光扫描共聚焦显微技术在医药研究中的应用[J].中南药学,2007,5(1):66-68.
[5]朱菁,李秀兰,李惠芬.激光扫描共聚焦显微技术及在药学上的应用[J].天津药学,2006,18(5):58-61.
[6]王玉,吴中明,敖弟书,等.紫花地丁对HepG2.2.15细胞分泌 HBsAg 的影响[J].遵义医学院学报,2009,32(6):559-566.
