先天性心脏病圆锥动脉干畸形NKX2-5基因Cp G岛甲基化状态分析
2010-09-10盛伟王慧君马晓静李文灿陈龙张进黄国英马端
盛伟 王慧君 马晓静 李文灿 陈龙 张进 黄国英 马端,,*
(1.复旦大学上海医学院分子医学教育部重点实验室,上海 200032;2.复旦大学生物医学研究院,复旦大学出生缺陷研究中心,上海 200032;3.复旦大学附属儿科医院,复旦大学儿童发育与疾病转化医学研究中心,上海 200032;4.复旦大学法医系,上海 200032)
先天性心脏病(congenital heart disease),简称先心病,是指胚胎发育过程中心脏结构发生异常的一类疾病。近年来出生缺陷调查资料显示,先心病已跃居我国出生缺陷畸形首位,发病率占活产新生儿的6‰~10‰[1]。圆锥动脉干畸形(congenital heart conotruncal defects,CTD)是先心病中最为严重的一种类型,约占先心病的30%[2]。CTD是指在遗传和环境因素的共同作用下,胚胎发育早期心脏流出道和大动脉发育异常,临床上表现为法洛四联症、肺动脉闭锁、大动脉转位、右室双出口、永存动脉干等多种复杂心血管畸形,常出现紫绀和低氧血症,是造成我国婴儿和新生儿死亡最主要的原因之一。
心脏特异性转录因子NKX2-5高度保守,是脊椎动物心脏育生中较早表达的转录因子,是心脏前体细胞最早的标志物,参与心脏发育的整个过程。NKX2-5自胚胎发育第7.5天开始持续表达,其正常表达对心脏的环化、心房及心室发育、动脉干分隔、房室瓣形成及房室传导的维持均起重要作用[3]。动物实验显示,NKX2-5参与了胚胎心脏发育,是引起心脏畸形的关键因素,敲除NKX2-5基因的小鼠胚胎在10.5天由于心脏缺失而死亡[4]。临床研究显示,NKX2-5基因在患儿人群中发生突变的比例非常低,如法洛四联症和房间隔缺损患者中仅有4%发生突变[5]。最近也有学者提出,基因序列的改变不是NKX2-5引起心脏畸形的主要原因[6]。
除了编码序列改变可以导致基因的功能异常以外,基因启动子区域的甲基化变化也可以影响基因的表达,从而使所编码的蛋白出现量的差异。本研究拟通过比较该基因在正常心脏组织与CTD病变组织中的甲基化状态的差异,了解NKX2-5基因的甲基化状态与CTD的关系,为先心病的早期基因诊断提供理论依据。
1 材料和方法
1.1 材料
1.1.1 主要试剂 Tru1l限制性内切酶购自Fermentas公司,IPTG购自Promega公司,蛋白酶抑制剂购自Sigma公司,Glutathione Sepharose 4B购自GE Healt hcare公司,组织基因组DNA提取试剂盒购自AXYGEN公司,PCR产物回收试剂盒购自QIAGRN公司,LA Taq聚合酶、T4 DNA连接酶和实时定量PCR试剂均购自Ta KaRa公司,所有引物均在上海桑尼生物公司合成。含有PET4-GST-MBD重组质粒的大肠杆菌为本实验室保存。
1.1.2 研究材料 正常儿童心脏组织取自复旦大学法医学系。圆锥动脉干畸形病变组织由复旦大学附属儿科医院提供。本研究涉及的人体组织样本均经所有研究对象签署知情同意书。
1.2 方法
1.2.1 NKX2-5基因启动子区Cp G岛预测及Real Time PCR引物设计 登陆http://genome.ucsc.edu/网站,查找人的NKX2-5基因启动子区,通过甲基化分析软件(Methyl Primer Express v 1.0)确定启动子区的Cp G岛位置,根据Tru1l限制性内切酶的酶切位点,确定Real Time PCR的扩增区域,然后利用引物设计软件(primer premier 5)设计Real Time PCR引物。
1.2.2 基因组片段化与接头连接 组织样品基因组DNA按照QIAGEN公司的组织基因组DNA提取试剂盒步骤进行提取。取正常心脏组织和CTD病变组织基因组各1μg,利用Tru1l限制性内切酶进行酶切,反应体系为:各基因组1μg,Tru1l酶1μL,10×buffer 2.5μL,补加灭菌蒸馏水至终体积为25μL,再加入10μL石蜡油防止蒸发,反应条件为65℃3~4小时,利用酶切回收试剂盒对酶切产物进行回收。接头引物序列为:H-24,5-AGG CAA CTG TGC TAT CCG AGG GAT,H-12,5-TAA TCC CTC GGA。各取200μM的接头引物100μL,94℃5分钟,然后将2种引物汇合,自然冷却形成接头。利用T4 DNA连接酶,将基因组DNA酶切回收产物与制备的接头进行连接,反应体系为:10×T4 buffer 5μL,酶切回收产物 10μL,接头 2μL,PEG4000 4μL,T4连接酶2μL,补加灭菌蒸馏水至终体积为50μL,反应条件为16℃,过夜。
1.2.3 GST/MBD融合蛋白的表达纯化及活性检测将含有PET4-GST-MBD重组质粒的大肠杆菌在LB-Kan平板上进行划板,37℃培养过夜;挑取单克隆,接种于10ml LB-kan液体培养基中;次日将培养液接种于200ml LB-kan液体培养基中进行扩大培养;用终浓度为1m M的IPTG诱导3~4小时以表达GST/MBD融合蛋白,分别在1.5小时(诱导前)、4小时(诱导后)取待检测样品,通过SDS-聚丙烯酰胺凝胶电泳和考马斯亮蓝染色检测诱导表达结果。200ml诱导后菌液离心后悬浮在PBS-T(1%Triton X-100)缓冲液中,此缓冲液中含有终浓度为1m M的PMSF和50mg/ml的溶菌酶,冰上放置30分钟,超声破碎细胞,溶解产物经高速离心,上清过Glutathione Sepharose 4B层析柱,并用10倍柱体积的PBS洗去非特异性结合的蛋白,用低盐浓度结合缓冲液洗去大肠杆菌DNA,最后获得纯化的GST/MBD蛋白[7]。本实验室前期研究已证实,采用不同的盐离子强度的缓冲液进行洗脱,可以把甲基化的DNA和非甲基化的DNA分开,实验条件为:100m M NaCl缓冲液为结合缓冲液,500m M NaCl缓冲液为洗涤缓冲液,1 000m M NaCl的缓冲液为洗脱缓冲液[8]。
1.2.4 基因组中甲基化DNA富集 取GST/MBD蛋白层析柱100μL,离心去上清,用100μL 500m M NaCl的洗涤缓冲液平衡2次,在含有100m M NaCl的结合缓冲液中结合基因组DNA,放在摇床上4℃结合1小时。用500m M NaCl的缓冲液洗涤,以去除非甲基化DNA,最后用1 000m M NaCl的洗脱缓冲液洗脱并回收甲基化DNA。
1.2.5 LM-PCR扩增富集甲基化DNA 由于富集下来的甲基化DNA量较少,不能满足后续实验的要求,因此需要对富集的甲基化DNA进行有效的扩增。以富集的甲基化DNA为模板,H24为引物进行2轮LM-PCR扩增,从而获得足够量的富集甲基化DNA的PCR产物,用PCR产物回收试剂盒进行纯化回收,-20℃储存以备后续研究。
1.2.6 Real Time PCR检测样本中NKX2-5基因的甲基化状态 采用SYBR Green Real Time检测样本NKX2-5基因启动子区CpG岛的甲基化状态。实验中选取6例先天性圆锥动脉干畸形组织样本和1例正常心脏组织样本作为研究对象,各取100ng富集甲基化DNA LM-PCR产物为模板,以DXZ4为内参,利用比较定量法,根据Ct值与起始模板拷贝数呈线性关系,分析不同样本中Ct值的变化,每个样本重复3次,取其平均值。反应体系及反应条件严格按照试剂盒说明书进行。
2 结果
2.1 NKX2-5基因启动子区Cp G岛的预测及Real Time PCR扩增区域的确定 利用http://genome.ucsc.edu/网站及甲基化分析软件(Methyl Primer Express v1.0)确定NKX2-5基因转录起始点上游5kb内有3个Cp G岛(图1),根据Tru1l酶切片段的大小以及启动子区的确定,本研究选取了Cp G岛2中的1段,利用引物设计软件(primer premier 5)设计Real Time PCR引物,其上游引物为:GGCTTTGATGAGGGACAGGA,下游引物为CAAGGTGCGGAGGAAACG,产物长度为162bp。
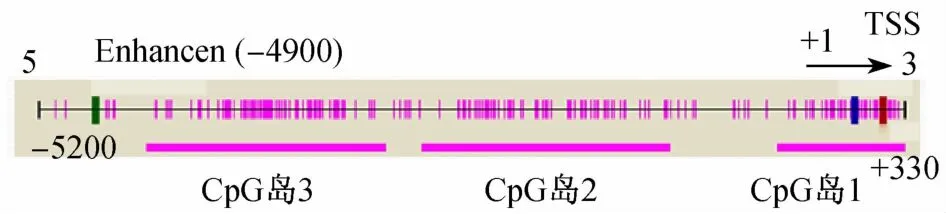
图1 NKX2-5基因启动子区Cp G岛分布
2.2 基因组DNA片段化与接头连接分析 Tru1l酶切位点是TTAA,对基因组DNA进行酶切时可以保留绝大部分Cp G点的完整性,同时片段化基因组的大小集中在300~700之间(图2A),符合实验的预期目标。接头连接的成功与否直接关系到后续实验的成败。以连接产物为模板,H24为引物进行PCR扩增,琼脂糖凝胶电泳分析表明接头连接成功(图2B)。
2.3 GST/MBD融合蛋白的表达纯化 含有PET4-GST-MBD重组质粒的大肠杆菌,用IPTG诱导表达GST/MBD融合蛋白,SDS-聚丙烯酰胺凝胶电泳检测结果表明,在菌液的上清中有大量的融合蛋白表达,表达的融合蛋白经过Glutathione Sepharose 4B柱纯化,可以得到纯度较高的蛋白,其分子量大小与预期大小一致(图3)。
2.4 Real Time PCR检测结果分析 通过Real Time PCR检测,与正常心脏组织相比,不同CTD病变组织中NKX2-5基因的Ct值发生不同程度的改变(表1),其值变化范围在15~35之间,属于正常分析范围;根据其扩增曲线(图4)以及RQ柱状图分析(图5),样本T8、T11、T27和T76呈现高甲基化,分别是正常心脏组织样本的3.5、4.2、2.1和2.4倍,T6和T19则无明显变化。
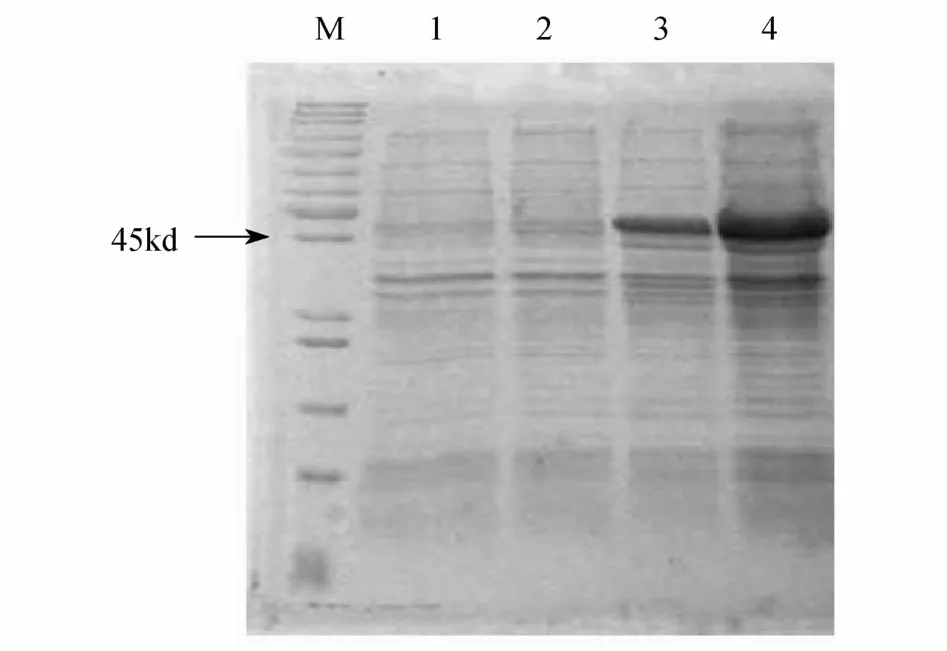
图3 GST/MBD融合蛋白的表达和纯化

表1 正常心脏组织和不同病变组织样本中NKX 2-5基因Real Time PCR Ct值

图4 NKX2-5基因启动子甲基化Real Time PCR扩增曲线图
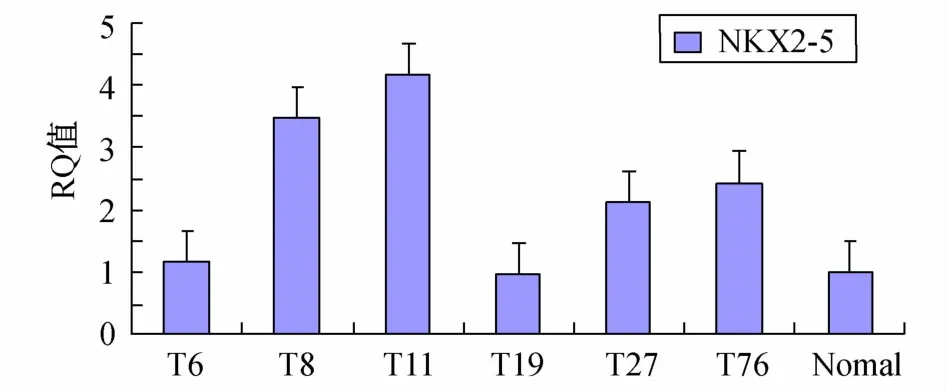
图5 NKX2-5基因启动子甲基化Real Time PCR RQ检测结果
3 讨论
人NKX2-5基因定位于染色体5q35,含2个外显子,编码324个氨基酸。NKX2-5基因位于众多对心脏发育有重要作用基因的上游,如TFGBR3、EDG7、BMP10、CX43、NPPA,以及最近发现的Etsrp71和Chibby等。应用原位杂交技术发现在NKX2-5基因纯合敲除小鼠中,Anp、MeCP2C、Carp等基因表达受到严重干扰[9]。同时,NKX2-5基因也受 Nodal、Shh/Ihh、Wnt、Notch和BMP2等多个早期胚胎发育相关的信号通路调节[10]。
NKX2-5基因启动子区存在多个具有重要功能的启动子、增强子,以及抑制因子和自动调节因子的结合元件。这些元件在与相应的转录因子结合后,在不同的时间和空间调控NKX2-5基因的表达。本研究利用甲基化结合蛋白(MBD)能够与甲基化DNA特异性结合的特性,将酶切后片段化的基因组甲基化DNA进行有效地富集,同时根据Real Time PCR中Ct值与起始模板拷贝数呈线性关系这种理论,利用SYBR Green Real Time PCR检测CTD样本和正常心脏样本中NKX2-5基因启动子区Cp G岛的甲基化状态。结果表明,该方法灵敏度高,准确性强,能够有效地检测出不同样本之间的甲基化状态。在所测的6例CTD组织样本中,与正常组织样本相比,4例呈现高甲基化,2例甲基化状态改变不明显。由此推断,NKX2-5基因表达异常可能与该基因启动子区甲基化有关。今后我们将扩大样本检测量,以进一步证实这个重要的现象。
总之,在本研究中,通过Real Time PCR检测,我们发现在CTD病变组织中NKX2-5基因启动子区Cp G岛发生了不同程度的甲基化,表明该基因启动子区Cp G岛甲基化可能与先心病的发生有关。同时,这种变化有可能对先心病的早期基因诊断有价值,值得进一步探索。
[1]Hoffman JI,Kaplan S.The incidence of congenital heart disease[J].J Am Coll Cardiol,2002,12:1890-1900.
[2]高燕,黄国英.先心病病因及流行病学研究进展[J].中国循证儿科杂志,2008,3:213-222.
[3]Benson DW,Silberbach GM,Kavanaugh-Mc Hugh A,et al.Mutations in the cardiac transcription factor NKX2.5 affect diverse cardiac developmental pathways[J].J Clin Invest,1999,104:1567-1573.
[4]Harvey RP,Lai D,Elliott D,et al.Homeodomain factor Nkx2-5 in heart development and disease[J].Cold Spring Harb Symp Quant Biol,2002,67:107-114.
[5]Draus JM,Hauck MA,Goetsch M,et al.Investigation of somatic NKX2-5 mutations in congenital heart disease[J].J Med Genet,2009,46:115-122.
[6]Balci MM,Akdemir R.NKX2.5 mutations and congenital heart disease:Is it a marker of cardiac anomalies[J]?Int J Cardiol,2009,[Epub ahead of print].
[7]周贝贝,李明辉,于雅晴,等.一种快速高效的全基因组甲基化Cp G岛富集方法的建立[J].中国生物工程杂志,2008,5:78-82.
[8]陈雅婷,张进,杜颖颖,等.利用甲基化Cp G结合域富集甲基化DNA[J].中国产前诊断杂志(电子版),2008,1:20-24.
[9]Nakashima Y,Ono K,Yoshida Y,et al.The search for Nkx2-5-regulated genes using purified embryonic stem cellderived cardiomyocytes with Nkx2-5 gene targeting[J].Biochem Biophys Res Commun,2009,390:821-826.
[10]Keren-Politansky A,Keren A,Bengal E.Neural ectodermsecreted FGF initiates the expression of Nkx2.5 in cardiac progenitors via a p38 MAPK/CREB pathway[J].Dev Biol,2009,335:374-384.
