红球菌-R04生物降解多卤代联苯的影响因素研究
2010-09-09杨秀清李鹏丽王婧人山西大学生物技术研究所化学生物学与分子工程教育部重点实验室山西太原030006
杨秀清,郑 媛,李鹏丽,王婧人 (山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
红球菌-R04生物降解多卤代联苯的影响因素研究
杨秀清*,郑 媛,李鹏丽,王婧人 (山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
研究了不同取代元素以及取代元素的数量、位置等因素对 Rhodococcus sp. R04降解多卤代联苯的影响.结果表明,联苯苯环第4位上的氢分别被氟、氯、溴以及甲基基团取代后降解率由高到低依次为4-FB>4-CB≥4-MB>4-BrB;当取代元素相同时,随着取代原子数目的增加,多卤代联苯降解率降低;当取代元素及取代原子数目相同时,不同位置的取代对卤代联苯的降解影响较大,特别是2,6位取代会强烈抑制关键酶对卤代联苯的催化降解,导致降解率降低.
Rhodococcus sp. R04;降解;多卤代联苯
Abstract:Three influencing factors, including different substituted elements, numbers and position of substituted elements were investigated to correlate structural features to degradation of polyhalogenated biphenyls by Rhodococcus sp. R04. For mono-substituents, degradation preference of R. sp. R04 were in the order 4-FB>4-CB≥4-MB>4-BrB. When the substituted elements were same, degradation rates of halogenated biphenyls reduced as halogen substitution increased. The strain was relatively insensitive to the halogen substitution pattern on the biphenyl ring, when halogenated biphenyls containing the same halogen substitution and numbers, the effect of the position of substituted halogen on the degradation of polyhalogenated biphenyls was great, especially 2,6-CB, which intensively showed striking resistance to degradation, eventually led to the reduction of degradation rates.
Key words:Rhodococcus sp. R04;degradation;polyhalogenated biphenyls
卤代联苯具有高度的化学稳定性、热稳定性、抗氧化性、较低的蒸汽压和良好的电绝缘性,因而曾被广泛地应用于纺织、电子电器、阻燃剂等各种生产领域[1-3].但由于各种卤代联苯具有持久性有机污染物的特征, 由于使用过程中渗漏、排放进入环境,已造成了长期的大范围污染[4],因此对卤代联苯的降解已经成为了人们十分关注的问题.目前,处理卤代联苯的方法主要是物理法,化学法及焚烧, 但是这些方法价格昂贵容易产生二次污染,微生物处理具有环境友好性,经济性等特点被各国广泛采纳[5].
研究表明,微生物降解多氯联苯有两种途径:厌氧脱氯降解和好氧开环降解[6].红球菌Rhodococcus sp. R04与Rhodococcus sp. RHA1,Rhodococcussp. M5, R.erythropolisBD2, R.globerulusP6相似,是一株新的能够降解卤代联苯的好氧微生物[7-10].本课题组前期利用该菌对几种多氯联苯的降解进行了初步研究[11],结果表明,菌株R04可以降解一系列不同数量取代基的多氯联苯.
本研究考察了卤代联苯苯环上不同取代元素和取代元素的数量、位置对Rhodococcus sp. R04降解能力的影响,以期了解该菌株对几种卤代联苯的降解机制和机理,为利用微生物进行污染修复提供参考.
1 材料与方法
1.1实验材料
1.1.1菌株来源 Rhodococcus sp. R04,来源于由中国科学院微生物研究所.
1.1.2试剂 联苯购自军事医学科学院试剂站,4-Fluorobiphenyl(4-FB), 4,4′-Difluorobiphe nyl(4,4′- FB), 4-Bromobiphenyl(4-BrB), 4,4′-Dib romobiphenyl (4,4′-BrB), 4-Chlorobiphenyl (4-CB), 4, 4′ -Dichlorobiphenyl (4, 4′-CB), 2-Chloro biphenyl (2-CB), 4-methylbiphenyl (4-MB),2,6-Dichlorobiphenyl (2,6-CB),3-Chlorobiphenyl(3-CB), 3,3′-Dichlorobiphenyl (3,3′-CB)和3,4-Di chlorobiphenyl (3,4-CB)均购自美国Fluka公司,色谱纯甲醇购自Dikma公司.
1.1.3培养基 2.93g KH2PO4,5.87g K2HPO4, 0.3gMgSO4, 0.01g FeSO4, 2g NaCl, 5g (NH4)2SO4,微量盐溶液2mL[10],1L蒸馏水.固体培养基中加入1.5%琼脂,使用时加入0.1%联苯作为碳源.
1.2实验方法
1.2.1菌株的活化及培养 将Rhodococcus sp. R04在涂有0.1%联苯的固体基础培养基表面划线,于30℃培养箱放置5d,挑取单菌落接种于含有0.1%联苯的基础盐液体培养基中,30℃、200r/min振荡培养24h.
1.2.2卤代联苯溶液的配制 准确称取/移取一定量的4-FB、4,4′-FB、4-BrB、4,4′-BrB、4-CB、4,4′-CB、4-MB、2-CB、2,6-CB、3-CB、3,3′-CB、3,4-CB、标准试剂溶于N,N′-二甲基甲酰胺中,使其浓度达到40 mmol/L,置于-20℃保存.
1.2.3生物降解多卤代联苯 Rhodococcus sp.R04在含有0.1%联苯的基础培养基中培养,当OD600达到1.0时,经玻璃棉过滤除去联苯固体颗粒,6000r/min离心10min收集菌体,30mL磷酸缓冲液(20mmol/L,pH 8.0)洗涤2次,接着以5mL上述缓冲液重新悬浮菌体,测定其OD600值.菌悬液室温放置2~3小时后加入到含有卤代联苯的基础盐培养基中,至培养基中菌体浓度达到OD600值为0.3.每种卤代联苯的终浓度为400µmol/L.
1.2.4卤代联苯的降解分析 卤代联苯降解的HPLC分析按照文献[12]进行.色谱柱为Thermo Hypersil GOLD C18液相色谱柱(4.6mm× 250mm),流动相为甲醇-水(体积比9:1),流速1.0mL/min,检测波长为每种卤代联苯的最大吸收波长,柱温25℃,进样量为20µL.
样品的处理和分析:于不同时间取含有卤代联苯的培养液,加入等体积色谱纯甲醇,旋涡混合2 min,充分混匀后取1mL离心(12000r/min, 10min),取上清作为待测样品,每个样品中加入一定量的内标物(3-氯代苯甲酸),混匀后取20µL进行HPLC 分析,用内标法[13]计算各样品中卤代联苯的残留量.
2 结果与讨论
2.1相同位置上不同取代元素的卤代联苯的降解
将R04的静息细胞分别加入到含有400µmol/L 4-BrB、4-FB、4-MB,4-CB、4,4′-FB、4,4′-BrB、4,4′-CB的基础培养基中,30℃振荡培养,每隔4h分别取样进行分析.几种卤代联苯的降解率见图1和图2.
由图1可见,菌株R04可以降解4-BrB、4-FB、4-CB、4-MB,培养4h后其降解率分别为71.18%、98.21%、93.92%、93.22%,培养8h时降解率分别达到了95.75%、100%、100%、100%,但是,4-BrB在20h后才能被完全降解.可见,R04可以快速降解这几种单卤代联苯.同时,实验结果也表明,当联苯相同位置上的取代元素不同时,菌株R04对卤代联苯的降解率也不同,当第4位上氢原子分别被卤族元素氟、氯、溴,以及甲基基团取代后,降解率由高到低依次为4-FB>4-CB≥4-MB>4-BrB.由图2可见,培养4h后菌株R04对4,4′-FB、4,4′-CB、4,4′-BrB的降解率分别为39.2%、29.54%、5.67%,培养20h后, 4,4′-FB完全降解,而4,4′-CB、4,4′-BrB的降解率却只有50.37%和14.92%.可见,当联苯的第4位以及其对位上的氢同时被卤族元素氟、氯、溴取代后,降解率由高到低依次为4,4′-FB>4,4′-CB>4,4′-BrB.
典型的PCBs/联苯降解途径中,联苯双加氧酶催化PCBs降解的第一步反应,进攻苯环,加入一分子氧,形成二醇,继续在脱氢酶作用下形成2,3-二羟基联苯,该化合物在2,3-二羟基联苯-1,2-双加氧酶(BphC)的作用下通过间位裂解生成黄色开环化合物2-羟基-6-酮基-6-苯基-2,4-己二烯酸,继而在2-羟基-6-酮基-6-苯基-2,4-己二烯酸水解酶(BphD)的作用下生成氯代苯甲酸或苯甲酸[14].
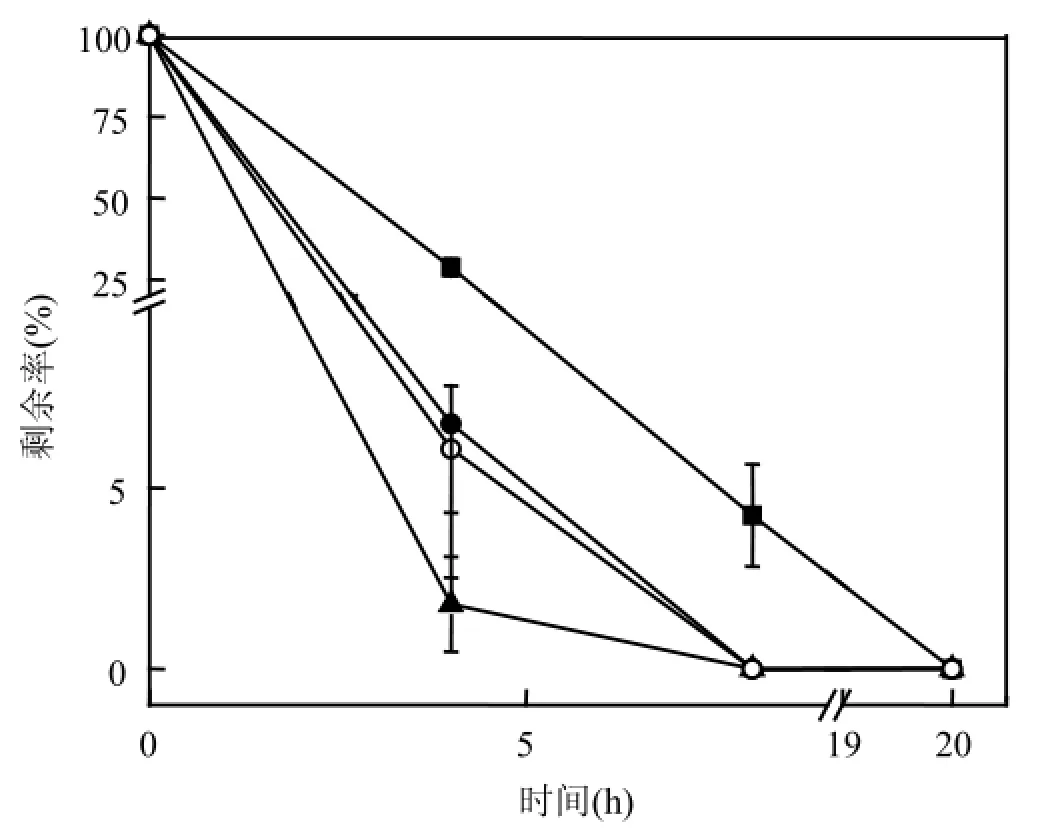
图1 菌株 R04对4-CB、4-MB、4-BrB、4-FB的生物降解动力学过程Fig.1 Biodegradation kinetics of 4-CB, 4-MB, 4-BrB, 4-MB and 4-FB by strain R04

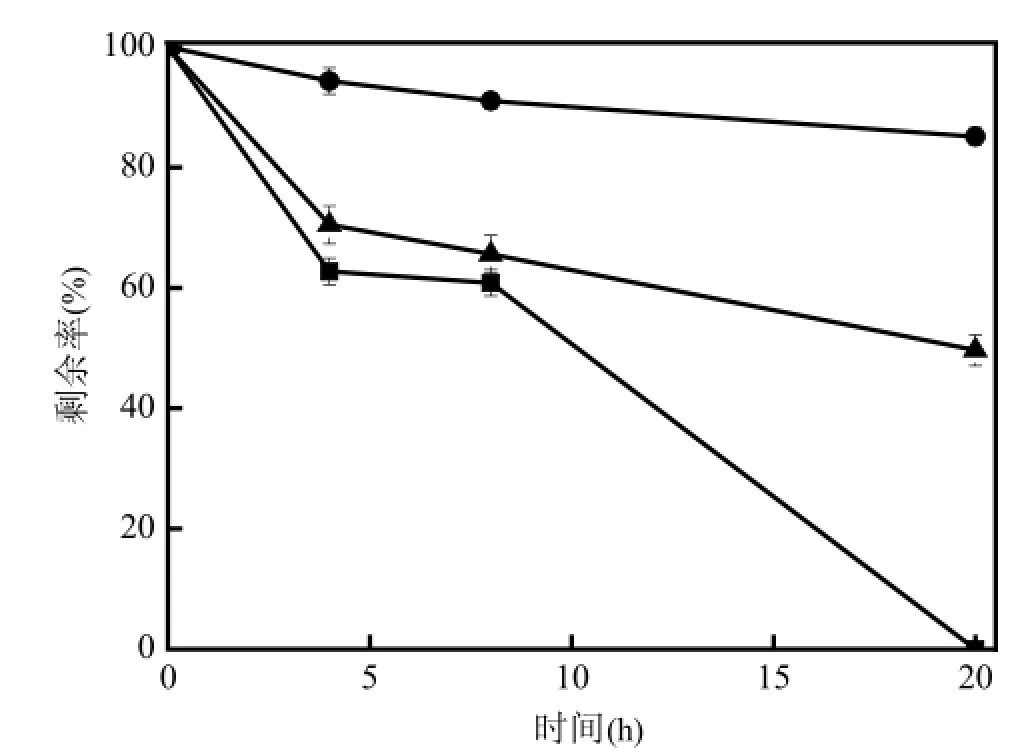
图2 菌株 R04对4,4′-BrB、4,4′-FB、4,4′-CB的生物降解动力学过程Fig.2 Biodegradation kinetics of 4,4′-BrB, 4,4′-FB and 4,4′-CB by strain R04
本实验中,由于联苯/卤代联苯的取代元素不同,因而对上述几种酶产生的空间位阻也不同,其中,氢原子最小,氟次之,氯第三,溴原子半径最大,当降解途径中的一系列酶进攻苯环时,受卤族原子阻挡,原子半径越小所受的阻挡就越小,越有利于酶的进攻,降解率就较高. Bhowmik等[15]也得到了相同的结论,即取代基的大小会影响降解代谢中关键酶(BphD)的催化速率,其降解难易序列为H>F>Cl>Me. 4-BrB的降解率比4-MB的低,这可能是因为尽管溴原子要比甲基基团半径小,但是它的毒性有所增加,对细胞的损伤程度增大,从而导致4-BrB降解率比4-MB的低.
2.2相同元素不同数量的卤代联苯的降解
将R04的静息细胞分别加入到含有400µmol/L 4-CB、4,4′-CB、4-BrB、4,4′-BrB、4-FB、4,4′-FB的基础培养基中,30℃振荡培养,卤代联苯的降解率随取代个数的增加而降低(图1,图2),当联苯上仅4位氢被取代时,培养4h后氟、氯、溴取代的单卤代联苯的降解率都可以达到90%以上,当取代原子增加至2个时,4h后4,4′-FB 的降解率为39.2%, 4,4′-CB的降解率为29.54%,而4,4′-BrB的降解率仅为5.67%,培养20h后,单卤代联苯的降解率都可达到100%,而二卤代联苯中只4,4′-FB的降解率达到了100%.这表明卤代联苯的降解受取代原子数量的影响.由于单卤代联苯取代原子对降解途径中每种酶的空间位阻较小,利于其对苯环的进攻,而当取代原子的数量增加时,空间位阻就会随之增大,阻挡了卤代联苯与联苯双加氧酶活性位点结合因而降解率也会有所下降. Furukawa等[16], Eisenreich等[17], Svobodova等[18]的研究也证实了这一观点.
2.3同种元素不同取代位置的卤代联苯的降解
将R04的静息细胞分别入加到含有400µmol/L 2-CB、3-CB、4-CB、3,3′-CB、3,4-CB、2,6-CB 的基础培养基中,30℃振荡培养,每隔4h取样进行分析.几种不同的卤代联苯的降解率如图3所示,对于单氯联苯,受不同位置取代的影响较小,在5h内,2-CB、3-CB、4-CB的解率分别为100%、89.5%、98.6%,这是因为单氯联苯只有一个位置的氢被氯原子取代,降解途径中各种酶受其空间位阻的影响较小.而对于二氯联苯来讲,取代位置的不同对降解有较大的影响,培养4h时3,3′-CB、3,4-CB、2,6-CB的降解率分别为91.05%、92.35%、8.64%.
由此可见,菌株R04对二氯联苯的降解有很大的差别,这主要是由联苯双加氧酶以及2,3-二羟基联苯1,2-双加氧酶作用机制造成的,它们都是通过进攻苯环的2,3位之间的键作用的.2,6-CB的两个氯原子都位于另一苯环的2位附近,严重的阻挡了联苯双加氧酶和2,3-二羟基联苯1,2-双加氧酶的作用,所以降解作用较缓慢,但20h后其降解率仍然可达35.74%,这与以往只有很少的菌株能够降解2,6-CB的研究[19]有所不同.3,4-CB的降解率略高于3,3′-CB,这是由于取代位点集中在一个苯环上比分布在不同苯环上的PCBs更易代谢.同时还发现二氯联苯3,3′-CB、3,4-CB的降解率要比单氯联苯3-CB的降解率高,这在以往的报道中很少见,Donna等[20]通过几种不同的菌株对单氯联苯、二氯联苯的降解实验也得出了相类似的结果,其原因可能是由于菌株不同造成的.

图3 菌株R04对2-CB、3-CB、4-CB、3, 3′-CB、3, 4-CB、2, 6-CB的生物降解动力学过程Fig.3 Degradation kinetics of 2-CB, 3-CB, 4-CB, 3,3′-CB, 3, 4-CB and 2, 6-CB by strain R04
3 结论
3.1Rhodococcus sp. R04是一株高效降解卤代联苯的菌株,该菌在4h内降解90%以上的4-FB、4-CB、4-MB、2-CB等单卤代联苯及3,3′-CB和3,4-CB;对难以降解的2,6-CB,20h后的降解率可达35.74%;对4,4′-BrB,20h后的降解率仅为5.67%.
3.2卤代联苯环上不同取代元素以及取代元素的数量、位置对菌株R04的降解影响较大,表现为:苯环第4位上氢分别被卤族元素氟、氯、溴以及甲基基团取代后降解率依次为4-FB>4-CB≥4-MB>4-BrB;当取代元素相同时,随着取代原子数目的增加,降解率减小;不同的取代位置对卤代联苯的降解影响较大,特别是2,6位取代会极大的阻碍菌株R04相关酶系对其的转化.
[1] Weber K, Goerke H. Persistent organic pollutant (POPs) in Antarctic fish: levels, patterns, changes [J]. Chemosphere, 2003, 53(6):667-678.
[2] Renner R. Increasing levels of flame retardants found in North American environment [J]. Environ. Sci. Technol., 2000,34(21): 452-453.
[3] Sanggoo K, Flynn W P. A novel bacterium that utilizes monochlorobiphenyls and 4-chlorobenzoate as growth substrates [J]. FEMS. Microbiol. Lett., 2000,185:225-229.
[4] Hope B, Scatolini S, Titus E. Bioconcentration of chlorinated biphenyls in biota from the North Pacific Ocean [J]. Chemosphere, 1998, 36(6):1247-1261.
[5] 徐 莉,滕 应,张雪莲,等.多氯联苯污染土壤的植物-微生物联合田间原位修复 [J]. 中国环境科学, 2008,28(7):646-650.
[6] Abramowicz D A. Aerobic and anaerobic biodegradation of PCBs: review [J]. Crit. Rew. Biotechnol., 1990,10:241-300.
[7] Asturias JA, Timmis KN. Three different 2, 3-dihydroxybiphenyl-1, 2-dioxygenase genes in the gram-positive polychlorobiphenyl degrading bacterium Rhodococcus globerulus P6 [J]. J. Bacteriol., 1993,175(15):4631-4640.
[8] Chung S Y, Maeda M, Song E, et al. Isolation and characterization of a Gram-positive polychlorinated biphenyldegrading bacterium, Rhodococcus erythropolis strain TA421, from a termite ecosystem [J]. Biosci. Biotechnol. Biochem., 1994, 58(11):2111-2113.
[9] Seto M, Kimbara K, Shimura M, et al. A novel transformation of polychlorinated biphenyls by Rhodococcus sp. strain RHA1 [J]. Appl. Environ. Microbiol., 1995,61(9):3353-3358.
[10] Wang Y, Garnon J, Labbe D et al. Sequence and expression of the bpdC1C2BADE genes involved in the initial steps of biphenyl/chlorobiphenyl degradation by Rhodococcus sp. M5 [J]. Gene, 1995,164(1):117-122.
[11] Yang Xiuqing, Sun Yan, Qian Shijun. Biodegradation of seven polychlorinated biphenyls by a newly isolated aerobic bacterium (Rhodococcus sp. R04) [J]. J. Ind. Microbiol. Biotechnol., 2004, 31(9):415-420.
[12] Hayteas D L, Duffield D A. The determination by HPLC of PCB and p, p'-DDE residues in marine mammals stranded on the Oregon Coast, 1991-1995 [J]. Marine Pollution Bulletin, 1997, 34(10):844-848.
[13] 祝永明,涂厉标,王 真.互为内标法测定去甲万古霉素与万古霉素的血药浓度 [J]. 中国医院药学, 2005,25(12):1127-1128.
[14] Furukawa K. Moleclar genetics and evolutionary relationship of PCBs-degrading bacteria [J]. Biodegradation, 1994,5(3/4):289-300.
[15] Bhowmik S, Horsman G P, Bolin J T, et al. The molecular basis for inhibition of BphD, a C-C bond hydrolase involved in polychlorinated biphenyls degradation [J]. The Journal of Biological Chemistry, 2007,282(50):36377-36385.
[16] Furukawa K, Tomizuka N, Kamibaya A. Effect of chlorine substitution on the bacterial metabolism of various polychlorinated biphenyls [J]. Appl. Environ. Microbiol., 1979, 38(2):301-310.
[17] Eisenreich K M, Kelly S M, Rowe C L. Latent mortality of juvenile snapping turtles from the Upper Hudson River, New York, exposed maternally and via the diet to polychlorinated biphenyls (PCBs) [J]. Envioron. Sci. Technol., 2009,43(15): 6052-6057.
[18] Svobodova K, Plackova M, Novotna V, et al. Estrogenic and androgenic activity of PCBs, their chlorinated metabolites and other endocrine disruptors estimated with two in vitro yeast assays [J]. Sci. Total. Environ.,2009,407(22):5921-5925.
[19] Bedard D L, Unterman R, Bopp L H, et al. Rapid assay for screening and characterizing microorganisms for the ability to degrade polychlorinated biphenyls [J]. Appl. Environ. Microbiol., 1986,51(4):761-768.
[20] Bedard D L, Haberl M L. Influence of chlorine substitution pattern on the degradation of polychlorinated biphenyls by eight bacterial strains [J]. Microbial Ecology, 1990,20(2):87-102.
Influencing factor for the biodegradation of polyhalogenated biphenyls by Rhodococcus sp. R04.
YANG Xiu-qing*, ZHENG Yuan, LI Peng-li, WANG Jing-ren (Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education, Instiute of Biotechnology, Shanxi University, Taiyuan 030006, China). China Enviromental Science, 2010,30(5):694~698
X172
A
1000-6923(2010)05-0694-05
杨秀清(1975-),男,山西代县人,副教授,博士,主要从事微生物生物转化与生物催化研究.发表论文20余篇.
2009-09-08
国家自然科学基金资助项目(30800030)
* 责任作者, 副教授, xiuqyang@sxu.edu.cn
