血红素加氧酶-1显性负性突变体转基因小鼠模型的建立与鉴定
2010-09-09王波程萱刘庆军魏旭冉尹玉静高旭杨晓周虹
王波,程萱,刘庆军,魏旭冉,尹玉静,高旭,杨晓,周虹
(1.军事医学科学院野战输血研究所,北京 100850;2.军事医学科学院生物工程研究所,北京 100071; 3.哈尔滨医科大学生化教研室,哈尔滨 150081)
研究报告
血红素加氧酶-1显性负性突变体转基因小鼠模型的建立与鉴定
王波1,程萱2,刘庆军1,魏旭冉1,尹玉静1,高旭3,杨晓2,周虹1
(1.军事医学科学院野战输血研究所,北京 100850;2.军事医学科学院生物工程研究所,北京 100071; 3.哈尔滨医科大学生化教研室,哈尔滨 150081)
目的建立血红素加氧酶-1(heme oxygenase-1,HO-1)显性负性突变体G143H转基因小鼠模型。方法通过SalI/DraI酶切pCAGGHO-1G143H转基因表达载体,纯化回收HO-1G143H表达盒片段;通过显微注射把表达目的基因的DNA片段导入FVB小鼠受精卵原核,并移植给同期发情的假孕受体母鼠,获得子代小鼠;用PCR对子代鼠尾DNA进行鉴定,并用Southern blot对结果做进一步验证;通过RT-PCR、免疫组化和Western blot方法检测HO-1基因的表达。结果表达盒回收片段正确;假孕鼠出生的17只子代小鼠共有3只阳性,均为雄性;RTPCR、免疫组化和Western blot结果表明,阳性小鼠体内的HO-1 mRNA与蛋白表达水平增高。结论成功建立HO-1显性负性突变体G143H表达的转基因小鼠,该模型为研究HO-1在体内的作用机制奠定了基础。
HO-1;显微注射法;转基因小鼠
血红素加氧酶-I(heme oxygenase-1,HO-1)是降解血红素为胆绿素、CO和Fe2+的限速酶。它也是一种应激蛋白,具有抗氧化、抗炎症、抗凋亡、下调血管内皮细胞间黏附分子表达,减少血管损伤,增加移植器官的血流灌注等作用[1]。对HO-1基因缺失小鼠和一例患者的研究表明,HO-1在机体中起着非常重要的作用。HO-1缺失(缺失外显子3和4以及外显子5的一部分)的成年小鼠表现出异常贫血,铁离子在血清中的含量降低,并且沉积于肝脏和肾脏,最终造成生物大分子的氧化损伤、组织损害和慢性炎症。世界上唯一一例HO-1表达缺失的病例[2],其母系HO-1等位基因第2外显子完全缺失和其父系HO-1等位基因第3外显子两个核苷酸缺失。这一患者表现生长迟缓,持续的溶血性贫血、严重的持续性内皮细胞损伤、铁沉积、对氧化应激损伤极度敏感。由此可见HO-1外显子2-5对维持HO-1的正常功能都是必需的。
当前,在动物水平开展的HO-1与疾病的相关性研究,主要是通过HO-1的诱导剂或抑制剂来改变机体的HO-1水平的方式来进行的。但是这些试剂的作用机制复杂、缺乏特异性,故不利于问题的阐明。HO-1作为一种保护作用的酶,其作用就是将其有毒底物分解成有活性的产物,但是我们不清楚HO-1对机体的保护作用是通过HO-1对其底物的清除作用引起的,还是由其产生的活性产物的作用来发挥的。我们拟通过建立一种既能去除HO-1底物又能使HO-1产物降低的动物模型来研究HO-1在机体中的作用机理。HO-1的显性负性突变体,即第143位甘氨酸(G)突变为组氨酸(H)(HO-1G143H),可以产生一种只具有结合底物活性,但失去了催化分解活性[3]的HO-1。这种HO-1突变体在体内将会通过与体内HO-1竞争性结合底物,去除HO-1的有毒底物,同时由于HO-1的底物的相对量减少而使其产物生成减少。
1 材料与方法
1.1 材料与试剂
pCAGG-HO-1G143H质粒(本室保存),大肠杆菌E.coil DH5α由本实验室保存。限制性内切酶SalⅠ、DraⅠ均为TaKaRa公司产品。兔抗HO-1一抗为本室制备。罗丹明标记山羊抗兔二抗(中杉公司)。FVB鼠由军事医学科学院动物中心提供[SCXK(军)2007-004]。
1.2 HO-1G 143H基因构件制备
将质粒pCAGGHO-1G143H用SalⅠ和DraⅠ酶切,1%琼脂糖凝胶电泳回收目的片段。用QIA quick gel extraction kit纯化回收目的片段(3177 bp)。纯化后DNA溶于Microinjection buffer(pH 7.4)中,注射浓度为3 ng/μL。
1.3 显微注射及F0代鼠的产生
将纯化后的HO-1G143H片段通过显微注射法注入FVB小鼠受精卵原核中,将注射后状态良好的受精卵移植到FVB假孕母鼠的输卵管内,待F0代鼠产生。所有实验用小鼠均在SPF动物房中饲养和繁殖,温度控制在22℃。
1.4 转基因鼠的PCR检测
剪取出生后15 d的鼠尾0.5~1 cm,用酚、氯仿提取DNA方法提取鼠尾DNA。引物序列为:F:5′-ggagcgtccacagcccgaca-3′,R:5′-tgagagtgaggacccactgg aggag-3′,扩增片段长815 bp,PCR反应条件为: 95℃5 min;94℃20 s→60℃10 s→72℃20 s,30循环;72℃延伸10 m in。用1%琼脂糖凝胶电泳分析扩增产物。
1.5 转基因小鼠Southern b lot检测
PCR检测阳性转基因小鼠子代及阴性对照鼠基因组DNA(约20 μg),用HindⅢ过夜酶切,1%琼脂糖凝胶电泳,经凝胶处理后采用毛吸印迹法使DNA转移到尼龙膜上,用紫外交联的方法使DNA固定于膜上。用NcoⅠ和SpeⅠ酶切注射片段,回收纯化作为探针,32P标记后,进行杂交,洗膜,放射自显影。
1.6 转基因小鼠肝组织RT-PCR检测
选取转基因子代小鼠的肝组织,使用Trizol试剂提取其组织总RNA。采用Promega RT-PCR试剂盒进行反转录cDNA及PCR扩增进行RNA水平表达的分析。HO-1基因PCR条件同上。以小鼠βactin基因设为内对照,β-actin F:5′-aggagatc acagccctagca-3′,R:5′-tgaggctagcatgaggtgtg-3′。小鼠β-actin PCR扩增条件为:95℃,5min;94℃,20 s→60℃,10 s→72℃,20 s,25个循环;72℃,10 m in。琼脂糖凝胶电泳分析结果。
1.7 免疫组化法检测HO-1基因的表达
取转基因阳性F1代鼠和FVB野生小鼠的脾组织进行冰冻切片,-20℃冻存。使用免疫组化SP试剂盒(中杉公司)进行基因表达检测。加入兔抗HO-1一抗4℃过夜,二抗为罗丹明标记山羊抗兔IgG,37℃30 min,荧光激发拍照。
1.8 转基因小鼠肝组织HO-1的W estern blot检测
选取转基因鼠肝组织,匀浆后进行BCA蛋白定量,各取50 μg蛋白进行SDS-PAGE,200 mA恒流电转移至PVDF膜上,加入按1∶2000稀释anti-mouse HO-1一抗,孵育过夜,PBST洗膜后加入1∶5000浓度稀释的山羊抗兔二抗,37℃孵育1 h,PBST洗膜后,化学发光法(ECL)显色,显影、定影。
2 结果
2.1 F0代转基因小鼠产生
回收纯化得到3177 bp的片段。将纯化后的HO-1G143H片段通过显微注射法注入FVB小鼠受精卵雄原核中,将注射后状态良好的受精卵移植到假孕母鼠的输卵管内,待F0代鼠产生。所有实验用小鼠均在SPF动物房中饲养和繁殖。共移植注射胚胎64枚给2只移植鼠,得到17只F0代鼠,PCR鉴定3只雄性鼠为阳性,其中一只传下F1代。
2.2 转基因小鼠PCR检测结果
鼠尾基因组DNA PCR检测结果:鼠尾基因组DNA经PCR扩增后,通过1%琼脂糖凝胶电泳阳性小鼠在815 bp处可见扩增条带。见图1。图上显示,阳性动物条带特异、清晰。
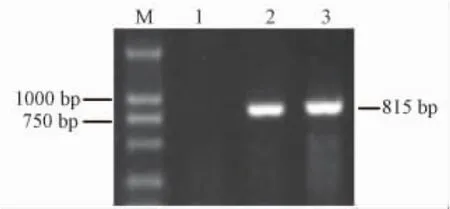
注:M.DL2000 marker;1.野生鼠;2.阳性鼠;3.阳性对照。图1鼠尾DNA PCR检测结果Note:M.DL2000 marker;1.Non-transgenic mice;2.Transgenic mice;3.Positive controlFig.1 Result of PCR products from tails of the transgenic mice
2.3 鼠尾基因组DNA Southern b lot检测结果
阳性F1代Southern blot检测阳性,可见特异3.1 kb整合条带,正常小鼠基因组DNA未见特异条带(图2)。结果显示出阳性动物与阴性对照动物之间明显的差异。
2.4 鼠肝组织RT-PCR检测结果
PCR结果显示HO-1mRNA阳性转基因小鼠中高表达(图3)。野生鼠HO-1转录水平明显低于阳性鼠。
2.5 鼠脾免疫组化检测结果
与野生鼠相比,转基因鼠在脾红髓区HO-1表达增多(图4,彩插3)。可见转基因鼠不仅是HO-1表达数量的增多,还有表达位置的不同。
2.6 鼠肝组织W estern b lot检测结果
Western blot结果显示,转基因小鼠肝匀浆中HO-1蛋白高表达(图5)。

注:1.野生鼠;2.阳性鼠。图2鼠尾DNA Southern blot检测结果Note:1.Non-transgenic m ice;2.Transgenic miceFig.2 Result of Southern blot of the DNA from the tail of transgenic mice

注:1.野生鼠;2.阳性鼠。图3 HO-1 RT-PCR检测结果Note:1.Non-transgenic mice;2.Transgenic miceFig.3 Fig.3 Results of electrophoresis of RT-PCR products of the transgenic mice
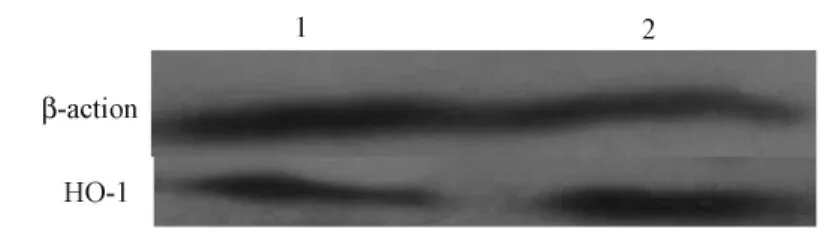
注:1.野生鼠;2.阳性鼠。图5 HO-1 Western blot检测结果Note:1.Non-transgenic mice;2.Transgenic miceFig.5 Expression of HO-1 in the liver detected western blot
3 讨论
HO-1是血红素分解代谢的关键酶,它与很多疾病密切相关,如肿瘤的发生、发展和治疗[1],老年性痴呆症、帕金森病、多发性硬化等退行性和非退行性中枢神经系统疾病[4-6]。而且,HO-1在抗缺血/再灌注损伤(ischemia-reperfusion injury,IRI)方面具有很好的功效[7,8]。由此来看,HO-1表达与疾病关系密切。但其作用机制有待深入研究。
HO-1的底物和产物都具有生物学活性,其底物血红素在机体中是致超氧自由基的主要物质;其产物(胆绿素、CO和Fe2+)具有抗氧化、抗凋亡、抑制免疫反应等保护作用。HO-1对机体行使保护作用,一方面是降解体内致超氧自由基的血红素,另一方面HO-1通过其产物发挥对机体的保护作用。HO-1显性负性突变体HO-1G143H,一方面与血红素结合,与HO-1一起行使去除有毒底物的保护作用;另一方面,与机体HO-1竞争结合底物,致与HO-1结合的底物量减少,从而使HO-1的产物量减少。基于此,本研究利用此突变体HO-1G143H建立的转基因小鼠体内的HO-1量不降低,而产物降低,以此来研究HO-1对动物的影响。
我们用PCR法和Southern blot法对子代鼠尾DNA进行鉴定,结果我们获得了3只阳性转目的基因小鼠。3只F0代阳性鼠均为雄性,推测HO-1G143H可能对小鼠的性别有影响。我们将继续关注HO-1G143H小鼠的病理变化。我们应用RTPCR和Western blot检测小鼠的HO-1 mRNA和蛋白水平表达,结果显示转基因动物在肝组织中转录水平和蛋白水平表达都升高,说明HO-1G143H开始表达,免疫组化检测HO-1在脾中的表达,结果表明HO-1在脾红髓与白髓区均高表达。结果表明,成功建立了HO-1G143H转基因小鼠。此小鼠体内的HO-1去除血红素的功能不变,但HO-1活性产物量降低,将为HO-1的在机体的作用机制和功能及其相关疾病的作用机制研究提供一种较好的动物模型。
(本文图4见彩插3。)
[1]Jozkowicz A,Was H,Dulak J.Heme oxygenase-1 in tumors:is it a false friend?[J].Antioxid Redox Signal,2007,9(12): 2099-2118.
[2]Yachie A,Nida Y,Wada T,et al.Oxidative stress causes enhanced endothelial cell injury in human heme oxygenase-1 deficiency[J].J Clin Invest,1999,103(1):129-135.
[3]Lad L,Koshkin A,De Montellano PR,et al.Crystal structures of the G139A,G139A-NO and G143H mutants of human heme oxygenase-1.A finely tuned hydrogen-bonding network controls oxygenase versus peroxidase activity[J].J Biol Inorg Chem,2005,10(2):138-146.
[4]Calabrese V,Stella AM,Butterfield DA,et al.Redox regulation in neurodegeneration and longevity:role of the heme oxygenase and HSP70 systems in brain stress tolerance[J].Antioxid Redox Signal,2004,6(5):895-913.
[5]Schipper HM.Heme oxygenase expression in human central nervous system disorders[J].Free Radic Biol Med,2004,37 (12):1995-2011.
[6]Takeda A,Itoyama Y,Kimpara T,et al.Heme catabolism and heme oxygenase in neurodegenerative disease[J].Antioxid Redox Signal,2004,6(5):888-894.
[7]Hoekstra KA,Godin DV,Cheng KM.Protective role of heme oxygenase in the blood vessel wall during atherogenesis[J]. Biochem Cell Biol,2004,82(3):351-359.
[8]Tsuchihashi S,Fondevila C,Kupiec-Weglinski JW.Heme oxygenase system in ischemia and reperfusion injury[J].Ann Transplant,2004,9(1):84-87.
Estab lishm ent of a Transgenic M ouse M odel of Hem e Oxygenase-1 Dom inant Negative M utation
WANG Bo1,CHENG Xuan2,LIU Qing-jun1,WEI Xu-ran1,YIN Yu-jing1,GAO Xu3,YANG Xiao2,ZHOU Hong1
(1.Institute of Transfusion Medicine,Academy of M ilitary Medical Sciences,Beijing 100850,China; 2.Institute of Bioengineering,Beijing 100071; 3.Department of Biochem istry and Molecular Biology,Harbin Medical University,Harbin 150086)
ObjectiveTo establish a HO-1 dominant negative mutant G143H transgenic mouse model.M ethods
The purified HO-1G143H fragment,digested from pCAGGHO-1G143H plasmid with Sal I and Dra I,was microinjected into FVB superovulated pronuclear zygotes.The injected zygotes were transplanted into the oviducts of pseudopregnant m ice.The genotype of transgenic mice was identified by PCR and Southern blot.The HO-1 expression in the tissues of the transgenic mice was detected by RT-PCR,immunohistochem istry and Western blot.ResultsThree positive transgenic male m ice were detected from 17 viable offsprings.RT-PCR,immunohistochemistry and Western blot results demonstrated that the levels of HO-1 mRNA and protein were increased in the positive mice.ConlusionA HO-1 dominant negative mutant HO-1G143H transgenic mouse model has been established successfully.The transgenic m ice may serve as a suitable model for the research of HO-1action mechanisms in vivo.
HO-1;M icroinjection;Transgenic mice
Q3
A
1005-4847(2010)03-0181-04
2010-02-24
国家973项目(2009CB521702)。
王波(1976-),男,博士研究生,专业方向:生物化学与分子生物学。
周虹(1966-),女,研究员,专业方向:生物化学与分子生物学(电话:010-66931982,E-mail:zhouhtt@yahoo.com.cn)。
