苏氨酸三肽与DNA相互作用的研究*
2010-09-07王刚马英杰卢奎
王刚,马英杰,卢奎
(1.武汉生物工程学院,湖北武汉430415;2.河南工业大学化学化工学院,河南郑州450052)
苏氨酸三肽与DNA相互作用的研究*
王刚1,马英杰2,卢奎2
(1.武汉生物工程学院,湖北武汉430415;2.河南工业大学化学化工学院,河南郑州450052)
利用紫外-可见光谱法和凝胶电泳法研究了在人体正常的生理环境下苏氨酸三肽与DNA的相互作用。结果表明:苏氨酸三肽可与DNA发生相互作用,二者的作用模式为沟槽结合,结合常数为K=6.4× 105L·mol-1,最大结合数n=7.04。
紫外-可见分光光度法;凝胶电泳法;苏氨酸三肽;DNA;相互作用
脱氧核糖核酸(DNA)是生物体内的重要组成物质,是遗传信息的主要载体。其与生物的生长、发育和繁殖等密切相关。小分子可与其发生相互作用,从而影响人体的生长、发育和繁殖等,从而小分子可应用于生物医药、功能性食品及生命科学等领域[1,2]。
苏氨酸是一种重要的营养强化剂,有恢复人体疲劳,促进生长发育的效果,并且对保护细胞膜起重要作用,在体内能促进磷脂合成和脂肪酸氧化。其制剂具有促进人体发育抗脂肪肝药用效能,是复合氨基酸输液中的一个成分。因此,由它们形成的寡肽,也应具有巨大的潜在应用价值。并且与氨基酸相比,寡肽的吸收速度和效率更高,且其可由肠道不经降解直接吸收[3,4]。由此可以推测苏氨酸形成的寡肽比苏氨酸本身更易被人体吸收,其可能具有比苏氨酸更高的生物活性。
因此,为了研究苏氨酸寡肽在生物医药、功能性食品及生命科学等领域的潜在应用价值,考察了苏氨酸三肽(Thr-Thr-Thr)与DNA的相互作用。
1 实验部分
1.1 仪器与试剂
UV-2450紫外-可见分光光度计(日本岛津公司);DYY-8C型电泳仪(北京市六一仪器厂);紫外凝胶成像仪(美国BIO-RAD(伯乐)公司)。
苏氨酸三肽参照文献方法制备[5],用二次蒸馏水配成浓度为3.490×10-4mol·L-1的溶液;DNA(A. R.Sigma公司,0~4℃保存,用前未作进一步处理,纯度以260 nm与280 nm处吸光度的比值检测(A260/A280=1.872>1.8,符合实验要求),利用260 nm处的吸光度确定其浓度(ε=6600 L·(mol·cm)-1)为2.227×10-3mol·L-1;1.0 mol·L-1NaCl溶液;1.0 mol· L-1NaH2PO4溶液;Tris-HCl缓冲溶液(pH值为7.40)。其余试剂均为分析纯,实验用水为二次蒸馏水。
1.2 实验方法
1.2.1 紫外-可见吸收光谱法研究Thr-Thr-Thr与DNA的相互作用
(1)分别取配好的DNA溶液、Thr-Thr-Thr溶液、NaCl溶液和NaH2PO4溶液各100μL,用Tris-HCl缓冲液稀释到10mL,用Tris-HCl缓冲液作参比测定200~400nm的紫外吸收光谱。
(2)Thr-Thr-Thr浓度对Thr-Thr-Thr-DNA体系紫外光谱的影响于一系列10 mL比色管中加入相同体积的DNA溶液,一定量的Thr-Thr-Thr溶液,其加入量以一系列Rt(Rt=cThr-Thr-Thr/cDNA,下同)值确定,用Tris-HCl缓冲溶液稀释至刻度,混匀,于37℃下放置1 h后,以相应的Thr-Thr-Thr溶液作参比,进行紫外光谱扫描。
(3)作用时间对Thr-Thr-Thr-DNA紫外光谱的影响于一系列10 mL比色管中,在Thr-Thr-Thr-DNA体系中(Rt=2),用Tris-HCl缓冲溶液稀释至刻度,摇匀,于37℃下放置数小时后,以相应的Thr-Thr-Thr溶液作参比,测定其紫外吸收光谱。
(4)Na+强度对Thr-Thr-Thr-DNA体系紫外光谱的影响于一系列10mL比色管中,在Thr-Thr-Thr-DNA体系中(Rt=2),以NaCl调节离子强度,用Tris-HCl缓冲溶液稀释至刻度,摇匀,于37℃下放置1 h后,以相应的Thr-Thr-Thr溶液作参比,测定其紫外吸收光谱。
(5)PO43-浓度对Thr-Thr-DNA体系紫外光谱的影响于一系列10 mL比色管中,在Thr-Thr-Thr-DNA体系中(Rt=2),加入不同浓度的NaH2PO4溶液,用Tris-HCl缓冲溶液稀释至刻度,摇匀,于37℃下放置1 h后,以Thr-Thr-Thr溶液作参比,测定其紫外吸收光谱。
(6)结合常数的计算采用公式:ΔA-1=(ΔεCL)-1+(ΔεKCL)-1CP-1计算Thr-Thr-Thr与DNA的结合常数和最大结合数。
2.2.2 凝胶电泳法研究Thr-Thr-Thr与pUC18DNA相互作用向上样槽中加入1μL pUC18DNA溶液(0.5μg·μL-1),然后加入不同体积的苏氨酸三肽溶液(0、1、2、3、4、5、6、7、8和91μL),再加入水,使反应液终体积保持一致,混合均匀。37℃放置1 h后,加入2μL的上样缓冲液TBE,用质量分数为0.8%的琼脂糖凝胶,稳压80 V,电泳60 min,取出凝胶,使用凝胶成像分析系统成像。
2 结果与讨论
2.1 紫外-可见吸收光谱法
2.1.1 DNA、苏氨酸三肽(Thr-Thr-Thr)溶液紫外吸收光谱的测定(图1)

图1DNA与Thr-Thr-Thr的紫外吸收光谱Fig.1The UV-Vis absorption spectroscopy of DNA and Thr-Thr-Thr(a.DNA b.Thr-Thr-Thr)
对DNA进行紫外光谱扫描,发现其在λ=260nm有最大吸收;Thr-Thr-Thr在260nm附近也有紫外吸收,因此,在紫外光谱法研究Thr-Thr-Thr浓度对Ph-DNA紫外吸收影响时,须用相应的Thr-Thr-Thr溶液作参比,以扣除Thr-Thr-Thr在λ=260nm处的吸收。
2.1.2 苏氨酸三肽(Thr-Thr-Thr)浓度对DNA紫外光谱的影响(图2)

图2Thr-Thr-Thr浓度对Thr-Thr-Thr-DNA体系紫外吸收光谱的影响Fig.2UV-Vis absorption spectra of different concentration of Thr-Thr-Thr interacted with DNA
由图2可知,在Thr-Thr-Thr-DNA体系中,随着Thr-Thr-Thr的浓度不断增加,DNA分子在260nm处的紫外吸收呈增色效应。在Rt值为0~2阶段,增色效应较为明显,增色率较大;在Rt值为2~6阶段,增色率不大。
增色效应可能是Thr-Thr-Thr以氢键作用或范德华力的方式与DNA的大沟或小沟的碱基边缘直接发生相互作用,破坏了DNA的双螺旋而产生的。DNA的碱基是紫外光谱的生色团。在正常情况下,DNA的碱基是被包裹在DNA磷酸骨架内部的。磷酸骨架的存在,减弱了碱基的紫外吸收。当有外在的物质与DNA发生作用时,外在物质破坏了DNA分子的双螺旋结构,使得碱基从严密的包裹状态下,暴露出来。这将使得DNA的紫外吸收明显的增加[6]。
然而,在本文中Thr-Thr-Thr的加入会使得DNA的紫外吸收发生增色效应,但增色率不大(在Rt值0~6范围内,约为:8.8%)。这说明可能是Thr-Thr-Thr以沟槽作用的方式与DNA的碱基发生作用,有限度的改变了DNA的双螺旋结构,但没有从根本上破坏DNA的双螺旋。
2.1.3 作用时间对Thr-Thr-Thr-DNA体系紫外光谱的影响(图3)
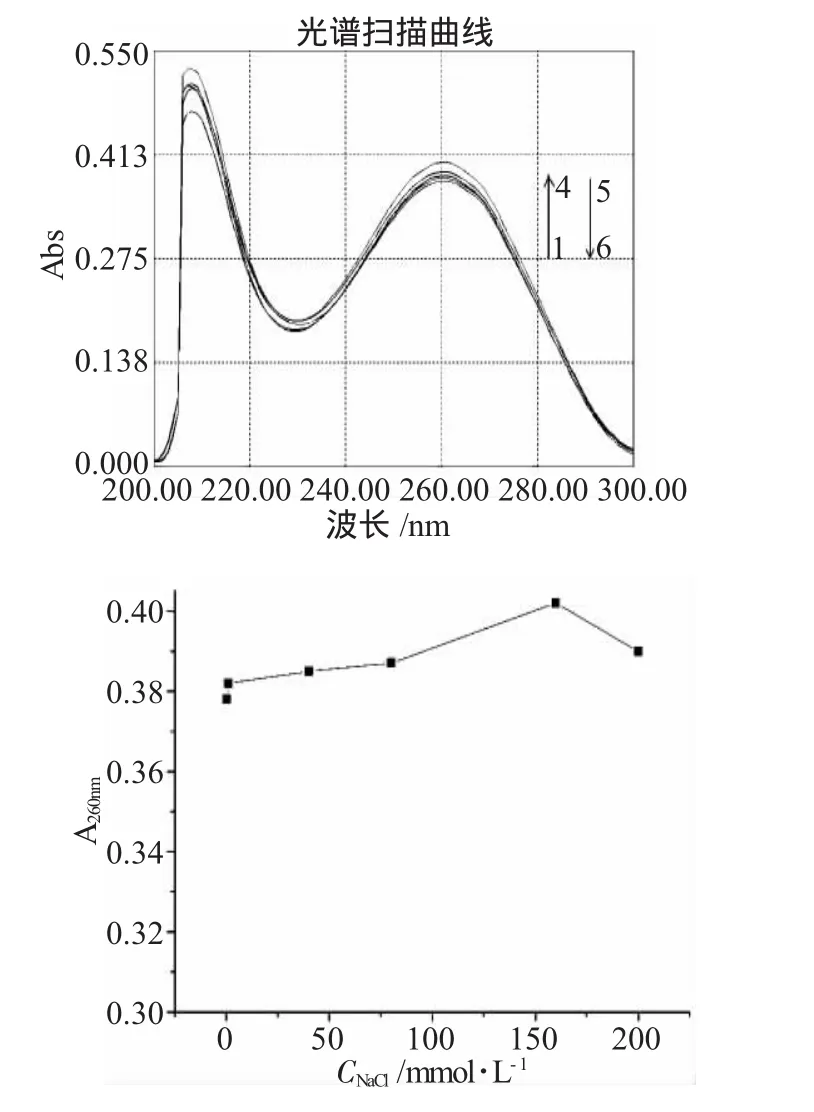
图3 时间对Thr-Thr-Thr-DNA体系紫外光谱的影响Fig.3UV-Vis absorption spectra of different interaction time of Thr-Thr-Thr interacted with DNA
随着时间的延长,Thr-Thr-Thr-DNA体系的紫外吸收发生增色效应。在6h内,增色效应较为明显,增色率达到了15.3%;而在其后的8h内,Thr-Thr-Thr-DNA体系的紫外吸收的增色效应不明显,增色率仅为2.7%。
可能的原因是:Thr-Thr-Thr与DNA发生相互作用是动态的,二者之间的相互作用要达到动态的平衡是需要一定时间的。这个时间可能就是6h。经过6h,Thr-Thr-Thr与DNA的相互作用达到了平衡状态,此时Thr-Thr-Thr-DNA体系也就达到了稳定的状态,体系的紫外吸收也达到了一个较为稳定的值。此后,再延长时间,也不会对Thr-Thr-Thr-DNA体系产生影响。因此,Thr-Thr-Thr-DNA体系的紫外吸收也就保持基本恒定。
2.1.4 体系Na+强度对Thr-Thr-Thr-DNA体系紫外光谱的影响(图4)
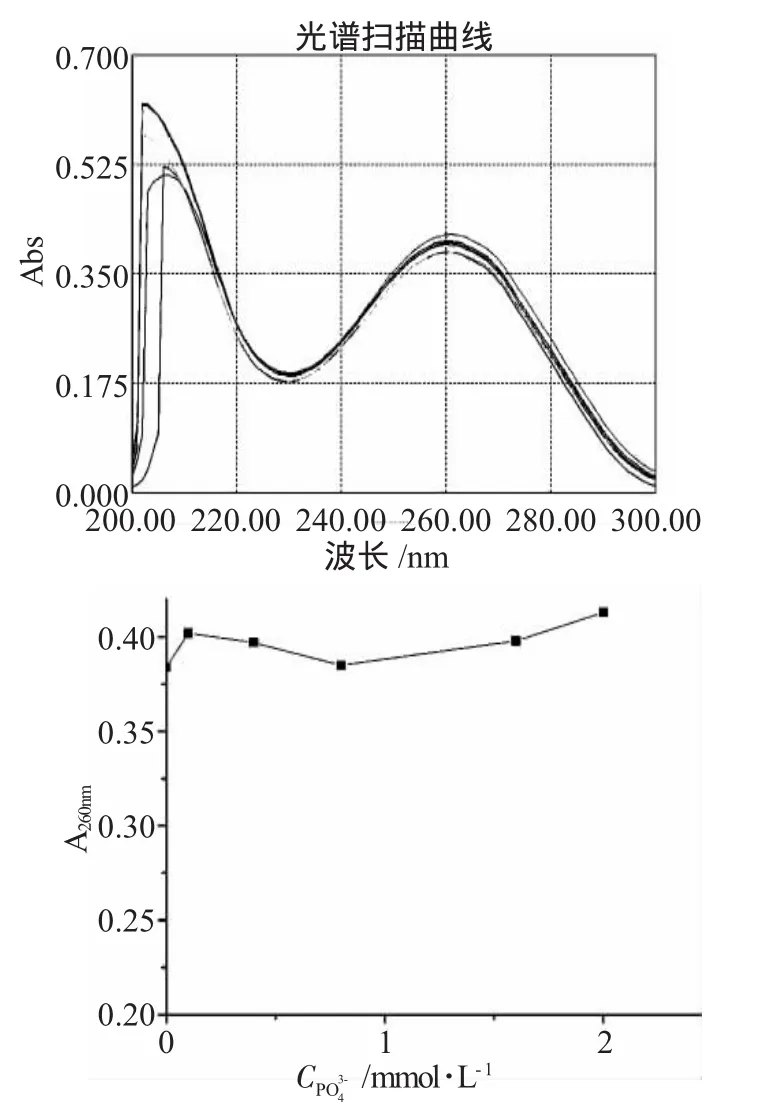
图4Na+强度对Thr-Thr-Thr-DNA体系紫外光谱的影响Fig.4Effect of salinity on the UV-Vis absorption spectra of Thr-Thr-Thr interaction with DNA
由图4可知,在0~160mmol·L-1的Na+浓度范围内,随着Na+浓度的增加,Thr-Thr-Thr-DNA体系的紫外吸收发生一定的增色效应,增色的幅度约为6.3%;当Na+浓度从160mmol·L-1增加到200mmol· L-1,Thr-Thr-Thr-DNA体系的体系的紫外吸收有一定程度的降低,降幅约为3%。
以上现象的原因可能是Thr-Thr-Thr使得DNA的立体构象发生改变,当然Na+浓度会维持并稍稍加大这一改变。这就使得Thr-Thr-Thr-DNA体系的体系的紫外吸收有一定的增色效应;但当Na+浓度增加到一定程度时(160 mmol·L-1),由于Na+与DNA的磷酸骨架作用,中和其上所带的正电荷,使得DNA分子因Thr-Thr-Thr的作用而发生的构象改变,有一定程度的恢复。这时,Thr-Thr-Thr-DNA体系的紫外吸收,有一定程度的减弱。
但是从整体上看,Thr-Thr-Thr-DNA体系的紫外吸收在所选的Na+浓度范围内,虽有一定的变化,但是变化不是很显著。这说明,人体正常的Na+浓度范围内,Thr-Thr-Thr-DNA体系的处于相对稳定的状态。
2.1.5 体系PO43-浓度对Thr-Thr-DNA体系紫外光谱的影响(图5)
图5PO43-浓度对Thr-Thr-Thr-DNA体系紫外光谱的影响Fig.5Effect of PO43-on the UV-Vis absorption spectra of Thr-Thr-Thr interaction with DNA
PO43-的加入,会使得Thr-Thr-Thr-DNA体系的紫外吸收发生一定的波动。其中当PO43-的浓度为0.8m mol·L-1时,体系的紫外吸收有一极小值(0.385)。然后,随着PO43-浓度逐渐增加,体系的紫外吸收又缓慢的增加。从图5可以看出,体系紫外吸收的波动是在一个较小的范围内进行的,即在所选PO43-浓度范围内,对Thr-Thr-Thr-DNA体系来说,外在环境的影响是相对较小的。
2.1.6 结合常数的计算设游离态与结合态DNA的总浓度分别为[L]与[L′],DNA的分析浓度为CL(CL=[L]+[L′]),则溶液的吸光度可表示为[7]:
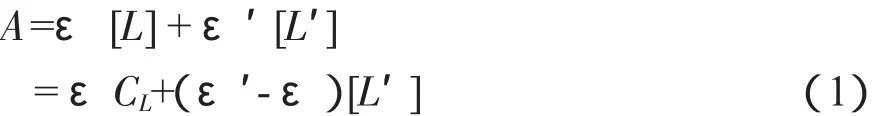
式中ε,ε′:分别表示游离与结合态DNA的平均摩尔吸光系数,εCL:DNA空白溶液的吸光度。令:

则由式(1)可得

△ε在测量条件和溶液酸度一定时为定值。
假定在溶液中反应符合以下关系:

式中CP:氨基酸寡肽的分析浓度;K:表观结合常数。
将式(4)及关系式[L]=CL-[L′]代入上式得:
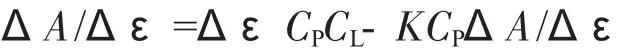
上式两端同时除以KCPCLΔA,移项,得
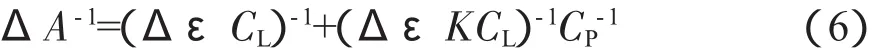
根据上式,若在实验中固定CL,改变CP,则△A-1与CP-1呈线性关系,由回归直线的截距与斜率可得Δε,K。在求得K之后,可根据n=KCL的关系计算最大结合数n。

表1 不同浓度的Thr-Thr-Thr对应的DNA在260nm处吸光值变化Tab.1Values of ΔA at different concentration of Thr-Thr-Thr
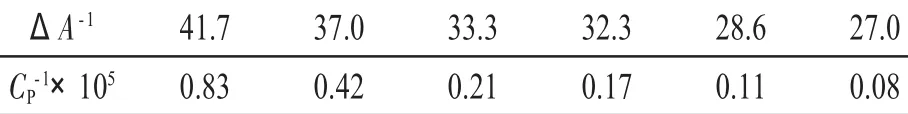
表2 ΔA-1与Cp-1关系表Tab.2Relationships between ΔA-1and C-1p

图6 ΔA-1与Cp-1关系的关系图Fig.6Relationships between ΔA-1and Cp-1
线性回归方程为:y=2.788×10-4x+179.1,R2= 0.8615,相关系数R=0.93。(ΔεCL)-1=179.1,(ΔεKCL)-1=2.788×10-4。根据式(6)可求出结合常数K=6.4×105L·mol-1,最大结合数n=7.04。
2.2 凝胶电泳法
为了检验Thr-Thr-Thr是否严重的破坏了DNA,采用琼脂糖凝胶电泳分析Thr-Thr-Thr与pUC18DNA的相互作用。若电泳后,出现不同迁移率的pUC18DNA,则说明Thr-Thr-Thr严重的破坏了DNA的结构,使得DNA开环或出现缺口[8]。
图7是含不同浓度Thr-Thr-Thr的DNA溶液的电泳图。

图7 含不同浓度Thr-Thr-Thr的DNA溶液的电泳图Fig.7Electrophoretogram of different concentration of Thr-Thr-Thr interacted with DNA
从图7可看出,加入不同浓度Thr-Thr-Thr(1至8泳道,Thr-Thr-Thr浓度不断增加)的DNA的迁移率基本一致。不同浓度的Thr-Thr-Thr并没有使得DNA断裂。这说明了不同浓度Thr-Thr-Thr对DNA的结构可能有破坏作用,但并不使DNA断裂。这与紫外光谱法得到的结论是相符的。
3 结论
本文通过紫外光谱法和凝胶电泳法研究了苏氨酸三肽与DNA的相互作用,考察了苏氨酸三肽浓度、时间、Na+强度和PO34-浓度对二者相互作用的影响,通过实验现象综合分析得到苏氨酸三肽是以沟槽的模式与DNA相互作用的。并计算得到了二者结合常数和最大结合数。
[1]卢继新,李惠芬,蔡乐,等.药物小分子与生物大分子相互作用的研究方法进展[J].分析科学学报,2007,23(5):601-606.
[2]吴会灵,杨反原,张重杰,等.小分子与核酸相互作用的研究进展[J].分析化学评述与进展,2004,32(9):1256-1261.
[3]王层飞,等.生物活性肽的保健功能及其在食品工业中的应用研究[J].食品与机械,2008,24(3):23-26.
[4]李勇.生物活性肽研究现况和进展[J].专家论坛,2007,33(1): 23-26.
[5]卢奎,刘艳,周宁,等.五氯化磷辅助下氨基酸的自组装成肽反应研究[J].化学学报,2002,60(2):372-376.
[6]李青山,刘锐铃,黄计军,等.二氯二乙基锡与DNA作用的研究[J].高等学校化学报,2000,21(4):513-516.
[7]HARSH R H,BARTON J K.Novel dipyridophenazine complexes of ruthenium(II):exploring luminescent reporters of DNA[J].J.Am. Chem.Soc.,1992,114(15):5919-5925.
[8]康敬万,王秀杰,董树清.六氮杂镍配合物与DNA相互作用的研究[J].西北师范大学学报(自然科学版),2006,42(5): 57-62.
Study on interaction of threonine-tripeptide and DNA*
WANG Gang1,MA Ying-jie2,LU Kui2
(1.Wuhan Bioengineering Instituge,Wuhan 430415,China; 2.College of Chemistry and Chemical Engineering,Zhengzhou 450052,China)
The interaction betweenThr-Thr-Thr and DNA was studied by UV-Vis spectrophotometry and gel electrophoresis method in the physiological environment of human’s.The results showed that there was an interaction between Thr-Thr-Thr and DNA.The action model might be groove combination.The Binding Constant(K=6.4×105L·mol-1)and the maximum binding number(n=7.04)were obtained.
UV-Vis spectrophotometry;gel electrophoresis method;threonine-tripeptide;DNA;interaction
book=2010,ebook=267
O657.3
A
1002-1124(2010)11-0007-05
2010-09-06
国家自然科学基金资助项目(NO.20572016,NO.20772023);河南省教育厅科技计划资助项目(NO.2006KYCX017)
王刚(1982-),男,武汉市人,实验师,本科。
