动脉粥样硬化兔模型的建立及评价
2010-09-06何新群岳增辉常小荣商李超
何新群,岳增辉,常小荣,符 凌,张 亮,商李超
(湖南中医药大学,湖南 长沙 410208)
动脉粥样硬化(atherosc1erosis,AS)是指在动脉及其分支的动脉壁内膜及内膜下有脂质沉着,同时伴有中层平滑肌细胞移行至内膜下并增殖,导致内膜增厚,形成黄色或灰黄色状如粥样物质的斑块,最终引起动脉壁增厚、变硬、失去弹性,终致管腔狭窄[1]。该病无论在发达国家还是发展中国家其发病率都呈上升趋势,成为了严重危害人类健康的常见病、多发病之一。基于这一现状,研究AS的发病机制、病理变化,以便早预防、早诊断、早治疗有重要的现实意义,这就势必要寻求一种快速、优化的方法建立AS动物模型。近10年来,在基础实验和临床方面对于动脉粥样硬化的研究均有较大进展,本文所采用的造模方法是在综合其他AS造模方法的基础上,进行改良设计,安全、无创伤,模型能够成功建立,为今后研究动脉粥样硬化提供一定的依据。
1 材料与方法
1.1 材料
1.1.1 动物 新西兰大耳白兔30只,雌雄各半,体质量2.0~2.5 kg,3月龄,由东创实验动物中心提供(合格证号:医动检证字2006-0001),普通饲料由湖南东创实验动物中心提供。
1.1.2 试剂 牛血清蛋白(sigma公司);卵清白蛋白(罗氏公司);胆固醇(sigma公司);蛋黄粉(安徽亳州市众意蛋业有限责任公司);猪油(湖北宜昌双汇食用油有限责任公司);血脂试剂盒(罗氏公司),其余试剂均系进口或国产分析纯。
1.1.3 仪器 TGL16M台式高速冷冻离心机(长沙科威实业有限公司);全自动生化分析仪Roche Hitachi917型(日本日立公司);瑞典产LKB-Ш型超薄切片机;LEICA DM LB2型双目显微镜 (德国LEICA公司)等。
1.2 方法
1.2.1 动物分组 将兔单笼饲养,饲喂正常的普通饲料观察1周后进入实验。随机将30只兔分为2组,每组15只,模型组喂高脂饲料;对照组喂普通饲料,自由饮水,每只兔进食量按30 g/(kg·d)给予,并根据体质量增减不断调整进食量,喂养10周,称体质量1次/周并记录。实验过程中,共死亡10只,其中空白组3只、模型组2只因腹泻致死;模型组2只在注射牛血清蛋白时急性死亡;空白组2只、模型组1只不明原因死亡。
1.2.2 模型制备 采用高脂饲料(15%蛋黄粉、5%猪油[2]、2%胆固醇、0.5%胆酸钠、77.5%普通饲料由湖南中医药大学实验动物中心加工成颗粒饲料)喂养,并于第1天、第3天、第5天从兔耳缘静脉注射牛血清白蛋白125 mg/kg,总共3次,同时用卵清白蛋白进行皮下注射[3],2.5 mg/kg,2 d/次,共5次,喂养 10周。
1.2.3 病理标本收集与处理 喂养10周后,经兔耳缘静脉注入4%乌拉坦4 mL/kg,麻醉后取颈动脉血离心后取血清进行血脂检测,解剖实验动物暴露胸主动脉,截取完整的升主动脉、主动脉弓和胸主动脉剥离干净用于拍照和检测。取下主动脉弓约1.5 cm,用生理盐水稍冲洗后以4%多聚甲醛保存,HE(苏伊红)染色,光镜观察。
1.3 统计学分析
所有数据采用SPSS 16.0统计软件进行分析,计量资料用“”表示,方差分析比较总体差异。
2 结果
2.1 一般情况的观察
部分兔因用笼具喂养时间长发生足癣,定期消毒笼具并用10 g/L克霉唑液进行局部喷洒;腹泻兔用诺氟沙星灌服后,可得以控制。
2.2 造模前后体质量的影响
空白组、模型组两组兔的体质量造模10周后较造模前均增加,但差异无统计学意义(P>0.05)。见表1。
表1 造模前后兔体质量的变化情况

表1 造模前后兔体质量的变化情况
组 别空白组模型组n 10 10造模前2.13±0.12 2.26±0.05造模后2.80±0.24 2.88±0.17
2.3 对兔血脂的影响
饲喂高脂饲料10周的家兔采血离心后肉眼即可见为高脂肪血且有乳糜,空白组血液离心后上清液清亮。检测结果模型组胆固醇明显增高,比空白对照高出10~15倍,甘油三酯升高不明显,高密度脂蛋白有的升高有的下降。空白组与模型组的血脂各项指标差异均有统计学意义(P<0.05)。与空白组比较,模型组的 TC、TG、LDL 含量明显升高(P<0.01),HDL/LDL 值明显降低(P<0.01)。 结果见表2。
表2 造模后两组兔的血脂情况 (n=10,,mmol/L)
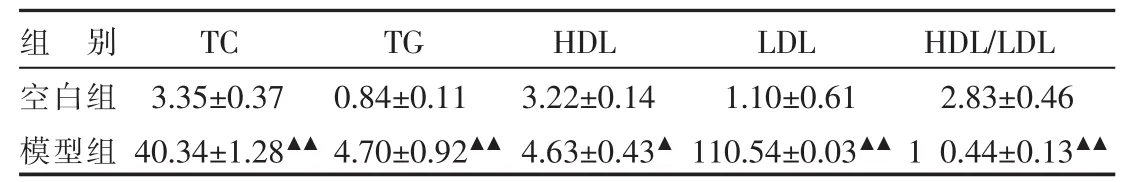
表2 造模后两组兔的血脂情况 (n=10,,mmol/L)
注:与空白组比较▲P<0.05,▲▲P<0.01。
组 别空白组TC 3.35±0.37 40.34±1.28▲▲TG 0.84±0.11 4.70±0.92▲▲HDL 3.22±0.14 4.63±0.43▲LDL 1.10±0.61 110.54±0.03▲▲HDL/LDL 2.83±0.46 1 0.44±0.13▲▲
2.4 对兔病理形态学观察
2.4.1 肉眼观察 两组主动脉内膜对比观察(图1):空白组兔主动脉形态正常,柔软而有弹性,管腔内膜光滑且较薄,未见脂质沉积及斑块形成。模型组家兔动脉弹性差,主动脉内膜有明显大小不等的突起于内膜表面的黄白色脂质条纹及隆起脂质斑块形成,边缘不整齐,部分区域连延成片;解剖可见肝脏为明显的脂肪肝改变。
2.4.2 HE染色光镜观察 图2所示:空白组主动脉内膜完整,内皮细胞紧贴内弹力板,排列有序,内膜无泡沫细胞、淋巴细胞聚集;中层平滑肌细胞排列整齐呈长型或椭圆型,无增生现象,弹力纤维无断裂及溶解现象;胞浆、嗜酸红染,无脂质沉积。图3所示:模型组主动脉内膜显著增厚,有多发性不规则的红色隆起,脂质斑块部位有的表面内皮细胞脱失,内膜下可见大量泡沫细胞和淋巴细胞聚集,呈圆形或长形,脂质核心可见坏死现象,中膜平滑肌增生,弹力纤维断裂、溶解,斑块凸向管腔,呈典型的脆性斑块表现。
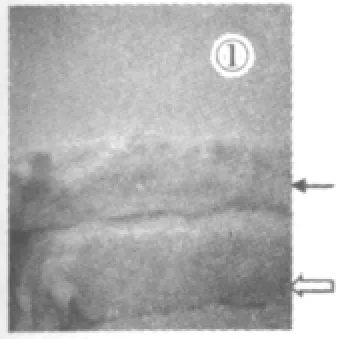
图1 主动脉内膜直观图

图2 空白组主动脉内膜光镜图(×400)

图3 模型组主动脉内膜光镜图(×400)
3 讨论
血脂检测是评价AS病变的一个公认、必不可少的指标。高脂血水平是AS动物模型成功建立的评判依据之一。高脂血症与AS的关系已经得到证实,血浆胆固醇水平与AS的严重程度呈正相关。血浆胆固醇主要以LDL的形式存在,能在血浆内或动脉内膜下经自由基引发的脂质过氧化转变成氧化修饰的LDL(ox-LDL),它在AS发生、发展及斑块形成过程中有至关重要的作用。HDL具有抗炎抗氧化,能促进胆固醇逆转录,有抗AS作用。LDL的升高和HDL的降低是AS形成的重要表现。病理学检测是评价AS造模成功的重要指标。兔是AS最常用的造模动物,因其对喂饲胆固醇非常敏感,吸收率高达75%~90%,且对高血脂清除能力低,在短期内即可诱发明显病变[4]。本文通过高脂饲养与免疫损伤相结合的方法,在较短时期内成功复制出稳定可靠的动脉粥样硬化兔模型。其动脉局部病理特点与人类动脉粥样硬化病理特点已非常相似,如中膜平滑基层变薄、内膜增厚、巨噬细胞的侵入和内弹力层破坏等,能满足实验研究的需要。
由于家兔体质及进食等都存在个体差异性,模型组中各兔AS病变程度有差异。根据肉眼大体观察动脉管壁进行病变硬化分级[5]方法进行评价,模型组中有3只家兔动脉病变评定为1级,2只兔动脉病变评定为4级,其余病变硬化程度评定为3级。这种病变程度的不均衡性势必会影响疗效的评定,上述现象提示我们对于把握动脉粥样硬化形成程度方面存在缺陷,有待进一步的深入探索研究。
试验中我们还发现在模型组高脂饲料喂养过程中,部分兔出现食欲下降,可补充给予少量青草、菜叶以改善食欲,发生腹泻应及早使用抗感染药物对症处理;饲养时间较长易出现足癣现象,应该加强环境卫生,定期对笼具进行清洗、消毒,这样才能避免在实验过程中出现意外死亡。在常用的实验中,草食性动物兔不容易自发产生动脉粥样硬化斑块,但它对高脂饮食特别敏感,有报道称过量的高脂饮食产生的病变类似于似黄瘤病[6]。即动脉内膜的广泛增生并纤维化,而不像人类的动脉粥样硬化斑块,在实验中若高脂饮食的喂养过于集中、没有经过加工等,可导致一些过量的高脂饮食动物的斑块类似黄瘤病,而另一些高脂饮食摄入不足的动物动脉粥样斑块仅仅停留在脂纹期。故在实验中使胆固醇充分与基础饲料混合再加工成颗粒状,并且控制每日的摄入量,也是实验成功的保障。牛血清蛋白诱发免疫反应导致动脉壁的损伤和动脉粥样硬化形成已经有报道[7]。但应注意把握好注射的剂量和速度,防止因剂量过大、注射过快导致的死亡事件。
[1]张美玲,王茁伉.动脉粥样硬化动物模型研究进展[J].四川动物,2009,28(5):794-797.
[2]魏国华,刘 兰.高脂饮食所致动脉粥样硬化家兔肝组织学损伤评估[J].中国动脉硬化杂志,2008,16(5):373-375.
[3]王园园,龙民慧,周磊磊,等.兔动脉粥样硬化模型的建立和评价[J].实验动物学,2008,25(3):18-21.
[4]张均田.现代药理实验方法[M].北京:北京医科大学中国协和医科大学联合出版社,1998:261.
[5]朱 榆,多秀瀛.实验动物的疾病模型[M].天津科技翻译公司,1997:167.
[6]言伟强,土成林,刘远健,等.肝血管瘤的螺旋CT三期扫描分析[J].中国 CT 和 MRI杂志,2004,2(3):34-37.
[7]李仪圭.中药药理实验方法学[M].上海:上海科技出版社,2006:426.
