钙调神经磷酸酶基因多态性与中国北方地区汉族男性心脏功能表型的关联性研究
2010-09-06何子红李燕春包大鹏
何子红,胡 扬,李燕春,包大鹏,刘 刚,席 翼,文 立
钙调神经磷酸酶基因多态性与中国北方地区汉族男性心脏功能表型的关联性研究
何子红1,胡 扬2,李燕春2,包大鹏2,刘 刚2,席 翼3,文 立4
目的:探讨钙调神经磷酸酶的5个编码基因(PPP3CA、PPP3CB、PPP3CC、PPP3R1和PPP3R2)的55个单核苷酸多态性与心脏功能表型的初始值及耐力训练效果的关联性。方法:102名无训练史的青年健康男子完成18周有氧耐力训练,测试训练前后的安静、次最大负荷(50W、100W和150W)下及恢复期的心脏结构及功能指标,采用PCR-RFLP和MALDI-TOF MS对多态性进行分型,所有的统计学分析均进行多重比较的修正。结果:1) rs3763679(PPP3CA)与安静时的心率初始值关联;2)rs1879793、rs1075534、rs7430、rs2461483和rs10108011(PPP3CC)与恢复期的每搏量或/和心输出量的训练敏感性关联; 3)rs1407877(PPP3R2)与次最大负荷(50W)下的射血分数的训练敏感性关联。结论:钙调神经磷酸酶基因多态性可能部分解释心脏功能指标的个体差异性。
心功指标;耐力训练;关联研究
前言
钙调神经磷酸酶(Calcineurin,CaN)是钙依赖信号通道最重要的组成部分,在调控心脏功能过程中有重要作用[4,22,24],尤其在调控心脏肥大方面。比如,CaN缺失的小鼠是可育的,可以正常发展到成年,但是心脏CaN活性降低80%,心脏大小降低12%,并且CaN缺失的小鼠对于外界刺激引起的心肌肥大反应能力严重损害[4]。CaN高表达的转基因大鼠的心脏较非转基因大鼠的心脏明显增大。组织结构分析表明,左心室心室壁剖面和室间隔增厚,右心室和动脉腔也扩大,心肌细胞明显肥大。左心室壁肌细胞横截面积的测量表明,转基因鼠的面积是对照组的2倍[25]。由过氧化物酶体激活受体(peroxisome proliferatoractivated receptorβ,PPARβ)诱导的快速心肌细胞扩张是由CaN介导的,CaN直接作用在PPARβ的启动子增强其表达[23]。在动物模型,PPARβ对心脏功能及心脏重量的短期作用与长期训练引起的作用类似[23]。因此,CaN可能在心肌细胞充当一个内部负荷感受器的作用,匹配心脏生长的需求。
CaN是由催化亚基(calmodulin-binding catalytic A subunit,CnA)和调节亚基(calcium-binding regulatory B subunit, CnB)组成的异型二聚体,几乎在所有的组织均有分布。CnA有三种异构体,CnAα、CnAβ和CnAγ,分别由PPP3CA,PPP3CB和PPP3CC基因编码。CnB有CnB1和CnB2 2种异构体,分别由PPP3R1和PPP3R2基因编码。PPP3R1的I/D多态性被报道与高血压病人[20]和运动员[1]的心脏肥大关联。但目前还没有关于CaN基因型与心脏功能指标对于耐力训练适应方面的研究。因此,本研究拟探讨PPP3CA、PPP3CB、PPP3CC、PPP3R1和PPP3R2基因的55个单核苷酸多态性(single nucleotide polymorphism,SNP)与心脏结构及功能指标的训练前的初始值及18周(w)耐力训练的效果的关系。
1 研究对象与方法
1.1 研究对象
102名中国武装警察某部的新兵,籍贯为山东和安徽等北方平原地区,全部为健康男性,汉族。所有士兵入伍前均无训练史,也无由于生活环境而导致的长期耐力性活动,排除由此给训练初始水平造成的差异,平均年龄19± 1岁,身高171.7±5.8 cm,体重60.27±6.54 kg,所有研究对象均知情同意。
1.2 研究方法
1.2.1 有氧训练计划
5 000 m有氧匀速跑,每周3次,共18周。强度通过个体无氧阈强度(VT)对应的心率(Hr)控制,由polar表(芬兰)监控(VTHr±3)。前10周为95%个体VTHr,后8周为105%个体VTHr。正式训练前进行2周适应性训练。实验期间,受试者作息时间、饮食条件、训练安排均保持一致。本训练之外不再进行耐力训练,只进行一般的力量和军事训练,训练地点在部队驻地。
1.2.2 心脏功能结构及功能指标的测定
运动方式为卧式蹬车的极限下递增定量负荷运动。受试者身着单衣单裤,静卧10 min,然后开始蹬车。取其平卧位,首先测定安静时左心室结构指标,然后以起始负荷50 W和60 r/min的频率开始蹬车,每3 min增加负荷50 W,直至150 W蹬满3 min后停止,总负荷时间9 min。平卧恢复3 min。测定50 W、100 W、150 W负荷的最后30 s和恢复的最后30 s的左心室结构指标。测试地点在有氧训练驻地,每名受试者两次测试中的时相(上午、下午、晚上)保持一致,全部测试由同一名实验师完成。
采集的指标有:左室舒张末内径(LVDD)、左室收缩末内径(LVSD)、左室舒张末后壁厚度(PWD)、左室收缩末后壁厚度(PWS)、室间隔舒张末厚度(IVSD)、室间隔收缩末厚度(IVSS),超声心动仪为Aloka SSD-118型(日本)。
衍生的指标有:1)体表面积bsa=0.006×身高(cm)+ 0.0128×体重(kg)-0.1529;2)每博输出量指数SVI(ml/ m2)=(LVDD3-LVSD3)/bsa;3)心输出量指数COI(l/m2) =(SV×HR)/bsa;4)射血分数EF=(LVDD3-LVSD3)/ LVDD3×100%;5)左室重量指数LVMI(g/m2)=1.04× [(LVDD+PWD+IVSD)3-LVDD3]-14[5]。
获取的所有数据包括:1)结构指标:训练前后的LVDD、LVSD、PWS、PWD、IVSD、IVSS;2)每搏量指标:训练前后的SVI、50 W/SVI、100 W/SVI、150 W/SVI、Re/ SVI;3)心输出量指标:训练前后的COI、50 W/COI、100 W/COI、150 W/COI、Re/COI;4)射血分数指标:训练前后的EF、50 W/EF、100 W/EF、150 W/EF、Re/EF;5)心率指标:训练前后的HR、50 W/HR、100 W/HR、150 W/HR、Re/HR[7]。
1.2.3 基因多态性分析
1.2.3.1 单核苷酸多态性的选择
PPP3CA全长约323.8 kbp,PPP3CB全长约59.14 kbp,PPP3CC全长约100 kbp,PPP3R1全长约73.66 kbp, PPP3R2全长约3.385 kbp。上下游各扩展2kb后,从hapmap网站(www.hapmap.org)下载上述5个基因(中国北京汉族人)的SNPs,应用haploview软件中的Tagger程序,根据pair-wise方法,最小r2=0.8,Maf≥0.1可选择出55个标签SNPs(tagSNPs):34个位于PPP3CA,3个位于PPP3CB,12个位于PPP3CC,3个位于PPP3R1和3个位于PPP3R2[8]。
1.2.3.2 单核苷酸多态性的分型
Promaga公司试剂盒提取全血DNA。rs12644采用PCR-RFLP分析。其他位点采用基质辅助激光解吸电离飞行时间质谱技术(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)分析[27,28]。MALDI-TOF MS是国际通用的基因单核苷酸多态性(SNP)的研究平台,也是国际HapMap计划指定实施平台之一(http://www.hapmap.org/downloads/assay-design_protocols.html)。
PCR引物和单碱基延伸引物都是用Assay Designer (Sequenom)软件包设计。所有需要分型的DNA样本都稀释到5 ng/μl,取1μl DNA样本,将其与0.95μl水、0.625 μl PCR缓冲液(含15 mM MgCl2)、1μl的2.5 mM dNTP、0.325μl的25 mM MgCl2、1μl PCR引物以及0.1μl Hot-Star Taq酶(Qiagen)混合在一起。PCR反应条件:94℃15min;94℃20 s,56℃30 s,72℃1 min,共45个循环;最终72℃3 min。PCR扩增后,剩余的dNTP将被去磷酸消化掉,反应体系包括1.53μl水、0.17μl SAP缓冲液、0.3单位碱性磷酸酶(Sequenom)。该反应在37℃进行40 min,然后85℃5 min使酶失活。碱性磷酸酶处理后,针对SNP的单碱基延伸引物在下列反应体系中进行:0.755μl水、0.2 μl 10X iPLEX缓冲液、0.2μl终止混合物、0.041μl iPLEX酶(Sequenom)和0.804μl 10μM的延伸引物。单碱基延伸反应在下列条件下进行:94℃30 s;94℃5 s,52℃5 s, 80℃5 s5个循环,共40个循环;最后72℃3 min。在终止反应物中加入6 mg阳离子交换树脂(Sequenom)脱盐,混合后加入25μl水悬浮。使用MassARRAY Nanodispenser (Sequenom)将最终的分型产物点样到一块384孔的spectroCHIP(Sequenom)上,并用基质辅助激光解吸电离飞行时间质谱进行分析。最终结果由MassARRAY RT软件系统(版本号3.0.0.4)实时读取,并由MassARRAY Typer软件系统(版本号3.4)完成基因分型分析。
1.3 统计学分析
采用χ2检验进行H-W平衡检验。对于多态性与初始值的关联关系采用单因素方差分析,对于与训练敏感性的关联关系采用重复测量的双因素方差分析(基因型×训练)。多重比较采用修正的P值[6,9],所有统计均在SPSS 13.0上完成。
2 研究结果
18周耐力训练引起心脏结构和功能指标以及最大摄氧量等指标的显著性变化(表1)[7]。基因型分型成功率为96.41%。rs12639641(χ22=5.26,P=0.02),rs2850983 (χ22=4.62,P=0.03)和rs13271367(χ22=13.9,P< 0.001)基因型分布不符合H-W平衡,不进行统计学分析。

表1 本研究对象训练前、后心脏结构及功能指标及有氧能力的变化一览表Table 1 Pre-training and Post-training Comparison of Cardiac and Aerobic V ariables in the Total G roup of Subjects
统计学分析进行多重比较的修正后表明:1) rs3763679(PPP3CA)与安静时的心率初始值显著关联(显著的基因型作用,表1);2)rs1879793、rs1075534、rs7430、rs2461483和rs10108011(PPP3CC)和恢复期的每搏量或/和心输出量的训练敏感性关联(显著的基因型×训练交互作用,表2);3)rs1407877(PPP3R2)与50W/EF的训练敏感性关联(显著的基因型×训练交互作用,表3)。因为数据量具大,为了简单的目的,表2和表3仅列出了P<0.05的位点,之所以将所有P<0.05的位点都列出来是希望给对该基因感兴趣的其他研究者更多的启示。
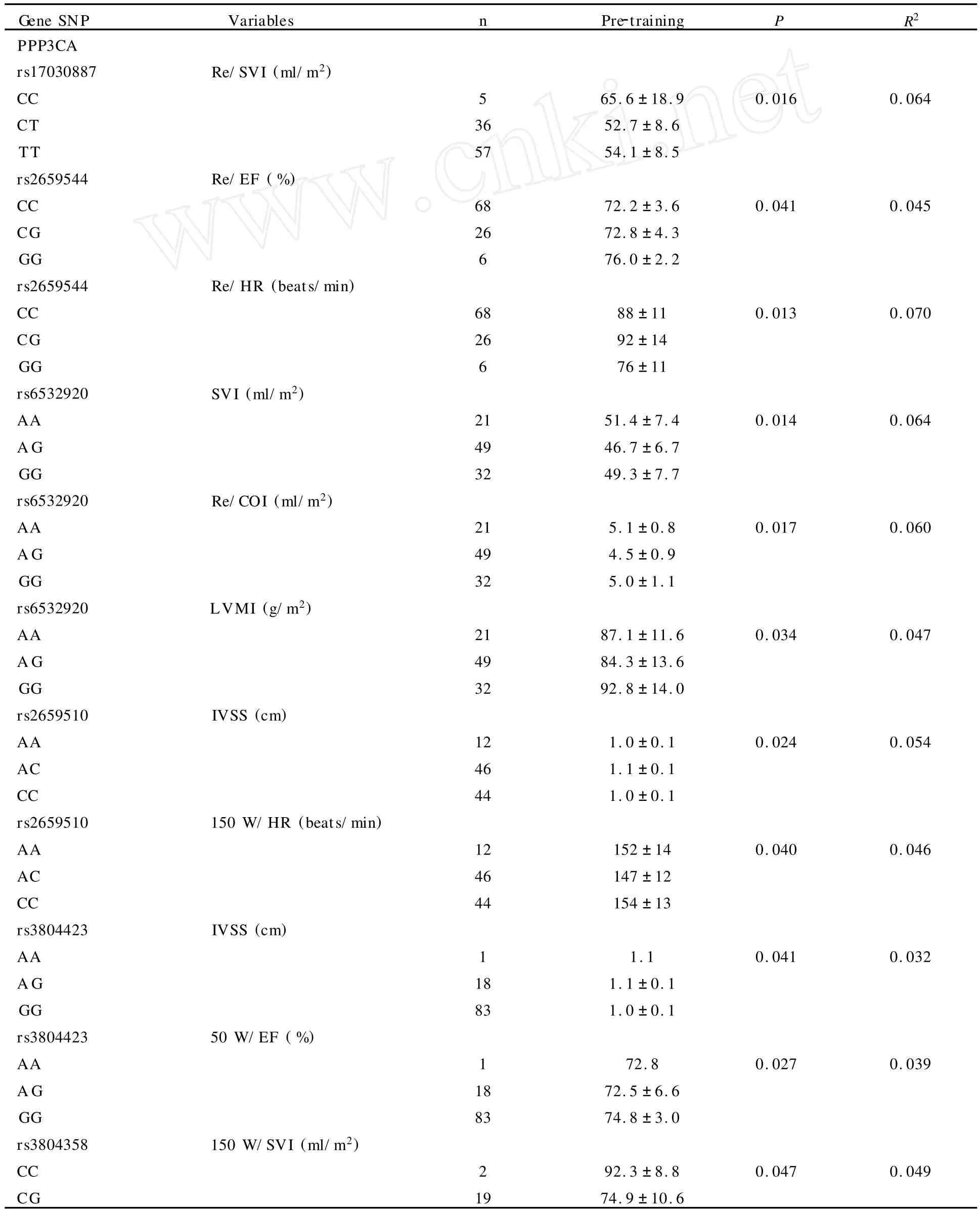
表2 本研究与训练前心脏功能指标初始值阳性关联的多态性位点一览表Table 2 The Association SNPs with Baseline(pre-training)Variables

续表2
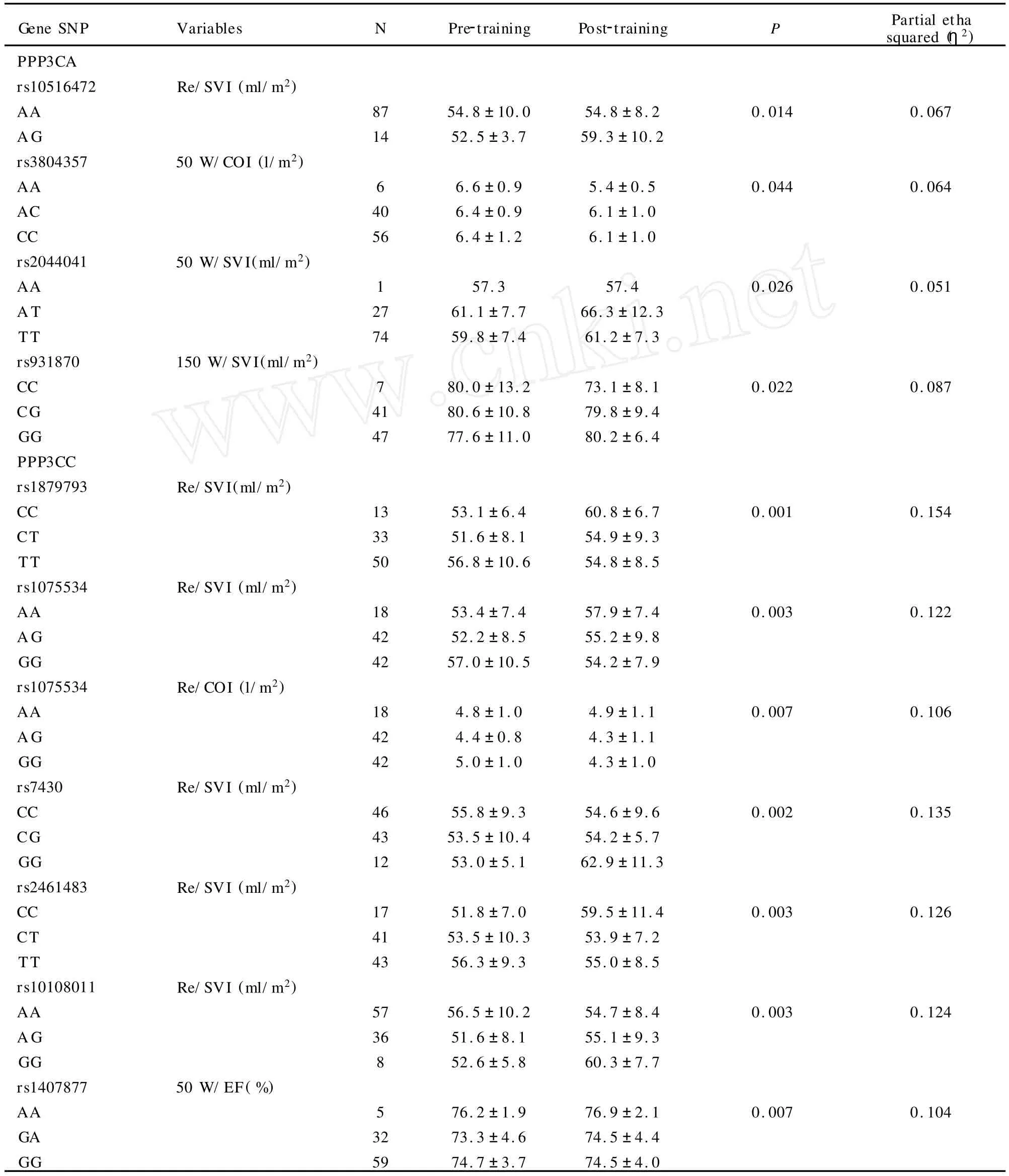
表3 本研究与心脏功能指标训练敏感性阳性关联的多态性位点一览表Table 3 The Association SNPs with Training Response V ariables
3 讨论
本研究主要的新结果是观察到CaN编码基因的多态性与心脏功能指标的初始值及在次最大负荷运动下及恢复的训练敏感性关联。
PPP3CB基因的rs3763679多态性与训练前的安静状态下的心率关联。安静心率是心血管疾病和各种原因死亡的一个危险因素[11]。另一方面,我们发现PPP3CC基因的多态性与Re/COI和/或Re/SVI的训练敏感性关联, PPP3R2与次最大负荷下(50W)的EF的训练敏感性关联。CO、SV和EF是体现心脏功能的重要指标,也是其他重要运动相关表型,比如最大及次最大耗氧量和血压的中间表型[2]。证实对耐力训练反应的“心脏有利基因型(cardiac favourable genotypes)”,即通过训练可以使心脏功能获得最大收益的基因型,对临床应用也有重要的潜在意义[15,19]。在这同一研究对象中,我们报道过血红素氧化酶I(heme oxygenase-1,HMOX-1)基因与心脏功能的初始值关联,但与训练敏感性不关联[7]。相反的,本研究CaN主要是影响心脏功能相关指标的训练敏感性。另一方面,本研究发现,CaN多态性主要与心脏功能指标恢复期的训练敏感性关联,这并不降低我们研究结果的意义。心脏和血液动力学变量运动后的反应对预测心血管疾病和死亡率有重要价值[26]。
PPP3CC和PPP3R2基因主要在睾丸和大脑表达[13,14]。对于PPP3CC主要在睾丸表达,但影响心脏功能可假定为它影响睾酮水平。实际上,男子的睾酮水平与心脏功能表型及心脏疾病相关[3]。反过来讲,PPP3CC可能能够调控男子血睾酮水平(用过钙调神经磷酸酶抑制剂后,循环的睾酮水平降低)[21]。CaN介导的信号转导途径是Ca2+诱导的三条主要信号通道中最重要的一条,激活的CaN直接对核因子的活化T细胞(nuclear factor of activated T cells,NFAT)去磷酸化,并且转移到核内,诱导相关肥大基因的表达[18,22,24]。它不仅本身可介导多条信号转导通路,还与其他途径交互作用[24]。有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号途径[25],PKC isoforms,c-Jun N-terminal kinase(JNK)和Akt[13]增强CaNNFAT信号转导,这些信号通路协同调节细胞的功能[24]。除了rs1407877,其他的多态性均位于内含子区域,其功能意义未知。位于内含子非编码区的SNPs可以调控mRNA的拼接,从而影响基因表达[12]和表型[16,17]。非编码区的SNPs也可能影响转录因子的结合[10]。下一步的研究应该综合性地对这些基因多态性进行功能分析以探清具体的关联机制。
此外,我们研究有一定的不足,缺少血压的测量数据以及18周训练引起的心脏结构及功能指标变化较小,后者降低了对心肌表型的训练反应的潜在基因型影响的程度。另外,如果有一个对照组能加强我们的研究结果,将来的研究要克服以上的不足。volume and cardiac outputduring submaximal exercise:the HERITAGE family study[J].Int J Sport Med,2000,(21):566-572.
4 结论
PPP3CC基 因 的rs1879793、rs1075534、rs7430、rs2461483、rs10108011和PPP3R2基因的rs1407877与心脏功能表型的训练敏感性关联,PPP3CB基因的rs3763679与安静的心率初始值关联。CaN编码基因多态性能够部分解释心脏功能表型的个体差异。
[1]AKHMETOV I I,LINDE E V,SHIKHOVA IU V,et al.The influence of calcineurin gene polymorphism on morphofunctional characteristics of cardiovascular system of athletes[J].Ross Fiziol Zh Im I M Sechenova,2008,(94):915-922.
[2]AN P,RICE T,GAGNON J,et al.Familial aggregation of stroke
[3]BASSIL N,AL KAADE S,MORLEYJ E.The benefits and risks of testosterone replacement therapy:a review[J].Ther Clin Risk Manag,2009,(5):427-448.
[4]BUENO O F,WIL KINS B J,TYMITZ K M,et al.Impaired cardiac hypertrophic response in Calcineurin Abeta-deficient mice [C].Proceedings of the National Academy of Sciences of the U-nited States of America,2002,99:4586-4591.
[5]DEVEREUX R B,REICHEK N.Echocardiographic determination of left ventricular mass in man.Anatomic validation of the method[J].Circulation,1977,(55):613-618.
[6]GORDI T,KHAMIS H.Simple solution to a common statistical problem:interpreting multiple tests[J].Clinical Therapeutics, 2004,(26):780-786.
[7]HE Z,HU Y,FENG L,et al.Association between HMOX-1 genotype and cardiac function during exercise[J].Appl Physiol, Nutrition,Metabol,2008,(33):450-460.
[8]HE Z H,HU Y,WANG H Y,et al.Are calcineurin genes associated with endurance phenotype traits[J].Eur J Appl Physiol, 2010,109(3):359-369.
[9]JP S.Multiple hypothesis testing[J].Ann Rev Psych,1995, (46):561-584.
[10]KNIGHT J C.Regulatory polymorphisms underlying complex disease traits[J].J Mol Med,2005,(83):97-109.
[11]KRISTAL-BONEH E,SILBER H,HARARI G,et al.The association of resting heart rate with cardiovascular,cancer and all-cause mortality.Eight year follow-up of 3527 male Israeli employees(the CORDIS Study)[J].Eur Heart J,2000,(21): 116-124.
[12]MERCADO P A,AYALA Y M,ROMANO M,et al.Depletion of TDP 43 overrides the need for exonic and intronic splicing enhancers in the human apoA-II gene[J].Nucleic Acids Res, 2005,(33):6000-6010.
[13]OKA T,DAI Y S,MOL KENTIN J D.Regulation of calcineurin through transcriptional induction of the calcineurin A beta promoter in vitro and in vivo[J].Molecular Cellular Biol,2005, (25):6649-6659.
[14]PARSONS S A,WIL KINS B J,BUENO O F,et al.Altered skeletal muscle phenotypes in calcineurin Aalpha and Abeta gene-targeted mice[J].Molecular Cellular Biol,2003,(23): 4331-4343.
[15]POWERS S K,LENNON S L,QUINDRYJ,et al.Exercise and cardioprotection[J].Curr Opin Cardiol,2002,(17):495-502.
[16]SASABE T,FURU KAWA A,MATSUSITA S,et al.Association analysis of the dopamine receptor D2(DRD2)SNP rs1076560 in alcoholic patients[J].Neurosci Lett,2007,(412): 139-142.
[17]SAXENA R,VOIGHT B F,L YSSENKO V,et al.Genomewide association analysis identifies loci for type 2 diabetes and triglyceride levels[J].Sci,2007,(316):1331-1336.
[18]SCHULZ R A,YUTZEY K E.Calcineurin signaling and NFAT activation in cardiovascular and skeletal muscle development [J].Develop Biol,2004,(266):1-16.
[19]STROM C C,APLIN M,PLOUG T,et al.Expression profiling reveals differences in metabolic gene expression between exercise-induced cardiac effects and maladaptive cardiac hypertrophy[J].Febs J,2005,272:2684-2695.
[20]TANG W,ARNETT D K,DEVEREUX R B,et al.Identification of a novel 5-base pair deletion in calcineurin B(PPP3R1) promoter region and its association with left ventricular hypertrophy[J].Am Heart J,2005,150:845-851.
[21]TAUCHMANOVA L,CARRANO R,SABBATINI M,et al. Hypothalamic-pituitary-gonadal axis function after successful kidney transplantation in men and women[J].Hum Reprod, 2004,(19):867-873.
[22]VEGA R B,BASSEL-DUBY R,OLSON E N.Control of cardiac growth and function by calcineurin signaling[J].J Biologi Chemi,2003,(278):36981-36984.
[23]WAGNER N,J EHL-PIETRI C,LOPEZ P,et al.Peroxisome proliferator-activated receptor beta stimulation induces rapid cardiac growth and angiogenesis via direct activation of calcineurin[J].Cardiovascular Res,2009,(83):61-71.
[24]WIL KINS B J,MOL KENTIN J D.Calcineurin and cardiac hypertrophy:where have we been?Where are we going[J].J Physiol,2002,541:1-8.
[25]WIL KINS B J,MOL KENTIN J D.Calcium-calcineurin signaling in the regulation of cardiac hypertrophy[J].Biochem Biophy Res Communica,2004,(322):1178-1191.
[26]YOSEFY C,JAFARI J,KLAINMAN E,et al.The prognostic value of post-exercise blood pressure reduction in patients with hypertensive response during exercise stress test[J].Int J Cardiol,2006,(111):352-357.
Polymorphisms in the Calcineurin Genes Associated with the Training Responsiveness of Cardiac Phenotypes of Male Adult of H an Nationality in North Region of China
HE Zi-hong1,HU Yang2,LI Yan-chun2,BAO Da-peng2,LIU Gang2,XI Yi3,WEN Li4
This paper studied the association of 55 polymorphisms in the PPP3CA,PPP3CB, PPP3CC,PPP3R1 and PPP3R2 genes with both(i)the pre-training levels and(ii)responsiveness to endurance training(18 weeks),of echocardiography variables.The latter were measured both before and after the training program at each of the following time points:before(rest),during,and after cycle-ergometry exercise.All multiple comparisons were corrected for mass significance.For genotype:phenotype associations at pre-training,we only found a significant association between the rs3763679 polymorphism(PPP3CB)and resting heart rate.As for genotype associations with trainability of cardiac phenotypes,we found the following significant associations(i.e.significantgenotype*training interaction effect):(i) rs1879793,rs1075534,rs7430,rs2461483,and rs10108011(PPP3CC)and cardiac output/ stroke volume after exercise;and(ii)rs1407877(PPP3R2)and ejection fraction at 50 watts. The findings suggest that polymorphisms in the calcineurin genes might be among the numerous potential genetic variant candidates that can help explain human variations in the pre-training levels or trainability of cardiac phenotype traits.
echocardiography;endurance exercise;association study
G804.7 文献标识码:A
1000-677X(2010)09-0066-07
2010-07-05;
2010-08-06
国家科技部课题(2003BA904B04);中央级公益性科研院所基本科研业务费资助(06-15)。
何子红(1977-),女,山东五莲人,副研究员,博士,研究方向为运动能力的分子遗传学及优秀运动员的训练监控, Tel:(01)87182524,E-mail:zihong_he@hotmail.com。
1.国家体育总局体育科学研究所,北京100061;2.北京体育大学科研中心,北京100084;3.深圳大学体育系,广东深圳518060;4.天津体育学院运动人体科学系,天津300381 1.China Institute of Sport Science,Beijing 100061,China;2.Beijing Sport University,Beijing 100083,China; 3.ShenzhenUniverseity,Shenzhen518060,China; 4.Tianjin University of Sport,Tianjin 300381,China.
