微小亚历山大藻对黑鲷仔鱼的抗氧化酶和ATPase的胁迫影响
2010-09-05蒋玫黄世林伦凤霞夏培艳
蒋玫,黄世林,伦凤霞,夏培艳
(1. 中国水产科学研究院东海水产研究所,上海 200090;2. 国家海洋局第二海洋研究所,浙江 杭州 310012;3. 上海市水文总站 上海 20023;4. 上海海洋大学,上海 200336)
微小亚历山大藻对黑鲷仔鱼的抗氧化酶和ATPase的胁迫影响
蒋玫1,黄世林2,伦凤霞3,夏培艳4
(1. 中国水产科学研究院东海水产研究所,上海 200090;2. 国家海洋局第二海洋研究所,浙江 杭州 310012;3. 上海市水文总站 上海 20023;4. 上海海洋大学,上海 200336)
研究了暴露于微小亚历山大藻藻液中的黑鲷仔鱼其超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化物酶(CAT)和Na+-K+-ATPase酶活性在4 d时间内的变化,结果表明,微小亚历山大藻藻液对仔鱼的GSH-PX和CAT活性诱导作用明显,尤其对处于染毒时间2 d内,这种作用较强,但随着实验时间的延长又表现出抑制作用。微小亚历山大藻藻液对SOD也有强烈的诱导作用,这种作用可持续3 d,但随后则表现为抑制作用。仔鱼的3种酶活性与染毒的藻液均符合较明显的剂量-效应关系,即实验藻液浓度越大,对酶活性的抑制率越低,对生物毒性越大。但藻液对于Na+-K+-ATPase酶却表现出强烈的抑制作用,显示出浓度-效应关系。其与上述3种酶的活力变化可以一起作为水体中藻液污染的生物指示器。
微小亚历山大藻,仔鱼,抗氧化酶,ATPase
藻毒素不仅能直接导致渔业生物的大量死亡[1],甚至还可通过影响鱼类的幼体或生活史的其它阶段改变海洋营养结构[2]。微小亚历山大藻能产生一种称为麻痹性贝毒 (PSP) 的藻毒素。大量的研究表明,藻毒素具有极高的细胞选择性,在生物机体内所引发的许多细胞学变化,主要缘于生物体酶系统的破坏,从而引发一系列的中毒特征。例如低细胞密度藻对菲律宾蛤仔、翡翠贻贝的鳃组织的Na+-K+-ATPase酶活性的有激活作用,而高密度藻则能抑制蛋白磷酸酶的活性,导致蛋白质磷酸化和去磷酸化调节失衡,最终对生物的多种生理功能造成影响[3]。此外,麻痹性毒素还能通过赖胆酸转运系统进入细胞,引起乳酸脱氢酶 (LDH) 释放率和细胞内活性氧基 (ROS) 的升高,产生脂质过氧化引起的氧化损伤的毒性现象,使得水生生物的肝脏表现出充血红肿和血斑的中毒症状[4]。
不少学者认为,鱼类对外源物的生物转化中,可生成危害性大的活性氧中间代谢物,并产生大量的活性氧自由基,这些活性氧会对机体造成氧化胁迫, 引起酶失活[5,6]。GSH-PX是鱼体内广泛存在的一种重要的催化过氧化物分解的酶类。SOD、CAT则是鱼类体内参与免疫防御的重的抗氧化酶。这些酶的活性水平与细胞免疫防御能力密切相关。而Na+-K+-ATPase酶作为生物体内重要的代谢酶,在能量代谢、物质转运、氧化磷酸化等生化过程中起着重要作用,常作为污染物评价的重要指标[7]。
本研究以黑鲷仔鱼为实验对象,通过检测被微小亚历山大藻藻液染毒后仔鱼体内SOD酶、GSH酶、Na+-K+-ATPase酶和CAT酶的活性变化,分析微小亚历山大藻对仔鱼抗氧化系统的影响,了解其抗氧化能力及免疫防御水平。以期为评价微小亚历山大藻对早期鱼类生物的生态毒理负面效应提供进一步的实验依据。
1 实验材料与方法
1.1 材料
实验黑鲷来自江苏省水产研究所养殖场的亲鱼直接产的鱼卵经孵化四天后的初孵仔鱼。实验用水来源于养殖场经过滤的自然海水,主要盐度为22。
微小亚历山大藻藻种(AM-1藻株)由台湾大学周宏农教授实验室提供,在实验室以2 L三角烧瓶f/2培养液单种培养,温度20±1℃,光照3 000 lx,光暗比12 h∶12 h。选用指数生长期中期的藻液用于实验。控制实验温度为20.2 ℃左右,温度变幅不超过2.0 ℃,pH为7~8,并保持实验用水溶解氧为饱和溶氧的60% 以上。
1.2 方法
1.2.1 仔鱼的藻液染毒实验
将藻细胞原液作为母液与过滤海水按一定比例混合稀释成(约50 000 cell/mL、30 000 cell/mL、15 000 cell/mL、10 000 cell/mL)4个浓度组,同时以过滤海水为对照组,每一个浓度组设3个平行样本,在每个3 000 mL的白搪瓷盆中投入已经开口的仔鱼(卵黄囊已经消失,平均体长约为2.34 mm,体重为0.004 9 g,口唇张开度为0.3 mm)。每个平行样投放仔鱼约300尾左右,充氧气,每天换水一次(20%),进行投饵(轮虫)一次,观测4 d内的生长情况,记录仔鱼生长游动情况、外观畸形以及死亡数量。每24 h随机抽取50尾左右保存于液氮容器中,带回实验室进行抗氧化系统指标的测定和分析。
1.2.2 抗氧化系统指标测定
分别向仔鱼整体加适量4 ℃冰冷双蒸水,高速组织匀浆机( Polytron, PT2MR 2100) 匀浆, 离心10 min (2 ℃、3 300 r/min) , 取上清液用于酶活力测定。SOD、GSH-PX、CAT以及Na+-K+-ATPase活性测定均采用南京建成生物工程研究所的专用试剂盒进行。SOD活性定义:每毫升组织蛋白在1 mL反应液中SOD抑制率达50时所对应的SOD量为1个SOD活力单位 (U)。GSH-PX活性定义:每0.1 mL组织蛋白在37℃反应5分钟,扣除非酶促反应作用,是反应体系中GSH浓度降低1 μmol/L为一个活力单位。CAT活性定义:每mg组织蛋白中CAT每秒钟分解吸光度为0.5~0.55的底物中的CAT相对量为1个CAT的活力单位。Na+-K+-ATPase活性定义:每小时毫克蛋白分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位。
1.3 数据处理
利用SPSS生物统计分析软件,进行单因素方差分析,检验各取样组间数据的差异显著性,当P < 0. 05时为差异显著。
2 实验结果
2.1 对仔鱼的SOD的活性影响
分别对暴露在不同浓度下的藻细胞原液进行4 d的仔鱼染毒分析,研究不同暴露时间和不同浓度染毒下SOD酶活力的影响。由图1可以看出,随着暴露时间的延长,SOD的活性开始处于增加态势 (P<0.05),到3 d后其活力最强,呈现出明显的时间-效应关系,但时间超过3 d后其活性又开始出现下降趋势。与对照组相比,差异性均较显著(P<0.01)。此外,我们也看出,在试验时间进行2 d内,浓度越小其对SOD的诱导性越强,符合剂量—效应关系,但到试验进行到4 d后,开始表现出抑制作用,浓度越大其抑制作用越明显,各浓度组与对照组相比其差异性较显著 (P<0.05)。
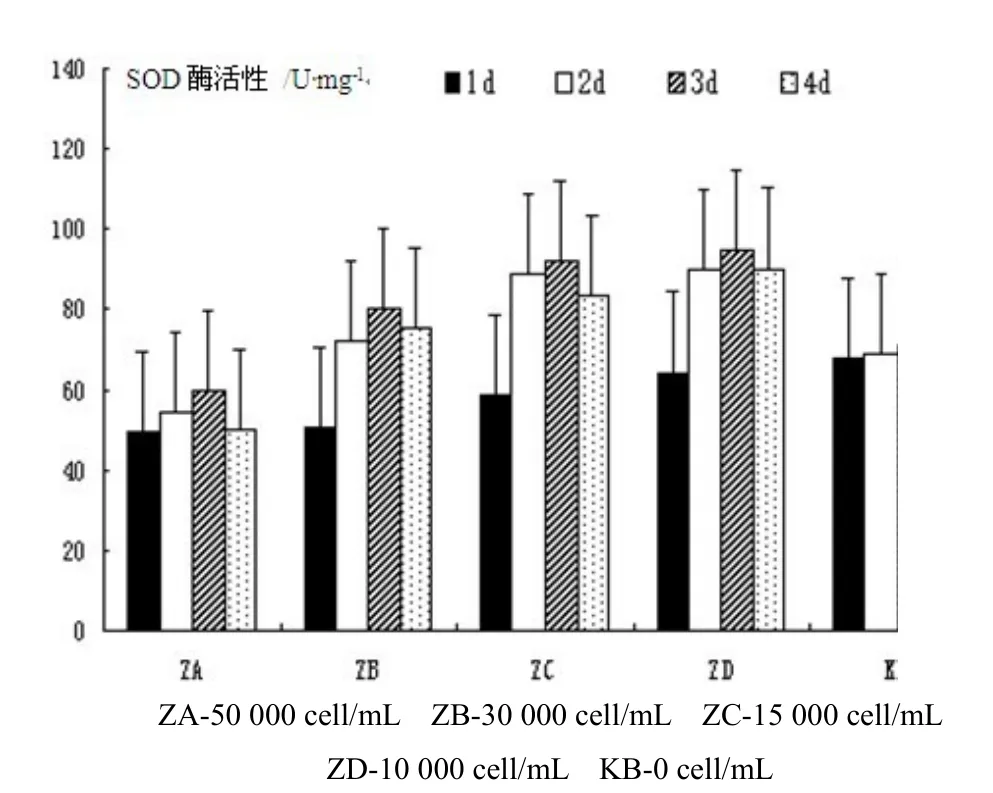
图1 微小亚历山大藻对黑鲷仔鱼的SOD 酶活力的影响Fig. 1 Effects of Alexandrium minitum on the SOD activity in larvae of Sparus macrocephalus
2.2 对仔鱼的GSH-PX的活性影响
经不同浓度的微小亚历山大 藻细胞原液处理后,仔鱼的GSH-PX活性在整个实验期间发生一定的变化(见图2)。由图可以看出,从开始的2 d内,藻液对仔鱼的GSH-PX酶产生诱导作用,使得酶活性呈现逐步增加的趋势,活随后到3 d以后又逐渐呈现下降趋势,表现一定的抑制性。这种变化与对照组相比有一定差异,但不十分显著(P>0.05)。从各浓度组来看,剂量-反应关系较明显,浓度越大,受影响作用越明显。
2.3 对仔鱼的CAT的活性影响
黑鲷仔鱼在藻细胞原液暴露1 d至2 d后,其CAT酶活性则呈现较明显地增加,但这种诱导作用持续时间短暂,到试验进行到3 d后,CAT酶活性则开始逐渐下降(图3)。据图3可见,黑鲷仔鱼经不同浓度的微小亚历山大藻藻细胞原液染毒后,其CAT酶活性呈现出一定的剂量-效应关系。对于越高的浓度,仔鱼的CAT活性受到抑制作用就越强,但这种抑制作用相对于对照组较显著(P<0.05)。

图2 微小亚历山大藻对黑鲷仔鱼的GSH-PX 酶活力的影响Fig. 2 Effects of Alexandrium minitum on the GSH-PX activity in larvae of Sparus macrocephalus

图3 微小亚历山大藻对黑鲷仔鱼的CAT 酶活力的影响Fig. 3 Effects of Alexandrium minitum on the CAT activity in larvae of Sparus macrocephalus
2.4 对仔鱼的Na+-K+-ATPase的活性影响
微小亚历山大藻对黑鲷仔鱼的Na+-K+-ATPase的活性影响结果见表1。相同时间内,随着藻液浓度的增加,仔鱼的Na+-K+-ATPase的活性呈下降趋势,表现为受到抑制作用。与对照组相比差异性较显著,尤其是浓度为50 000 cell/mL时,达到极显著水平( P <0.01)。在同组浓度下,仔鱼的Na+-K+-ATPase的活性从试验开始第一天到第四天均出现不同程度的减少, 表现出时间-效应关系。但对照组(0 cell/mL)的仔鱼其Na+-K+-ATPase的活性则在实验开始的3 d内,呈现逐步增加的趋势,与实验浓度组呈现明显的差异性(P<0.01)。

表1 各浓度组Na+-K+-ATPase酶的活性水平(单位:µmolPi/mgprot/hour)Tab. 1 Effects of Alexandrium minitum with various concentrations on the activities of ATPase in the larvae of Sparus macrocephalus(µmolPi/mgprot/hour)
3 讨论与结论
鱼类生物在遭受污染物的胁迫作用时,为了免受自由基伤害,其体内存在的抗氧化防御系统的抗氧化酶的发生活性或含量均会发生变化,这些抗氧化酶主要由SOD酶、GSH-PX酶和CAT酶等[8]。这些酶发生一系列的催化-歧化反应,使得过氧化物还原为氧化物或消除细胞内的氧自由基。当高浓度藻液长时间作用于黑鲷仔鱼后,产生了大量的活性氧中间体,超过了机体清除活性氧的能力。其结果是大量活性氧中间体作用于酶蛋白分子的关键性氨基酸残基, 使酶活性受到抑制,使CAT上的2SH巯基氧化成SOS, 从而改变CAT酶的结构, 抑制其活性[9]。因而染毒试验中,所用的藻液浓度,随着剂量的增加,黑鲷仔鱼体内抗氧化酶系统的酶活性受到的抑制作用就越强。
本实验表明,在低浓度的微小亚历山大藻细胞原液(约10 000 cell/mL)胁迫下,黑鲷仔鱼体内的SOD酶、GSH-PX酶和CAT酶的活性均呈现先增加后减少的现象,SOD酶的活性峰值出现在染毒后的第3 d,GSH-PX酶和CAT酶的活性则在染毒后的第2 d达到峰值。一些学者在研究水环境污染物的过程中发现,当生物体受到轻度胁迫时,在短期内机体组织的SOD、CAT及GSH-PX等酶的活力往往会升高[10],本实验同样出现了类似的现象。这3种酶所表现出的受短暂时间的诱导作用可能是黑鲷仔鱼对微小亚历山大藻液胁迫的适应阶段,通过适应性调节机体的相关生理机能活动,从而增强机体抗氧化防御系统清除活性氧自由基的能力。然而一旦藻液的胁迫程度超过黑鲷仔鱼生理机能的适应能力时,就会对仔鱼抗氧化系统的功能造成伤害,进而引起其功能水平的下降,最终可能造成活性氧自由基的积累和对细胞膜的损伤,降低生物的适应能力和健康水平,从而启动一系列的中毒反应[11,12]。因而随着时间的延续,仔鱼体内的SOD、GSH-PX和CAT的活性逐渐下降,证实了机体抗氧化功能可能受到损伤。
许多实验证明,Na+-K+-ATPase对环境中存在的多种有毒物质敏感,它是这些毒物攻击的靶点,并且这些毒物对Na-K-ATPase活性的抑制具有浓度和时间的依赖性[12]。在本实验中,黑鲷仔鱼Na+-K+-ATPase酶活性最大值出现在试验开始的前期和低浓度的染毒组。表现出随着微小亚历山大藻染毒浓度的增加或染毒时间的延长,仔鱼的Na+-K+-ATPase酶活性逐步下降,表明离子传递功能受到了抑制。Na+-K+-ATPase酶作为生物体内重要的代谢酶之一,是细胞膜上主动转运离子的重要组成部分。可推测仔鱼的组织细胞受到损伤,导致细胞膜的生理功能减弱,从而使其体内的能量运输阻断,Na+、K+离子运转减慢,代谢产物大量堆积,酶活性的降低也导致仔鱼组织细胞渗透压调节能力降低[14]。
我们通过实验可以推测藻毒素所诱导的活性氧胁迫可能是黑鲷仔鱼抗氧化酶活性受到影响的主要原因,由此影响体内自由基的代谢平衡,引起鱼体的其他生理功能下降。与上述3种抗氧化酶的活性变化相比,Na+-K+-ATPase酶活性对藻液的染毒环境反应更为敏感,与藻液浓度存在明显的剂量-效应关系,其与上述3种酶的活力变化可以一起作为水体中藻液污染的生物指示器。
致谢:本次实验得到了江苏水产所养殖基地、东海水产研究所的缪宇平副研究员、晁敏副研究员、马继臻同学的大力支持和帮助,在此表示感谢。
[1] 周名江, 朱明远, 张经. 中国赤潮的发生趋势和研究进展 [J].生命科学, 2001, 13(2): 54-59.
[2] 华泽爱. 赤潮藻类的毒素成分及其影响 [J]. 海洋湖沼通报,1994, (2): 74-82.
[3] 周立红, 陈学豪. 塔玛亚历山大藻对罗非鱼肝及鳃组织ATP酶活性的影响 [J]. 海洋科学, 2003, 27(12): 75-78.
[4] 尹伊伟, 王朝辉, 江天久, 等. 海洋赤潮毒素对鱼类的危害 [J].海洋环境科学, 2000, 19(4): 62-65.
[5] Iivingstone D R , Gavcia , Martinez P Michel X , et al. Oxyradical production as a pollution mediated mechanism of toxicity in the common musset, Mytil us edulisl and other mollusks [J]. Funct Ecol,1990, 4: 415-424.
[6] Winston G W, Di Giulio R T. Prooxidant and antioxidomt mechanism in aquatic organism [J]. Aquat Toxicol, 1991, 24: 143-152.
[7] 徐立红, 张甬元, 陈宜瑜. 分子生态毒理学研究进展及其在水环境保护中的意义 [J]. 水生生物学报, 1995, 19(2): 171-185.
[8] Griffith O W. Determination of glutathione and glutathionedisulfide using glutathione reductase and 2- vinylpyridine [J]. Analytical Biochemistry, 1980. 106: 207-212.
[9] ElifO O, Nevin U. Combined effects of 2, 4-D and azinphosmethyl on antixidant enzymes and lipid peroxidantion in liver of Oreoehromis niloticus [J]. Comp BiochemPhysiol, 2000, 127C:291-296.
[10] 韩力强, 康现江, 李双石, 等. 氨氮对斑马鱼2种代谢酶类的影响 [J]. 河北大学学报(自然科学版), 2005, 25(2): 179-184.
[11] 翁妍, 郑微云, 余群. 石油污染对真鲷幼体谷胱甘肽过氧化物酶影响的研究 [J]. 环境科学学报, 2000, 20(1): 91-94.
[12] 方允中, 郑荣梁. 自由基生物学的理论与应用 [M]. 北京:科学出版社: 2002: 23-47.
[13] Nishino H, Kumazaki M, Fukuda A, et a1. Acute 3-nitropropionic acid intoxication induces striatal astrocytiecell death and dysfunction of the blood--brain barrier: involvement of dopamine toxicity [J]. Neurosci Res. 1997, 27(4): 343-355.
[14] Mori F, Cuadra G, Giacobini E. Metrifonate effects on acetylcholine and biogenic amines in rat cortex [J]. Neurochem Res: 1995, 20(9):1 081-1 088.
Effects of Alexandrium minitum on the activities of the antioxidant system and ATPase of larvae of Sparus macrocephalus.
JIANG Mei1, HUANG Shi-lin2, LUN Feng-xia3, XIA Pei-yan4
(1. East China Sea Fisheries Research Institute, Chinese Academy of Fisheries Science, Shanghai 200090, China;2. The Second Institute of Oceanography, State Oceanic Administration, Hangzhou 310012, China;3. Shanghai General Hydrological Station,Shanghai 200232, China; 4. Shanghai Ocean University, Shanghai 200336, China)
In this article, we studied the change of superoxide dismutase (SOD), glutathione peroxidase (GSH-PX),peroxidase (CAT) and Na+-K+-ATPase activity of larvae of Sparus macrocephalus exposed to Alexandrium minitum algae liquid. It revealed that Alexandrium minitum algae liquid had obvious induction to the GSH-PX and CAT of larvae of Sparus macrocephalus in the early exposure stage, especially for the first two days. However, it showed inhibition effect in the following experiment after 2 days. Besides, Alexandrium minitum algae liquid showed strong induction effect to SOD for the first 3 days then changed to the inhibition effect. The obvious dose- response link between the concentration of exposed algae solution and the activity of SOD, GSH-PX and CAT showed that the higher the concentration of algae solution, the lower the inhibition and the greater the biological toxicity. However, the strong inhibition of algae solution to Na+-K+-ATPase displayed concentration-response link. The four enzyme’s activity changes of the larvae of Sparus macrocephalus studied in this paper can work as the biological indicator of algae pollution in water.
Alexandrium minitum; larvae; antioxidant system; ATPase
S965.3;Q143
A
1001-6932(2010)04-0427-05
2009-08-28;
2009-11-17
国家重点基础研究发展规划“973”项目资助(G2010CB428705);中央级公益性科研院所基本科研业务费专项资金(中国水产科学研究院东海水产研究所)(2007M08);上海市科委“登山行动计划”项目 (06dz2015)
蒋玫 (1973-),女,副研究员,主要从事渔业早期生态研究及海洋环境保护与影响评价。电子邮箱:jiangrose73@sina.com
