离子交换树脂吸附锰(Ⅱ)的热力学和动力学研究
2010-09-04朱春雷
马 聪,王 潘,朱春雷,魏 健
(1.中国矿业大学(北京) 化学与环境工程学院,北京 100083;2.中国环境科学研究院,北京 100012)
离子交换树脂吸附锰(Ⅱ)的热力学和动力学研究
马 聪1,2,王 潘2,朱春雷2,魏 健1,2
(1.中国矿业大学(北京) 化学与环境工程学院,北京 100083;2.中国环境科学研究院,北京 100012)
采用静态吸附法,研究了D113离子交换树脂吸附锰(Ⅱ)的过程和机理。结果表明:在一定的浓度范围内,D113树脂对锰(Ⅱ)的吸附符合Langmuir和Freundlich等温吸附方程式,但Langmuir方程更能准确反映该交换吸附过程。热力学函数ΔH<0,表明吸附为放热反应,降低温度有利于吸附进行;ΔS<0,说明吸附过程熵减少占主导作用;ΔG<0,表明该吸附过程为自发过程。吸附交换过程符合HO准二级吸附交换动力学方程,表观吸附活化能Ea为35.085kJ/mol,颗粒扩散过程为吸附的控速步骤。
离子交换树脂;锰;吸附;热力学;动力学
湘、渝、黔3省、市交界处的锰资源丰富,电解金属锰(以下简称为:电解锰)作为部分地区的支柱产业迅猛发展。电解锰生产过程产生大量富含锰废水。目前国内电解锰企业大都采用沉淀法对Mn2+进行分离去除[1~2]。结果导致大量废渣的产生,容易造成“二次污染”,而离子交换法可不但能避免“二次污染”,同时还可以对废水中的金属资源进行回收利用,提高资源利用率[3~4]。近年来对离子交换法处理工业含锰废水的研究尚未见报道,本文选用经预处理的D113树脂,通过其对Mn2+的静态吸附实验,对其吸附Mn2+的热力学与动力学规律进行研究,为其应用于工业含锰废水的治理及资源化处理提供理论基础和可行性依据。
1 实验部分
1.1 试剂与仪器
1.1.1 试 剂
D113弱酸性离子交换树脂,经预处理后备用;锰标准储备液(含Mn2+1.000mg/mL)、锰标准使用液(含Mn2+0.050mg/mL)、焦磷酸钾—乙酸钠缓冲溶液(焦磷酸钾0.600mol/L、乙酸钠1.000 mol/L)、高碘酸钾(20.000mg/mL,所用高碘酸钾为优级纯)作显色剂。其中锰标准储备液、锰标准使用液以及焦磷酸钾—乙酸钠缓冲溶液均使用去离子水进行配制,高碘酸钾则用硝酸(1+9)进行配制。
1.1.2 实验仪器
VIS-722型分光光度计,SHA-BA型水浴恒温振荡器,TB-403型电子天平,HANNApH211型酸度计,DHG-9123A型电热恒温鼓风干燥箱。
1.2 树脂的预处理
首先用无水乙醇将树脂浸泡24h,把残留在树脂中的有机溶剂和杂质除去,后用去离子水漂洗至无乙醇残留;然后用1.000mol/LNaOH溶液将树脂浸泡8h并不断搅拌以将其转化成Na+型树脂,后用去离子水洗至中性;最后将树脂放入60℃电热恒温鼓风干燥箱中烘干至恒重备用。
1.3 分析方法
锰的测定方法,高碘酸钾氧化光度法[5]。
1.4 实验方法
1.4.1 静态吸附平衡实验
1) Freundlich吸附等温线的测定
准确称量0.100,0.200,0.300,0.400,0.500g预处理后的干树脂5份,分别加入到250mL锥形瓶中,加入100mLMn2+浓度为1.482mg/mL的硫酸锰溶液(pH=6.5,下同),将锥形瓶放入到恒温振荡器中在298K下恒温振荡10h至吸附达到平衡。改变温度,其他条件不变,分别在303,313K下进行上述实验。测出Mn2+的平衡浓度,并算出吸附量。平衡吸附量Qe根据下式计算:
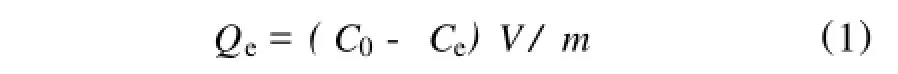
式中 Qe——平衡时的吸附量(下同)(mg/g);
C0和Ce——分别为溶液中Mn2+的起始浓度和平
衡浓度(下同)(mg/mL);
V——溶液体积(mL); m——树脂干重(g)。
2) Langmuir吸附等温线的测定
准确称量5份0.300g预处理后的干树脂,加入到250mL锥形瓶中,再分别加入100mLMn2+浓度为:0.738,0.949,1.202,1.482,2.000mg/mL的硫酸锰溶液,分别在298,303,313K下于恒温振荡器中振荡10h(吸附已达平衡)。测出平衡溶液的浓度,并算出吸附量。
1.4.2 Mn2+的静态吸附热力学实验
准确称取0.300g预处理后的干树脂4份,在C0为0.738mg/mL条件下,用上述方法分别测定在298,303,308,313K时树脂吸附Mn2+的分配比D的变化,其中D=Qe/Ce。
1.4.3 Mn2+的静态吸附动力学实验
准确称取0.300g预处理后的干树脂,加入到250mL的锥形瓶中,然后再加入100mL所配浓度为1.000mg/mL的硫酸锰溶液。分别在298,303,308, 313K下于恒温振荡器中振荡10h,每隔一定的时间取出1mL溶液直至反应平衡。测出其浓度,求出对应吸附量Qt,Qt是t时刻树脂的吸附量(mg/g)。
2 试验结果与讨论
2.1 吸附等温线
本研究使用了Freundlich经验等温式和Langmuir吸附等温式。其中Freundlich经验等温式的函数表达式[6]为:方程两边同时取对数得:式中 KF和n是表示体系吸附量和吸附强度的参数,反映了体系的吸附特性,可由实验数据以lnQe~lnCe作图线性拟合获得。
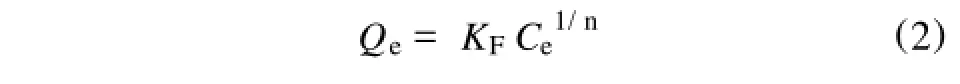
方程两边同时取对数得:
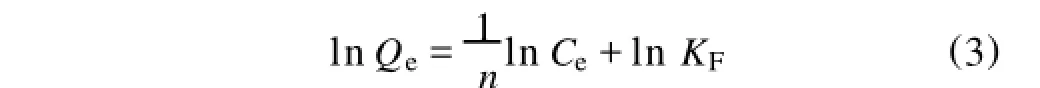
式中KFn是表示体系吸附量和吸附强度的参数,反映了体系的吸附特性,可由实验数据以lnQe~lnCe作图线性拟合获得。

式中 Qm——理论最大吸附量;
KL——常数由实验数据线性拟合得到[7]。
2.1.1 Freundlich吸附等温线
根据Freundlich经验等温式再结合实验所测得到的平衡溶液的浓度和平衡吸附量,以lnQe~lnCe作图如图1所示。
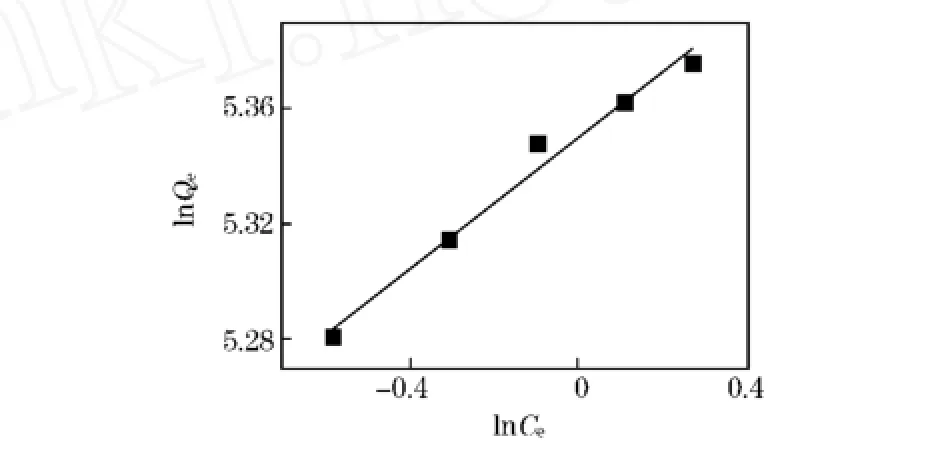
图1 Mn2+的Freundlich等温吸咐曲线
由图中的结果可以看出lnQe与lnCe存在一定的线性关系,直线相关系数R2=0.9704。由直线的斜率和截距可求得n=8.719,KF=210.701。KF代表吸附能力的相对大小,n值反映了吸附剂的不均匀性或吸附反应强度。n值越大,吸附性能越好。一般认为n值为2~10时,容易吸附;n值小于0.5时,则难以吸附。而n=8.719>2,则表明Mn2+比较容易被D113树脂所吸附[8]。
2.1.2 Langmuir吸附等温线
将实验数据以Ce/Qe~Ce作图,结果如图2所示:
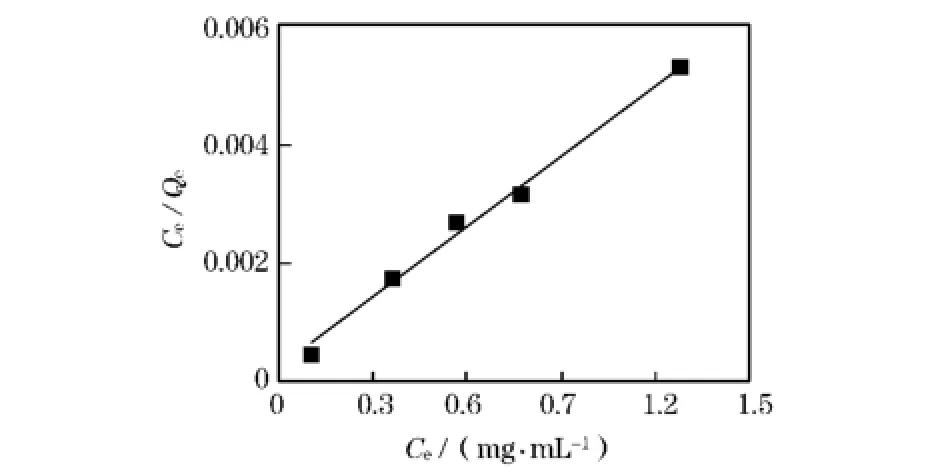
图2 Mn2+的Langmuir等温吸附曲线
将上述两种方法所测得的实验结果进行整理并分别进行线性回归以确定等温吸附平衡关系和相关参数,如表1所示。
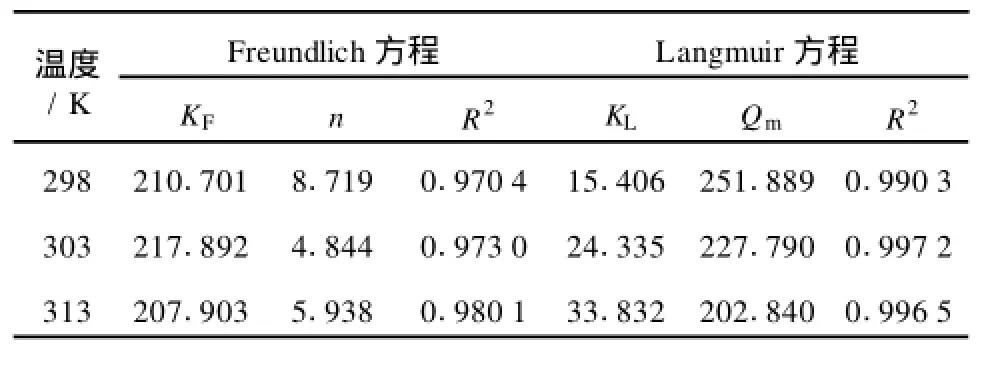
表1 吸附方程的参数
由表1可知,当温度分别为298,303,313K时,采用Langmuir方程拟合Mn2+在D113树脂上的吸附平衡的相关系数均比Freundlich方程拟合的相关系数大,其相关系数R2均在0.99以上,所以在实验条件下用Langmuir方程能够很好地描述Mn2+在D113树脂上的吸附平衡关系。
2.2 温度对树脂吸附锰的分配比的影响
树脂对Mn2+的吸附分配比随温度的变化如图3所示。
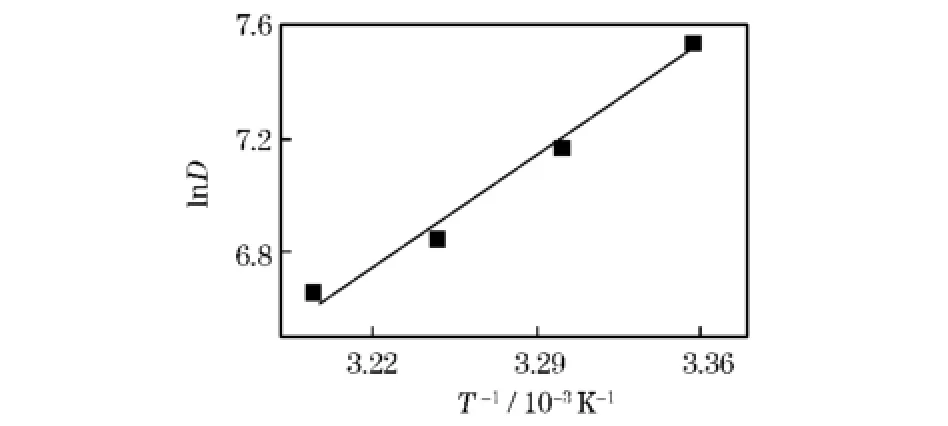
图3 温度对D113树脂吸附锰的分配比影响
图3中直线相关系数R2为0.9884,直线斜率K=5.632,截距为-11.384。根据van’tHoff方程[9]lnD=-ΔH/(RT)+ΔS/R,(R为气体常数, 8.314J/mol·K;T为温度,下同。)求得ΔH= -46.824kJ/mol,ΔS=-94.647J/mol·K。根据吉布斯方程,ΔG=ΔH-TΔS=-18.619kJ/mol。在该树脂吸附Mn2+的过程中,ΔH<0说明该吸附过程为放热过程,降低温度有利于吸附进行,故一般情况下选择常温即可;ΔS<0说明吸附过程中熵减少占主导作用;ΔG<0表明该吸附过程为自发过程。
2.3 吸附速率及表观活化能的确定
在温度为298K条件下,以Qt~t作图,绘出吸附量随时间的变化曲线如图4。
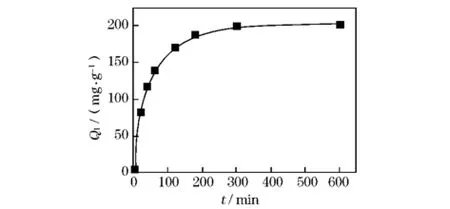
图4 D113树脂对锰的吸附速率曲线
图4的结果表明,D113树脂对Mn2+的吸附在起始阶段吸附速率较快,然后逐渐减慢,吸附量在5 h后就逐渐趋于平衡,平衡吸附量为203mg/g。
通常用于描述吸附动力学方程的数学模型有Lagergren准一级动力学方程(式6)和HO准二级动力学方程(式7)[10~11]:式中 F——交换度,F=Qt/Qe;
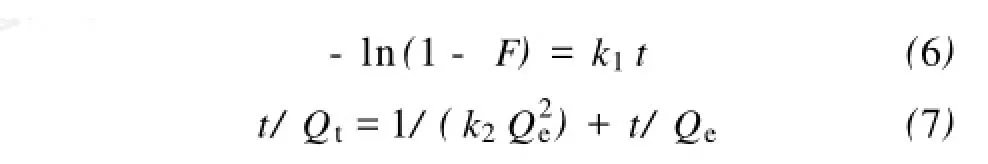
k1——一级吸附反应的速率常数(s);
k2——二级吸附反应的速率常数(g/mg·
min)。
对实验数据分别进行Lagergren准一级动力学拟合和HO准二级动力学拟合,结果表明:按准二级动力学模型拟合能得到很好的吻合效果(R2> 0.999),如表2所示。而采用准一级动力学模型进行拟合则有很大的偏离,说明准二级动力学模型可以更好地描述D113树脂吸附Mn2+的行为。

表2 Mn2+在D113树脂上吸附的动力学方程相关系数
以lnk2对1/T作图(图5),拟合得到的方程为lnk2=5.149-4.220/T。根据Arrhenius方程lnk2=-Ea/RT+A,计算得出吸附交换过程的表观活化能Ea为35.085kJ/mol。

图5 D113树脂吸附锰的活化能的确定
2.4 控速步骤的确定
离子交换过程一般需经历3个步骤:
1)离子由溶液经液膜扩散到树脂表面;
2)由树脂表面向树脂内部扩散;
3)离子在树脂内活性基位置发生交换反应。
即离子交换过程受液膜扩散、颗粒扩散和化学反应3个步骤速度的影响,而其中速度最慢的一步是控制离子交换过程速度的主要控制步骤。液膜扩散、颗粒扩散和化学反应控制方程可分别表示为[9,12]:
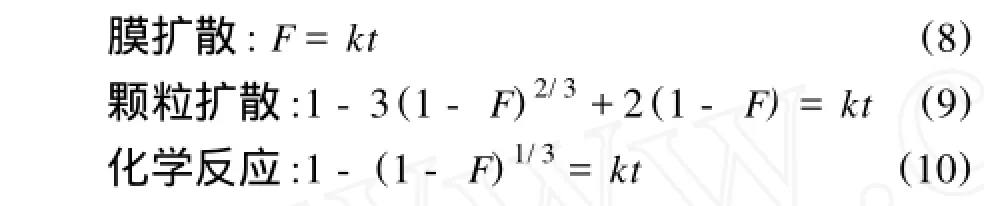
式中 F——交换度,同上;
k——该温度下的扩散系数。将相关数据按上述3个方程拟合,结果见表3。

表3 动力学模型回归结果
由表3可以看出时间t与1-3(1-F)2/3+2(1 -F)和1-(1-F)1/3都具有较好的线性关系,由于化学反应一般都很快,很难成为控速步骤,基本可以判断D113树脂对Mn2+的吸附受颗粒扩散控制。
3 结 论
1) 吸附规律可用Langmuir或Freundlich吸附等温方程描述,Langmuir方程更能准确地反映该吸附过程。
2) 由计算出的热力学函数ΔG、ΔH和ΔS可知,Mn2+在D113树脂上的吸附过程是自发过程(ΔG<0),伴随放热(ΔH<0),熵变为负值(ΔS<0)。
3) 吸附交换过程符合HO准二级吸附交换动力学方程,表观活化能Ea为35.085kJ/mol。
4) 树脂对于Mn2+的吸附为颗粒扩散控制。
[1] 姚俊,田宗平,姚祖风,等.电解金属锰废水处理的研究[J].中国锰业,2000,18(3):25-27.
[2] 樊玉川.含锰废水处理研究[J].湖南有色金属,1998,14(3): 36-38.
[3] 李红艳,李亚新,李尚明.离子交换技术在重金属工业废水处理中的应用[J].水处理技术,2008,34(2):12-15.
[4] Li - Chun Lin,Jiunn - Kwei Li,Ruey - Shin Juang.Removal of Cu (II)and Ni(II)from aqueous solutions using batchand fixed-bedion exchange processes[J].Desalination,2008,All(225):249-259.
[5] 国家环境保护总局水和废水监测分析方法编委会,水和废水监测分析方法(第四版)[M].北京:中国环境科学出版社,2002.
[6] 李增新,王国明,王彤,等.沸石-壳聚糖吸附剂吸附废水中的Ni2+[J].化工环保,2009,29(1):5-9.
[7] 范春英,王栋,陈远超,等.4A分子筛与Ca2+在热水中离子交换的实验研究[J].工业水处理,2009,29(5):39-42.
[8] 张秋利,宋永辉,兰新哲.001×7树脂吸附银氨配合离子的研究[J].有色金属,2007,59(3):52-54.
[9] 李响,魏荣卿,刘晓宁,等.新型弱碱性阴离子交换树脂对Cr (Ⅵ)的吸附性能[J].环境科学与技术,2008,31(10):9-18.
[10]Tsz - Him Shek,Anthony Ma,Vinci K.C.Lee,Gordon Mc Kay. Kinetics of zinc ions removal from effluents using ion exchange resin[J].Chemical Engineering Journal,2009,All(146):63-70.
[11]范文宏,许志珍,冯丽娟.固定化海带生物吸附剂的制备及其吸附Ni2+的动力学特性[J].化工环保,2008,28(3):196-200.
[12]唐嘉英,李鑫,应汉杰.离子交换树脂吸附TP5的热力学和动力学研究[J].南京工业大学学报,2006,28(5):79-83.
Study on Adsorption Kinetics and Thermodyna mics of Mn2+on on - Exchange Resin
MA Cong1,2,WANG Fan2,ZHU Chun-lei2,WEI Jian1,2
(1. School of Chemistry and Environmental Engineering,ChinaUniversity of Miningand Technology(Beijing),Beijing 100083,China;
2. China Research Academy of Environmental Sciences,Beijing 100012,China)
The adsorption process of Mn2+on D113 resin has been investigated by the method of static adsorp-tion.The results show that,within the experiment range of the manganese concentration,the adsorption of Mn2+on D113 resin agrees well with the Langmuir and the Freundlich isothermal adsorption equation.The
X52
A
1002-4336(2010)02-0043-04
2009-12-24
中国环境科学研究院中央级公益性科研院所基本科研业务专项电解锰废水处理及资源化研究(2007KYYW16)
马聪(1985-),女,河南南阳社旗人,2007级硕士研究生,研究方向:水污染控制与治理,手机:13811890738,电话:010-84915040,E-mail:619macong@163.com.
Langmuir gives the better - fit to the experiment data.Moreover,the adsorption reaction is exothermic process asΔH<0,so thet emperature decrease is conducive to adsorption.ΔS<0 indicates that the process is entropy decreasing and ΔG<0 indicates that it is spontaneous.The adsorption kinetic data well fit the HO pseudo - second - or-der rate equation.The apparent activation energy is 35.085kJ·mol-1.The adsorption was controlled by porediffusion.Keywords:Ion - exchange resin;Manganese;Adsorption;Thermodynamics;Kinetics
