Ni-B非晶纳米粉末微电极上丙醇的电氧化
2010-08-30郑一雄
郑一雄
(华侨大学材料科学与工程学院,福建 泉州 362021)
Ni-B非晶纳米粉末微电极上丙醇的电氧化
郑一雄
(华侨大学材料科学与工程学院,福建 泉州 362021)
在水溶液体系中,以化学还原法制得Ni-B非晶态合金纳米颗粒.应用循环伏安法,研究碱性介质中Ni-B非晶态合金纳米粉末微电极上丙醇的电催化氧化,并运用稳态极化曲线测定Ni-B非晶态合金纳米粉末微电极上丙醇的电催化氧化动力学参数.结果表明,Ni-B非晶态合金纳米粉末微电极对碱性溶液中丙醇的氧化具有很高的电催化作用.碱性介质中的Ni-B非晶态合金纳米粉末微电极上,丙醇的电催化氧化速率明显高于高择优取向(220)的镍电极.
Ni-B非晶态合金;纳米颗粒;粉末微电极;丙醇;电催化氧化
镍及氧化镍广泛用作碱性电池、碱性介质中电解水及有机电合成的电极材料.它对醇类有较高的电催化活性,而醇类小分子有望成为未来燃料电池的最佳燃料之一.近年来,有许多关于镍电极电催化氧化醇类小分子的研究报道[1-4],如抛光的多晶镍电极、高择优取向(220)镍电极、碳纳米管负载Ni纳米粒子修饰电极、以多孔氧化铝膜为模板制得的镍纳米线电极、钛基底上化学镀镍电极(Ni-P/SnO2/Ti)及玻碳表面修饰镍氧化物电极等.然而,有关丙醇于镍电极上的电氧化研究则很少.黄令等[5]采用高择优取向(220)镍电极研究丙醇的电氧化反应,发现其电催化活性显著高于低织构度多晶镍电极.文[6]报道了一种用活性炭负载纳米NiO作阳极电催化剂的直接2-丙醇燃料电池,具有较小的尺寸和质量,可在高温下工作,有希望作为汽车应用的新能源.Ni-B非晶态合金纳米颗粒兼具非晶态和纳米粒子的特性,短程有序仅出现在第一原子近邻尺度内.它表面原子配位高度不饱和,呈现很高的催化活性[7-8],在电催化领域上的应用很少报道.本文研究Ni-B非晶态合金纳米粉末微电极上正丙醇的电催化氧化行为,并测定其动力学参数.
1 实验部分
1.1 Ni-B非晶态合金纳米粉末微电极的制备
Ni-B非晶态合金纳米粉末按文[9]所述方法制备.将直径为100μm的铂微盘电极置于90℃王水中腐蚀约20min;然后,依次用蒸馏水、丙酮、蒸馏水超声波清洗干净,烘干.取适量Ni-B非晶态合金纳米粉末于光滑的载玻片上,把电极细端垂直向下反复碾磨,使粉末紧实嵌入已腐蚀的微凹坑内,用滤纸轻轻擦去附在电极周围的粉末,即可得Ni-B非晶态合金纳米粉末微电极.
1.2 循环伏安曲线和稳态极化曲线测试
采用三电极系统,工作电极即上述Ni-B非晶态合金纳米粉末微电极,表观面积为7.85×10-9m2.辅助电极为大面积铂片,参比电极为Hg/HgO(1mol·L-1KOH),电解液为含不同浓度的丙醇的1mol·L-1KOH溶液,用二次蒸馏水配制,实验试剂均为分析纯.实验系统置于25℃恒温水浴,实验前通高纯N2除氧15min.使用CHI-660B型电化学工作站测量循环伏安曲线和稳态极化曲线.循环伏安(CV)测试前至少先经5周次的CV扫描,以期获得稳定的电极表面.
2 结果与讨论
2.1 微电极对丙醇的电催化氧化活性
在不同浓度的丙醇溶液中,Ni-B非晶态合金纳米粉末微电极的循环伏安曲线,如图1所示.图1中:扫描速率为10mV·s-1;曲线a,b,c,d的丙醇浓度分别为0,0.1,0.2,0.3mol·L-1.从图1可知,未加丙醇的CV曲线呈现峰电流接近的氧化还原峰,这是由于Ni(OH)2和NiOOH之间的转化所致[10].加丙醇的CV曲线的Ni(OH)2氧化峰电流明显增大,并随着丙醇浓度的增加而大幅增大.

图1 微电极的循环伏安曲线Fig.1 Cyclic voltammograms of powdermicroelectrode
这是因为正向扫描时,微电极上的Ni(OH)2被氧化为NiOOH,然后又被扩散至微电极表面的丙醇还原为Ni(OH)2.丙醇浓度愈大,NiOOH被还原为Ni(OH)2的量愈多,Ni(OH)2氧化峰电流密度愈大.电位反扫时,末反应完的Ni(Ⅲ)又被还原为Ni(Ⅱ).可见,Ni-B非晶态合金纳米粉末微电极对碱性溶液中丙醇的氧化具有电催化作用.
以含0.1mol·L-1丙醇的碱性溶液,10mV·s-1的扫速作循环伏安测试,当正向扫描至0.6V时,高择优取向(220)镍电极的[5]阳极氧化电流密度约为1.65mA·cm-2,而Ni-B非晶态合金纳米粉末微电极却高达218mA·cm-2;前者对丙醇氧化的起始电位为0.45V,后者低至0.41V.可见,该Ni-B非晶态合金纳米粉末微电极具有更高的电催化活性.
2.2 电催化氧化动力学参数的测定
黄令等[11]采用现场红外反射技术,发现高择优取向(220)镍电极对碱液中乙醇的电催化氧化时,乙醇的氧化经过一系列中间过程后被氧化为乙酸.假定Ni-B非晶态合金纳米粉末微电极上丙醇的电氧化

过程与此类似,其反应历程[5,11-12]可表示为
式(1)中:k1和k-1分别为正、逆向反应的速率常数.则有

式(6),(7)中:β为阳极氧化传递系数;E为微电极电位(vs.Hg/HgO,1mol·L-1KOH).
假定反应(2)为速率控制步骤且体系反应处于稳态,根据物料平衡原理可推导出反应速率为
v=k2k1C/(k1+k-1+4k2C),
经转换,其电流表示式即丙醇电催化氧化的动力学方程为

式(8)中:C为丙醇的浓度(mol·L-1);A为电极的表观几何面积.将式(8)改写为

以I-1对C-1作图可得一直线,同时据式(6),(7)可得斜率(S)和截距(J)分别为

在扫速为0.1mV·s-1,含有丙醇的1mol·L-1KOH溶液中,Ni-B非晶态合金纳米粉末微电极的稳态极化曲线,如图2所示.图1中:曲线a,b,c,d,e的丙醇浓度分别为0.10,0.15,0.20,0.25,0.30mol·L-1.由图2可见,各极化曲线的氧化电流均随电位正移先逐渐增大而后达到稳态.从图2取不同电位下的氧化电流作电流的倒数(I-1),其与丙醇浓度的倒数(Cp-1)关系,如图3所示.

图2 微电极的稳态极化曲线Fig.2 Steady polarization curves of powdermicroelectrode

图3 I-1与Cp-1的关系Fig.3 Relationship betweenI-1andCp-1
根据图3求算的不同电位E下的lnJ与E关系,如图4所示.从图4可知,两者呈现较好的线性关系,其斜率为-19.88,截距19.85,根据式(12)可求得β=0.511,=3.16×10-10s-1.又据图3求算出各直线斜率S与exp(-EF/RT)的关系,如图5所示.从图5可知,两者呈现较好的线性关系,其斜率为1.79×1012,截距12 329,根据式(10)可求得k2=2.68×10-4L·(mol·s)-1,k0-1=0.045 9s-1.
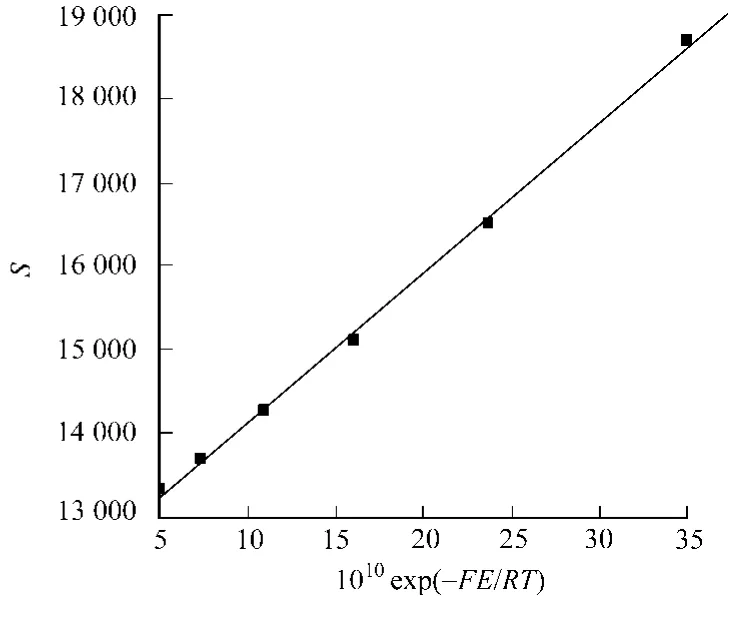
图5 S与exp(-EF/R T)关系Fig.5 Relationship betweenSand exp(-EF/R T)
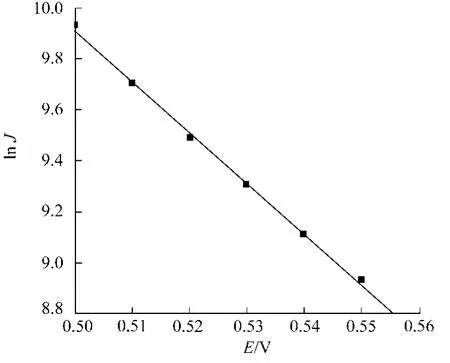
图4 lnJ与E关系Fig.4 Relationship between lnJandE
上述k2是Ni(Ⅲ)与丙醇反应的速率常数,而Ni(Ⅱ)氧化为Ni(Ⅲ)的速率常数k1=3.16×10-10exp(0.511FE/RT),其逆反应的速率常数k-1=0.045 9exp(-0.489FE/RT).该结果与高择优取向(220)镍电极k2=5.64×10-6L·mol-1·s-1),k1=5.25×10-13exp(0.488 FE/RT),k-1=2.46×10-4exp(-0.474FE/RT)[5]相比,分别大2个,3个和2个数量级.显然,在Ni-B非晶态合金纳米粉末微电极上,丙醇的催化氧化速率显著高于高择优取向(220)镍电极.
3 结论
在水溶液体系中,以化学还原法制得Ni-B非晶态合金纳米颗粒.循环伏安实验表明,在Ni-B非晶态合金纳米粉末微电极上,丙醇的电催化氧化活性明显高于高择优取向(220)镍电极.运用稳态极化曲线法,测定Ni-B非晶态合金纳米粉末微电极上丙醇的电催化氧化动力学参数.结果表明,碱性介质的Ni-B非晶态合金纳米粉末微电极上,丙醇的电催化氧化速率明显高于高择优取向(220)镍电极.
参考文献:
[1]孔景临,薛宽宏,何春建.镍纳米线电极的电化学氧化还原行为及其对乙醇的电化学氧化催化作用[J].应用化学,2001,18(6):462-465.
[2]徐红艳,吴华强,徐冬梅,等.碳纳米管负载纳米Ni修饰电极及碱液中电氧化甲醇[J].应用化学,2007,24(5):503-506.
[3]MANANDL HAR K,PL ECTHER D.The preperation of high surface area nickel oxide electrode for synthesis[J].J Appl Electrochem,1979,9(6):707-713.
[4]BERCHMANS S,GOMATHI H,RAO G P.Electrooxidation of alcohols and sugars catalysed on a nickel oxide modified glassy carbon electrode[J].J Electroanal Chem,1995,394(1/2):267-270.
[5]黄令,许书楷,周绍民.碱性介质中高择优取向(220)镍电极上丙醇的电氧化[J].高等学校化学学报,1997,18(6):932-937.
[6]KOBAYASHI T,OTOMO J,WEN Ching-ju,et al.Direct alcohol fuel cell:Relation between the cell performance and the adsorption of intermediate originating in the catalyst-fuel combinations[J].J Power Sour,2003,124(1):34-39.
[7]DENGJing-fa,LI He-xing,WANG Wei-jiang.Progress in design of new amorphous alloy catalysts[J].Catal Today,1999,51(1):113-125.
[8]DAI Wei-lin,LI He-xing,CAO Yong,et al.Evidence for the antioxidation effect of boron on the ultrafine amorphous Ni-B alloy catalyst[J].Langmuir,2002,18(24):9605-9608.
[9]郑一雄,姚士冰,周绍民.Ni-Mo-B非晶态合金纳米颗粒的抗氧化性能研究[J].物理化学学报,2004,20(11):1352-1356.
[10]SCHREBL ER GUZMAN R S,VILCHE J R,ARVIA A J.The potentiodynamic behaviour of nickel in potassium hydroxide solutions[J].J Appl Electrochem,1978,8(1):67-70.
[11]黄令,杨防祖,许书楷,等.碱性介质中高择优取向(220)镍电极上乙醇的电氧化[J].应用化学,2005,22(6):590-594.
[12]KIM J W,PARK S M.Electrochemical oxidation of ethanol at thermally prepared RuO2-modifified electrodes in alkaline media[J].J Electrochem Soc,1999,146(3):1075-1080.
Electrooxidation of Propanol at the Nano Ni-B Amorphous Alloy Powdermicroelectrode
ZHEN G Yi-xiong
(College of Material Science and Engineering,Huaqiao University,Quanzhou 362021,China)
Ni-B amorphous alloy nanoparticles were prepared by chemical reduction with KBH4in aqueous solution.Electrocatalytic oxidation of propanol at the nano Ni-B amorphous alloy powdermicroelectrodes in alkaline media was studied by using cyclic voltammetry.The kinetic parameters of electrocatalytic oxidation of propanol at the nano Ni-B amorphous alloy microelectrode in alkaline media were determined with the steady polarization curves.It is found that the nano Ni-B amorphous alloy microelectrode has very strong electrocatalytic activity for the oxidation of propanol.The rates of electrocatalytic oxidation of propanol at the nano Ni-B amorphous alloy microelectrode in alkaline media are much higher than those at the highly preferred orientation(220)nickel electrode
Ni-B amorphous alloy;nanoparticle;powdermicroelectrode;propanol;electrocatalytic oxidation
TG 139+.8;O 646
A
1000-5013(2010)04-0422-04
(责任编辑:黄晓楠 英文审校:陈国华)
2009-01-29
郑一雄(1966-),男,副教授,主要从事材料物理化学的研究.E-mail:yxzheng@hqu.edu.cn.
福建省自然科学基金资助项目(2006J0440);华侨大学高层次人才科研启动项目(08BS203)
