产大环糊精4-α-糖基转移酶的分离纯化及其性质研究
2010-08-28冀雪霞王金鹏徐学明金征宇
冀雪霞, 王金鹏, 徐学明, 金征宇*
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
产大环糊精4-α-糖基转移酶的分离纯化及其性质研究
冀雪霞1,2, 王金鹏1,2, 徐学明1,2, 金征宇*1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
4-α-糖基转移酶能够作用直链淀粉产生大环糊精。作者研究了重组E.coliDH-5α-TA(保藏编号:3093)产生的4-α-糖基转移酶的分离纯化及酶学性质。粗酶液经过65℃处理20 min、Ni -NTA亲和层析、生物半透膜脱盐得到目标酶,该酶经SDS-PAGE凝胶电泳呈单一蛋白条带,其相对分子质量为57 000。该酶具有较高的转糖基活性且最小作用底物为麦芽糖。酶学性质研究表明:该酶的最适反应温度为75℃,最适p H值为7.5;该酶具有良好的耐热性,在70~85℃酶活维持在80%以上;酶的p H稳定范围为6.0~8.5。
4-α-糖基转移酶;大环糊精;分离纯化;酶学性质
环糊精(cyclodextrin,CD)是由芽孢杆菌属(Bacillus)的某些种产生的葡萄糖基转移酶(CGTase)作用于淀粉而生成的一类环状低聚糖,其中最常见的是聚合度分别为6、7和8的α-、β-和γ-环糊精[1-2]。区别于上述环糊精的大环糊精是指聚合度从9到几百不等的环状葡聚糖[3-4],由于其复杂的空穴结构、高水溶性、低黏度和不回生等特性,可以广泛地用于食品、化学、医药工业中,越来越多的学者开始关注并致力于大环糊精的研究[5-8]。
环糊精的生产通过生物酶法进行的,即由微生物来源的环糊精葡萄糖基转移酶(简称CGTase, EC 2.4.1.19)转化淀粉而得[2,9-11],其中用于制备大环糊精的酶是4-α-糖基转移酶(4-α-GTase,EC 2.4.1.25)[12-13]。该酶是一个多功能性酶(Nakamura et al.1994),属于α-淀粉酶家族[3,14],可以作用直链淀粉使其发生环化反应,生成α-1,4-葡聚糖,即大环糊精(Takaha et al.1996,1998)。尽管从众多微生物或植物中都可以得到该酶[9,15-16,21],但是由于其在生物体内的含量很低,无论是作为研究来源还是用于制备大环糊精,都不能满足需求[7,17]。国外对产大环糊精的糖基转移酶的研究已经进行了几十年,而国内仅近几年才开始进行研究[4,19],对于产大环糊精酶的研究成果很少。
作者利用实验室保存的一株基因工程菌E.coliDH-5α-TA发酵产4-α-CGTase,对该酶进行了分离、纯化和鉴定,并对其酶学性质进行了初步研究,为该酶进一步的研究以及大环糊精的生产提供了理论依据。
1 材料和方法
1.1 材料
1.1.1 菌种 重组E.coliDH-5α-TA,带有p6× HTAaGT Ampr质粒(质粒为韩国首尔国立大学Kwan-Hwa Park教授提供)。
1.1.2 培养基LB斜面培养基(g/L):胰蛋白胨10,酵母膏5,NaCl 10,琼脂20,氨苄青霉素0.1, p H7.5;LB种子培养基(g/L):胰蛋白胨10,酵母膏5,NaCl10,氨苄0.1,p H 7.5;LB发酵基本培养基(g/L):胰蛋白胨10,酵母膏5,NaCl 10,氨苄0.1,p H 7.5。
1.1.3 主要试剂 低相对分子质量标准蛋白:14 400~97 400,分析纯,重庆升博科技有限公司产品; SDS-PAGE试剂:分析纯,北京经科宏达生物技术有限公司产品;麦芽糖标样、三(羟甲基)氨基甲烷:分析纯,国药集团化学试剂有限公司产品。
1.1.4 主要设备 SW-CJ-1F双人单面超净工作台:苏州安泰空气技术有限公司产品;LS-B50L自动立式电热压力蒸汽灭菌锅:上海华线医用核子仪器有限公司产品;3K30冷冻离心机:SIGMA公司产品;J YD-650超声波细胞粉碎机:上海三信仪器有限公司产品;纯泰PURIBEST Ni-NTA亲和层析柱:生物医药纯化技术公共服务平台;SDS-PAGE电泳仪:伯乐公司产品;HPLC:LC-20AT(包括二元泵,手动进样器,柱温箱,示差折光检测器),日本岛津公司产品。
1.2 方法
1.2.1 菌体的收集
1)种子培养 将稳定表达的基因工程菌种从平板上挑取单菌落接种至装有80 mL种子培养基的500 mL三角瓶中培养,设置摇床转速为200 r/ min,37℃培养12h。
2)摇瓶发酵培养 将培养好的种子培养基按照2%(体积比)的接种量,接种至装有80 mL发酵培养基的500 mL三角瓶中,设置转速200 r/min, 37℃发酵培养10 h。
3)收集菌体 将发酵完成的菌液于10 000 r/ min离心10 min收集菌体,用50 mmol/L Tris-HCl (p H 7.5)洗涤细胞两次,彻底去除残余培养基,上清液即为粗酶液。
1.2.2 粗酶液的制备 将湿菌体充分均质,冰浴超声。程序为超声波功率400 W,处理2 s,间隔5 s,循环100次。然后将其混合液于4℃,10 000 r/ min离心10 min,上清液即为粗酶液[17]。
1.2.3 酶活分析 碘比色法:准确吸取250μL质量分数0.2%直链淀粉(DMSO),置入10 mL比色管中,加50μL质量分数1%麦芽糖(Tris-HCl,p H 7.5),600μL 50 mmol/L Tris-HCl(p H 7.5),摇匀。于75℃水浴预热10 min,准确加入0.1 mL酶液,摇匀,立即计时,于75℃水浴准确保温酶解反应10 min,立即取出100μL反应液加入到900μL稀碘液,摇匀即可终止反应。以稀碘液为空白,620 nm波长下测吸光度[18]。
酶活定义:在测定条件下,10 min内吸光度每下降0.1为一个酶活单位。
1.2.4 目标酶的分离纯化
1)酶的初步纯化 将粗酶液置于65℃处理20 min,然后4℃、10 000 r/min离心10 min,取上清液[10],这样以使其中大部分的不耐热的酶变性而沉淀,为进一步的分离纯化提供了方便。
2)Ni-NTA柱亲和层析 所表达的基因工程重组蛋白带有一个组氨酸标签,可用Ni-NTA树脂柱进行亲和层析纯化。将粗酶液经微孔膜过滤后注入平衡好的Ni-NTA亲和层析柱,上样完毕后静置2 h,以便His-tag标签与填料中Ni2+充分结合。先用4 mL洗涤缓冲液[50 mmol/L Tris-HCl(p H 7.5),300 mmol/L NaCl,20 mmol/L咪唑]洗涤过柱以洗去未结合的杂蛋白,再用洗脱缓冲液[50 mmol/L Tris-HCl(p H 7.5),300 mmol/L NaCl, 250 mmol/L咪唑]来洗脱下与亲和柱结合的目标蛋白,此时收集目的酶液。
3)透析脱盐处理 将半透膜制成袋状,将粗酶液置入袋内,将此透析袋浸入去离子水中,样品液中的大相对分子质量的生物大分子被截留在袋内,而盐和小分子物质不断扩散透析到袋外,用磁力搅拌每隔4 h更换一次去离子水,直到袋内外两边的浓度达到平衡为止。
1.2.5 目标酶的鉴定
1)SDS-PAGE鉴定酶的纯度和测定酶的分子量 SDS-PAGE凝胶电泳可以鉴定酶的纯度并测定其分子量。采用不连续垂直平板电泳系统,对纯化后的目标酶进行纯度鉴定[18,21]。分离胶质量浓度15 g/dL,浓缩胶质量浓度5 g/dL,电泳采用p H 7.5的Tris-HCL缓冲体系,考马斯亮蓝R-250染色。根据标准蛋白Marker与样品的SDS-PAGE图比较来判断目标酶的纯度及其相对分子质量大小。
2)HPLC分析 酶的转糖基活性表现在能否将一种底物(糖)转移到另一种底物(糖)分子上。作者用HPLC法在平衡条件下测定底物(葡萄糖、麦芽糖、麦芽四糖混合物)及其酶解产物中各个成分的变化情况,为该酶的作用情况提供参考并为以后酶的应用工作提供了依据和方法。分别向葡萄糖、麦芽糖、麦芽低聚糖中添加等量的酶,75℃保温20 min,100℃加热灭活10 min,最后用0.45μm微滤膜过滤后上机测定。色谱条件:采用糖柱,柱温85℃,流动相为超纯水,流速4 mL/min,进样量10μL,等梯度洗脱。
1.2.6 酶学性质研究
1)不同温度对其酶活的影响为了确定酶的最适反应温度,将酶与底物在p H7.5及不同温度40~100℃条件下反应,反应10 min后分别测其酶活,以最高的酶活力为100%,其余条件下的酶活与其比值换算成相对酶活。
2)不同p H对其酶活的影响由于酶与缓冲液p H有关,所以在分别将缓冲液的p H值调为4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0时,当p H介于4.0~6.0使用50 mmol/L醋酸钠缓冲液作为缓冲体系;当p H介于6.0~7.0使用磷酸钠缓冲液;当p H介于7.0~8.0使用Tris-HCl(p H 7.5)缓冲液作为缓冲体系;当p H介于8.0~10.0使用氨基乙酸-氢氧化钠缓冲液作为缓冲体系;当p H介于10.0~11.0使用碳酸氢钠-氢氧化钠缓冲液作为缓冲体系,在75℃下反应10 min确定各自的酶活,以最高的酶活力为100%,其余条件下的酶活与其比值换算成相对酶活[17]。
3)温度对酶的稳定性影响在相对稳定的p H 7.5下,使酶在某个温度下保温不同时间测定其酶活,以最高的酶活力为100%,其余条件下的酶活与其比值换算成相对酶活。
4)p H值对酶的稳定性影响将酶液分别加入到p H 6.5、7.0、7.5、8.0、8.5、9.0的缓冲体系中室温放置2 h,然后调回最适pH值,在常规条件反应体系中(75℃)测定残余酶活,以最高的酶活力为100%,其余条件下的酶活与其比值换算成相对酶活。
2 结果与分析
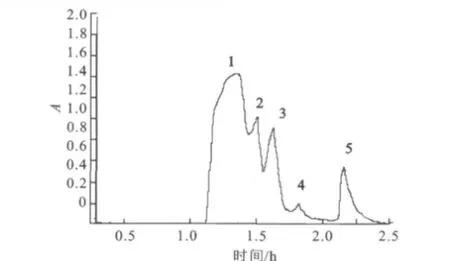
图1 目标酶的Ni-NTA亲和层析柱洗脱曲线Fig.1 Elution curves of purified enzyme on Ni-NTA column
2.1 酶的分离纯化
2.1.1 酶的初步纯化 由于目标酶耐热,所以经过65℃保温20 min处理,可以去除一部分不耐热的杂蛋白。
2.1.2 Ni-NTA亲和层析纯化目标蛋白 由图1中可以看出,粗酶液中蛋白种类较杂,组分较多。经过Ni-NTA亲和层析柱分离得到明显的5个活力峰,即1、2、3、4、5,由1、2、3、4组成的巨大峰为杂蛋白的峰,而5为与Ni-NTA柱耦合后被洗脱液洗洗脱下的目标酶峰。

图2 分离纯化的目标酶电泳图Fig.2 SDS-PAGEanalysis of the purified enzyme
2.1.3 SDS-PA GE分析 分离纯化的目标酶经处理后,用SDS-PAGE电泳来对其进行纯度与相对分子质量检测,结果如图2所示。经过初步纯化(65℃,20 min保温)、亲和层析和透析脱盐,目标酶在SDS-PAGE凝胶中被鉴定为电泳纯,相对分子质量57 000。 2.1.4 HPLC分析酶促反应混合物 采用HPLC法对底物及其酶解产物进行分析,结果如图3~6所示,图中,A1为葡萄糖,B1为麦芽糖,C1为麦芽低聚糖,D为纯酶,A2为经过酶处理的葡萄糖,B2为经过酶处理的麦芽糖,C2为经过酶处理的麦芽低聚糖。图3为葡萄糖标样、麦芽糖标样、麦芽四糖混合物标样的HPLC图,由此可知对应组分的保留时间。为其保留时间对应的组分分析。根据保留时间定性,可知葡萄糖为底物反应前后(图4)无变化;
以麦芽糖为底物反应后(图5)生成了麦芽七糖、麦芽六糖、麦芽五糖、麦芽四糖、麦芽三糖及葡萄糖;
以麦芽四糖混合物为底物反应后(图6)生成了麦芽七糖、麦芽六糖、麦芽五糖、麦芽四糖、麦芽三糖、麦芽糖及葡萄糖。
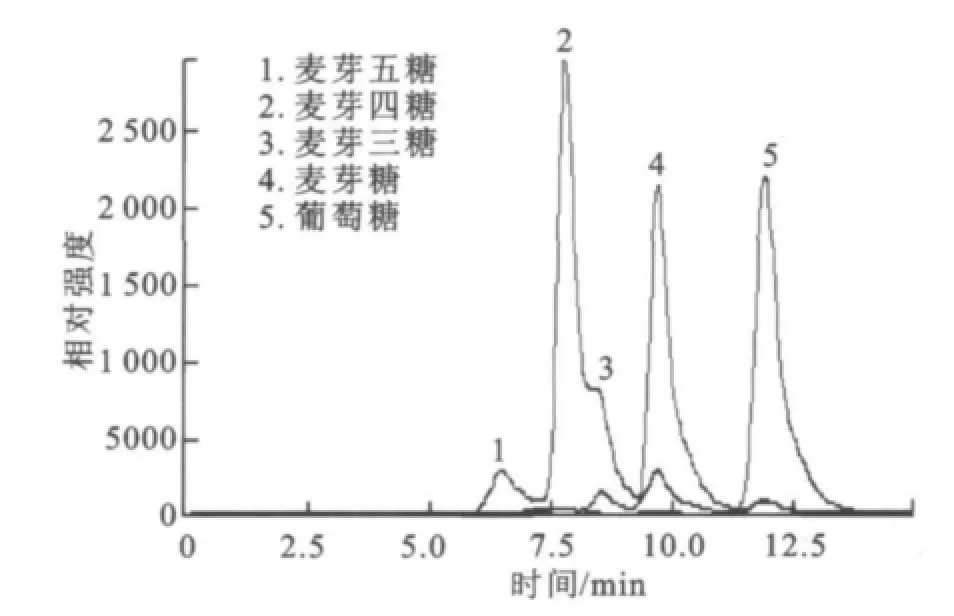
图3 底物标样的HPLC图Fig.3 Standard samples of the substraates

图4 HPLC分析酶促反应混合物(葡萄糖+纯酶)Fig.4 HPLC analysis of the reaction mixture(Glucose +Purified Enzyme)
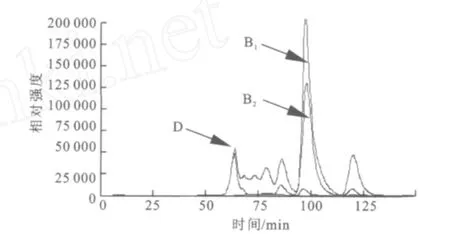
图5 HPLC分析酶促反应混合物(麦芽糖+纯酶)Fig.5 HPLC analysis of the reaction mixture(Maltose +Purified Enzyme)
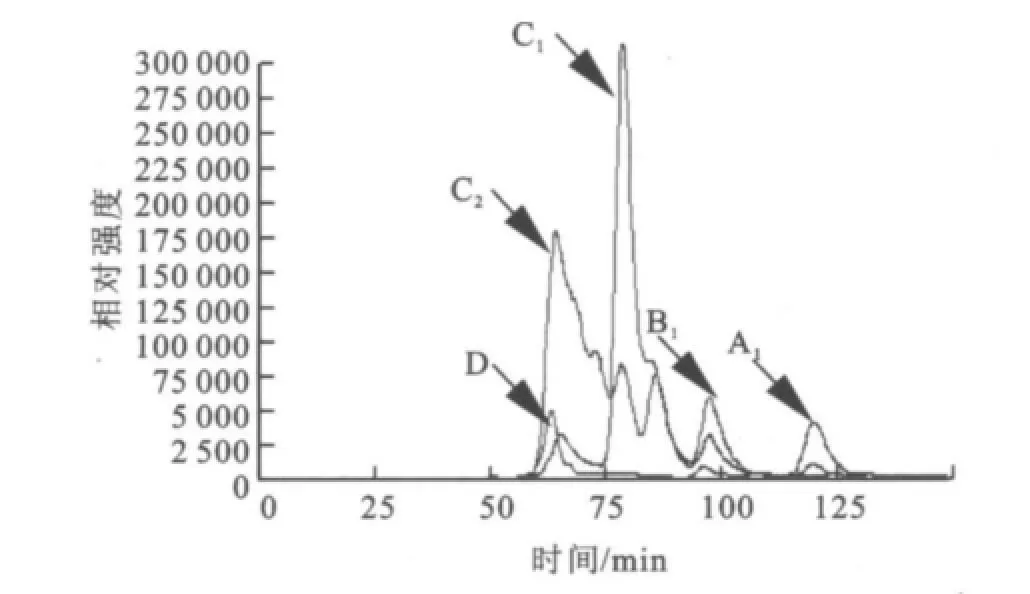
图6 HPLC分析酶促反应混合物(麦芽低聚糖+纯酶)Fig.6 HPLCanalysis of the reaction mixture(Maltotriose&Maltoterraose+Purified Enzyme)
由此可以看出,该酶对葡萄糖没有转糖基活性,最小作用底物是麦芽糖。4-α-糖基转移酶能够作用麦芽糖及麦芽四糖混合物生成麦芽七糖、麦芽六糖、麦芽五糖、麦芽四糖、麦芽三糖、麦芽糖及葡萄糖等,这表明该酶具有良好的转糖基活性。
2.2 酶学性质的研究
2.2.1 最适温度的研究 温度高于最适温度时,引起的酶变性而降低反应速度;在温度低于最适温度时,酶的反应速度随着温度升高而增加,所以为了确定酶的最适反应温度,研究了一定时间内温度对酶活性的影响。如图7所示,该酶随着温度的增加酶活呈上升趋势,约到75℃酶活达到最高,温度超过75℃后酶活开始下降,得知其最适温度为75℃,且在50~85℃范围内酶活都可以达到80%以上,可见该酶为耐热酶,至100℃时仍剩下20%左右的酶活。温度对该酶的影响结果与Jin-Hee Park[15]、王水兴[21]等人研究基本一致。
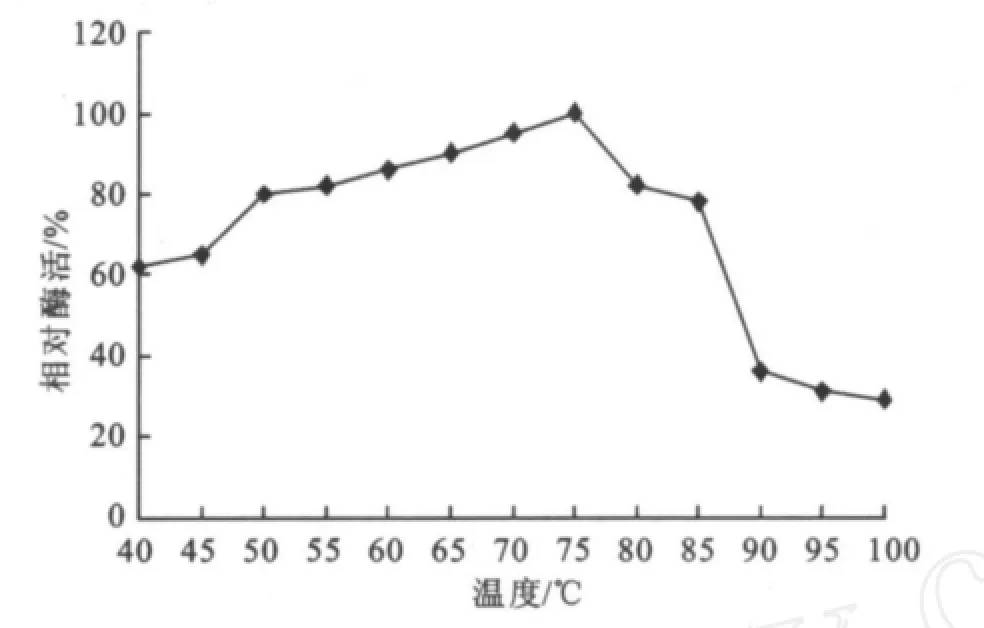
图7 温度对酶活力的影响Fig.7 E ffects of temperature on the specific enzymeactivity
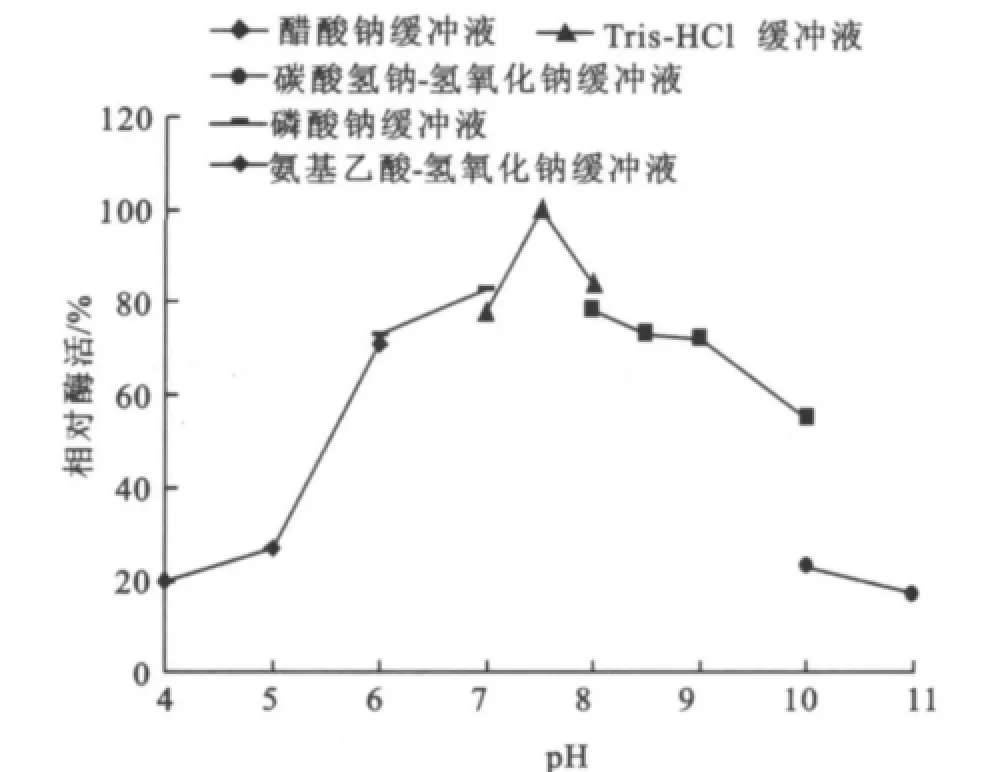
图8 pH对酶活力的影响Fig.8 Effects of pHon the specific enzyme activity
2.2.2 最适p H值的研究 在温度为75℃,反应10 min的条件下,测定反应p H值分别为4.0、5.0、6.0、7.0、7.5、8.0、8.5、9.0、10.0、11.0时的酶活,结果见图8。该酶随着p H的增加,酶活力呈上升趋势,在p H值为7.5时酶反应的转化率最高,然后随着p H上升酶活开始下降,且在p H 6.0~9.0相对酶活达到80%以上。因此确定其反应最适p H为7.5,在p H 6.0~9.0相对稳定。该结果与菌种的生长特性密切相关。理的酶活为100%,由此确定酶的热稳定性。由图9可知,温度75℃下处理,酶活基本可以保持100%;经80℃处理80 min内都可以基本维持90%左右;当经85℃处理随着时间的延长酶活逐渐缓慢下降但60 min内都可以维持80%,在保温80 min残余酶活力大约为78%;而经90℃处理酶活急剧下降最后在大约57 min后就没有酶活,而这些充分体现了它在75~85℃范围内的热稳定性,与Stefan Jane ek[14]和Jin-Hee Park[15]的研究结果基本一致。
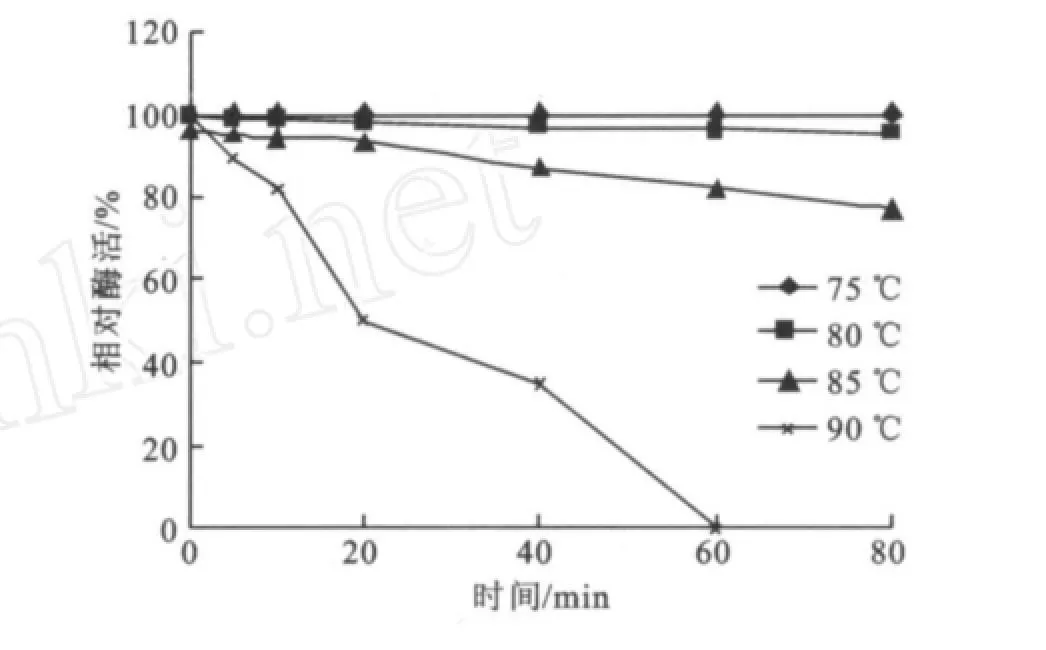
图9 酶的热稳定性Fig.9 Effect of temperature on the enzyme stability
2.2.4 酶的p H稳定性研究 如图10酶的p H稳定性,可见稳定范围较宽,在p H 6.0~8.5范围内稳定,残余酶活力都可以维持在80%左右。
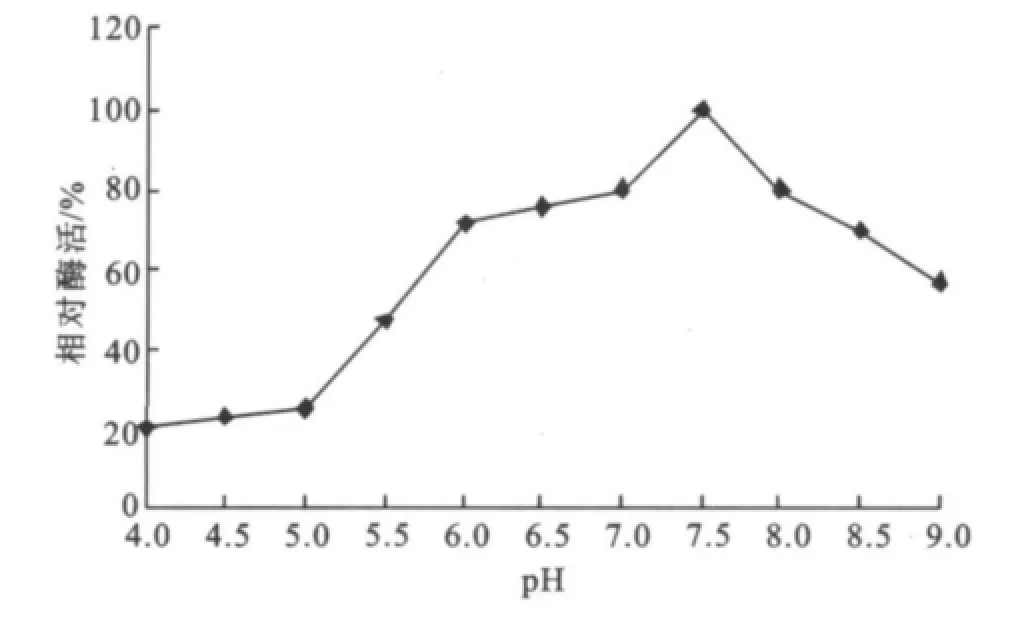
图10 酶的pH稳定性Fig.10 Effect of pHon the enzyme stability
2.2.3 酶的热稳定性研究 在相对稳定的p H值下,分别测定酶的热稳定性。将酶液与50 mmol/L Tris-HCl(p H 7.5)在75~90℃保温,分别在5、10、20、40、60、80 min取样测定酶活,以未经保温处
3 结 语
4-α-转糖基酶在重组E.coliDH-5α-TA中成功地被表达、分离并鉴定。据现有研究报道,4-α-转糖基酶具有产大环糊精的功能[15],该实验用HPLC法证实了该酶的转糖基活性,且最小的作用单位是麦芽糖,为该酶的进一步转糖基活性研究奠定了基础。重组E.coliDH-5α-TA菌株所产的4-α-转糖基酶有较好的热稳定性,在70~85℃范围内基本保持稳定且最适温度为75℃,适合高温生产工艺,为进一步的酶的分离纯化提供了方便。酶活最佳p H为7.5,在p H在介于6.0到8.5基本稳定。酶的相对分子质量(约为57 000)和酶学性质与报道的芽孢杆菌属的其他转糖基酶性质类似。因此本研究为今后对该菌的生产化应用及大环糊精的研究提供了可能,但该菌种的产酶率还偏低,有待进一步提高。
[1]Haruhisa U,Masahiro Wasahiro W,Hiromasa N,et al.Physicochemical properties of large-ring cyclodextrins(CD18-
CD21)[J].Journal of Inclusion Phenomena and Macroccyclic Chemistry,2002,44:403-405.
[2]金征宇,顾正彪,童群义.碳水化合物化学[M].北京:化学工业出版社,2007:126-184.
[3]Qingsheng Q,Tomohiro E,Wolfgang Z.Effect of the reaction temperature on the transglycosylation reactions catalyzed by the cyclodextrin glucanotransferase fromBacillus maceransfor the synthesis of large-ring cyclodextrins[J].Tetrahedron,2004,60(3),799-806.
[4]王水兴,郭勇,许杨.大环糊精及其在食品工业应用前瞻[J].食品与机械,2006,22(2),113-116.
WANG Shui-xing,GUO Yong,XU Yang:Large cyclodextrins and their utilization in food industry[J].Food&Machnery,2006,22(2):113-116.
[5]Lambertsen Larsen K,Duedahl Olesen L,Wolfgang Z,et al.Purification and characterisation of cyclodextrin glycosyltransferase fromPaneibacillu sp.F8[J].Carbohydrate Research,1998,310(3):211-219.
[6]Tomono K,Mugishima A,Suzuki T,et al.Interaction between cycloamylose and various drugs[J].Journal of Inclusion Phenomena and Macrocuclic Chemistry,2002,44:267-270.
[7]Meiying Z,Tomohiro E,Wolfgang Z.Synthesis of large-ring cyclodextrins by cyclodextrin glucanotransferases from Bacterial Isolates[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2002,44:387-390.
[8]王璋,许时婴,汤坚.食品化学[M].北京:中国轻工业出版社,1999,45-83.
[9]Shuang Yan T,Eui Jeon W,Kwan Hwa P,et al.Contribution of W229 to the transglycosylation activity of 4-α-glucanotransferase from Pyrococcus furiosus[J].Biochimica et Biophysica Acta,2006,1764:1633-1638.
[10]Shoichi K:Cyclodetrin producing enzyme(CGTase)[M].Process in biotechnology,1996,12:23-41.
[11]Van der Veen B A,Uitdehaag J C M,Dijkstra B W,et al.Engineering of cyclodetrin glycosyltransferase reaction and product specificity[J].Bicochim Biophys Acta,2000,1543(2):336-360.
[12]Terada Y,Yanase M,Takaha T,et al.Cyclodextrins are not the major cyclic alpha-1,4-glucans produced by the initial action of cyclodextrin glucanotransferase on amylase[J].Biological Chemistry,1997(272):15729-15733.
[13]Lambertsen Larsen K.Large cyclodextrin[J].Journal of inclusion phenomena and macrocuclic chemistry,2002,43:1-13. [14]Stefan Jane ek.α-amylase family:Molecular biology and evolution[J].Progress in biophysics and molecular biology,1997, 67(1):67-97.
[15]Jin-Hee P,Kwan-Hwa P.Characterization of 4-α-glucanotransferase from Thermus scotoductus and Its Applications to carbohydrate Engineering[D].Korean:Seoul National University,2004.
[16]Takaha T,Yanase M,Takata H,et al.Potato D-enzyme catalyzes the cyclization of amylase to produce cycloamylose,a novel cyclicglucan[J].Journal of Biological Chemistry,1996,271:2902-2908.
[17]庄海宁,金征宇.酶法合成低聚糖和新糖复合物的研究进展[J].食品与生物技术学报,2008,27(2):1673-1689.
ZHUANG Hai-ning,J IN Zheng-yu.Enzymatic systhesization of oligosaccharides and new compounds research[J].Journal of Food Science and Biotechnology,2008,27(2):1673-1689.
[18]Jin-Hee P,Hyun-Jung K,Yung-Hee K,et al.The action mode of Thermus aquaticus YT-1 4-α-glucanotransferase and its chimeric enzymes introduced with starch-binding domain on amylase and amylopectin[J].Carbohydrate Polymers,2007, 67:164-173.
[19]王水兴,李燕萍,许杨.基因工程菌E.coliBL21/pET-Dsba-MaIQ发酵产麦芽糖转糖基酶的研究[J].食品科学,2007,28 (08):285-289.
WANG Shui-xing,LI Yan-ping,Xu Yang,et al.Research on the glycosyltransferase proceduced by clonedE.coli BL21/ p ET-Dsba-MaIQ[J].Food Chemistry,2007,28(08):285-289.
[20]王水兴,郭勇,吴凌伟。来自基因工程菌E.coli BL21/p ET-Dsba-MaIQ麦芽糖基酶的分离纯化及酶学性质研究[J].食品科学,2007,28(12):258-262.
WANG Shui-xing,GUO Yong,WU Ling-wei,et al.Purification and Characterization of Amylomaltase from Genetic Engineering StrainE.coliBL21/pET-Dsba-MaIQ[J].Food Chemistry,2007,28(12):258-262.
[21]胡静,陈育如,魏霞.高产环糊精糖基转移酶的枯草芽孢杆菌选育、产酶和酶学特性[J].食品与生物技术学报,2008,27 (4):1673-1689.
HU Jing,CHEN Yu-ru,WEI Xia.Screening,Optimized Fermentation and Enzymatic Properties of a Bacillus subtilis Producing Cyclomaltodextrin Glucanotranferase[J].Journal of Food Science and Biotechnology,2008,27(4):1673-1689.
(责任编辑:朱明)
Purification and Properties of 4-α-Glucanotransferase Producing Large-Ring Cyclodextrin
J I Xue-xia1,2, WANGJin-peng1,2, XU Xue-ming1,2, J IN Zheng-yu*1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
4-α-glucanotransferase has the function of generating large-ring cyclodextrin.The crude enzymes production by the genetic mutant ofE.coli D H-5α-TA(CGMCC No.3093)was separated and purified by high-temperature processing(65℃,20 min),Ni-NTA affinity column and dialysis.The purified enzyme was demonstrated by SDS-PAGE to be a homogeneous protein and the molecular weight was estimated as 57KDa.It was proved to be with the high level of transglycosylation activity by HPLC which was always used to measure the oligosaccharide and its smallest substrate was maltose.The enzyme exhibited high stability at the temperature range from 70℃to 85℃and the p H range from 6.0 to 8.5.The optimal temperature for the enzyme was 75℃and optimal p H was 7.5,respectively.
4-α-glucanotransferase,large-ringcyclodextrin,separationandpurification, enzymatic property
TS 236.9
:A
1673-1689(2010)03-0336-06
2009-07-15
2007国际科技合作计划项目(2007DFA31120);江苏省自然科学基金创新学者攀登项目(BK2008003);食品科学与技术国家重点实验室2008年度目标导向项目(SKLF-MB-200804);江苏省科技支撑计划项目(BE2008317)。
*通信作者:金征宇(1960-),男,江苏扬州人,教授,工学博士,博士生导师,主要从事碳水化合物研究。Email:jinlab2008@yahoo.com
