用酸性碘酸钾溶液直接滴定法测定亚硫酸钠含量
2010-08-28陈智晖陈集谭佳
陈智晖,陈集,谭佳
(1.中石化西南油气分公司工程技术研究院,四川德阳618000;2.西南石油学院化学化工学院,四川成都610500)
用酸性碘酸钾溶液直接滴定法测定亚硫酸钠含量
陈智晖1,陈集2,谭佳1
(1.中石化西南油气分公司工程技术研究院,四川德阳618000;2.西南石油学院化学化工学院,四川成都610500)
提出了一种用酸性碘酸钾溶液直接滴定亚硫酸钠溶液的方法,用以测定高浓度亚硫酸钠样品的含量。该方法与标准方法相比,不用易挥发损失的I2溶液和稳定性较差且配置标定较麻烦的硫代硫酸钠溶液,简化了操作,降低了分析成本。其镜密度较高,RSD≤0.18%,测定结果与标准方法无显著差异。
亚硫酸钠;滴定法;碘酸钾
当前,亚硫酸钠含量的测定均采用国家标准(GB)或石油化学工业标准(HG)所规定的间接碘量法,即在含亚硫酸钠的样品溶液中加入过量的碘标准溶液,然后在酸性条件下用硫代硫酸钠溶液滴定过量的碘溶液[1,2]。该方法虽然准确度高,但要使用易挥发损失的碘溶液和配置标定麻烦且稳定性较差的硫代硫酸钠溶液,所用试剂较多,操作费时。陈集等人提出了用碘酸钾滴定法测定溶液中的亚硫酸根[3]。主要反应如下:
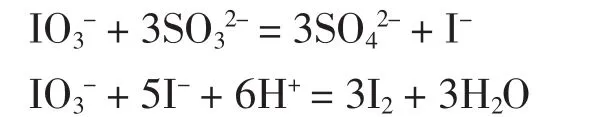
该方法用于空气监测中SO2标准溶液的标定,取得较高的准确度,与标准方法无显著差异,并且不用碘和硫代硫酸溶液,减少了试剂,简化了操作,降低了操作成本。但是用此方法测定高浓度亚硫酸钠样品时会产生较大的负误差。原因是在酸性介质中,亚硫酸根的浓度愈高愈易于生成H2SO4而发生挥发损失。为此,我们将碘酸钾标准溶液改用盐酸酸化,直接滴定未经酸化的亚硫酸溶液,用淀粉指示剂指示终点。通过实验,确定了滴定条件、方法的精密度和准确度,并与标准方法进行了对比试验,证实了酸性碘酸钾溶液直接滴定法测定高浓度亚硫酸钠样品是完全可行的。
1 实验部分
1.1 仪器和试剂
通用滴定器(西南石油学院);SSY-H恒温水浴(温度波动度≤1℃)
标准方法所用试剂:0.10mol/L I2溶液(A·R);0.10mol/L Na2S2O3(A·R);0.5%淀粉指示剂溶液(A·R);HCl溶液(A·R);无水亚硫酸钠(A·R)
酸性KIO3滴定法所用试剂:c1/6KIO3=0.2000mol/L酸性KIO3标准溶液(A·R);0.5%淀粉指示剂(A· R);无水亚硫酸钠
1.2 实验方法
1.2.1 标准测定法 见文献[1]。
1.2.2 酸性KIO3溶液滴定法 准确称取无水亚硫酸钠样品(已烘,冷却)0.25~0.3g于碘量瓶中,加入约50mL新煮沸且已冷却的纯水,加入一定量的淀粉指示剂。然后用0.2000mol/L的酸性KIO3标准溶液滴定。当溶液突然变蓝,且1min内颜色不消失,即到达滴定终点。用下式计算亚硫酸钠的质量分数:
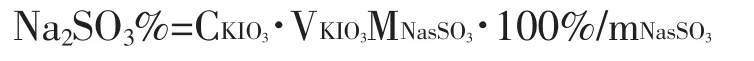
式中:CKIO3—KIO3标准溶液的浓度(mol·L-1)、
VKIO3—KIO3标准溶液消耗的体积(mL)
MNasSO3—Na2SO3的摩尔质量(g·mol-1)
MNa2SO3—亚硫酸钠样品的质量(g)
2 结果与讨论
2.1 酸性条件的选择
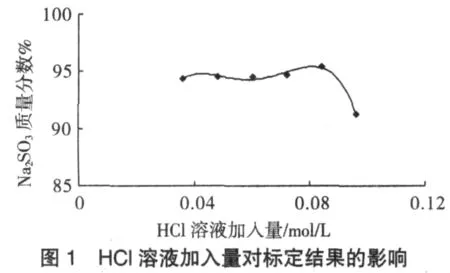
KIO3与I-的反应必须在酸性条件下进行,改变酸性KIO3标准溶液中HCl的加入量,按上述滴定法的步骤操作,对同一Na2SO3样品进行标定,结果见图1。当HCl溶液加入量<3.6×10-2mol/L时,溶液酸度太低,KIO3的氧化能力减弱,指示剂不变色;HCl溶液加入量在3.6×10-2~8.5×10-2mol/L时,所测结果比较稳定,在8.4×10-2mol/L左右效果最佳;但当HCl溶液加入量过大时,标定结果偏低。故可选取HCl溶液加入量为8.4×10-2mol/L。
2.2 指示剂用量的选择
改变淀粉指示剂的用量,用酸性KIO3溶液滴定法测定同一Na2SO3标准溶液,所得结果表明,指示剂用量对标定结果影响不大,但若指示剂用量太低,终点颜色较浅;若指示剂用量太高,标定结果略有偏小。故可选指示剂用量为2~3mL。
2.3 温度对滴定结果的影响
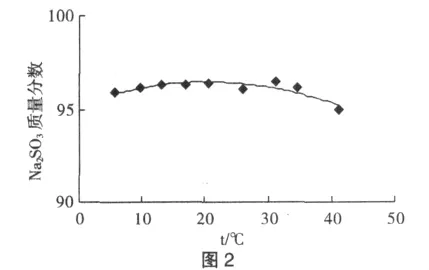
取同一Na2SO3,置于超级恒温水浴内,在不同温度下,用酸性KIO3溶液滴定法测定其浓度,作 Na2SO3质量分数和温度的关系曲线如图2所示。可以看出,在10~37℃范围内Na2SO3质量分数变化不大,但温度过高,则会引起Na2SO3质量分数减小,使测定结果偏低。结果表明,可在室温下滴定。
2.4 干扰及其抑制方法
S2-、S2O32-、Fe2+、Hg2+等还原性物质会产生正干扰,可去两份试样,其中一份加入甲醛掩蔽亚硫酸根,另一份不加入,分别用酸性KIO3法滴定。而这结果之差就是扣除了干扰离子影响的亚硫酸钠含量。
2.5 酸性KIO3溶液滴定法的精密度
用酸性KIO3溶液滴定法对两种Na2SO3样品分别平行测定7次,计算出样品一Na2SO3质量分数分别为 96.12,96.41,96.26,96.02,96.19,96.52,96.14,其均值x=96.24,标准偏差S=0.175,相对标准偏差RSD=0.18%。样品二 Na2SO3质量分数分别为:96.48,96.54,96.70,96.48,96.54,96.34,96.68,其均值x=96.54,标准偏差S=0.124,相对标准偏差RSD= 0.13%。可以看出,此方法的紧密度较高。
2.6 酸性KIO3溶液滴定法与标准测定法的对比
对于两种不同厂家的无水亚硫酸钠产品a,b分别取的7组不同量,然后用酸性KIO3溶液滴定法和标准法测定其含量,结果见表1。
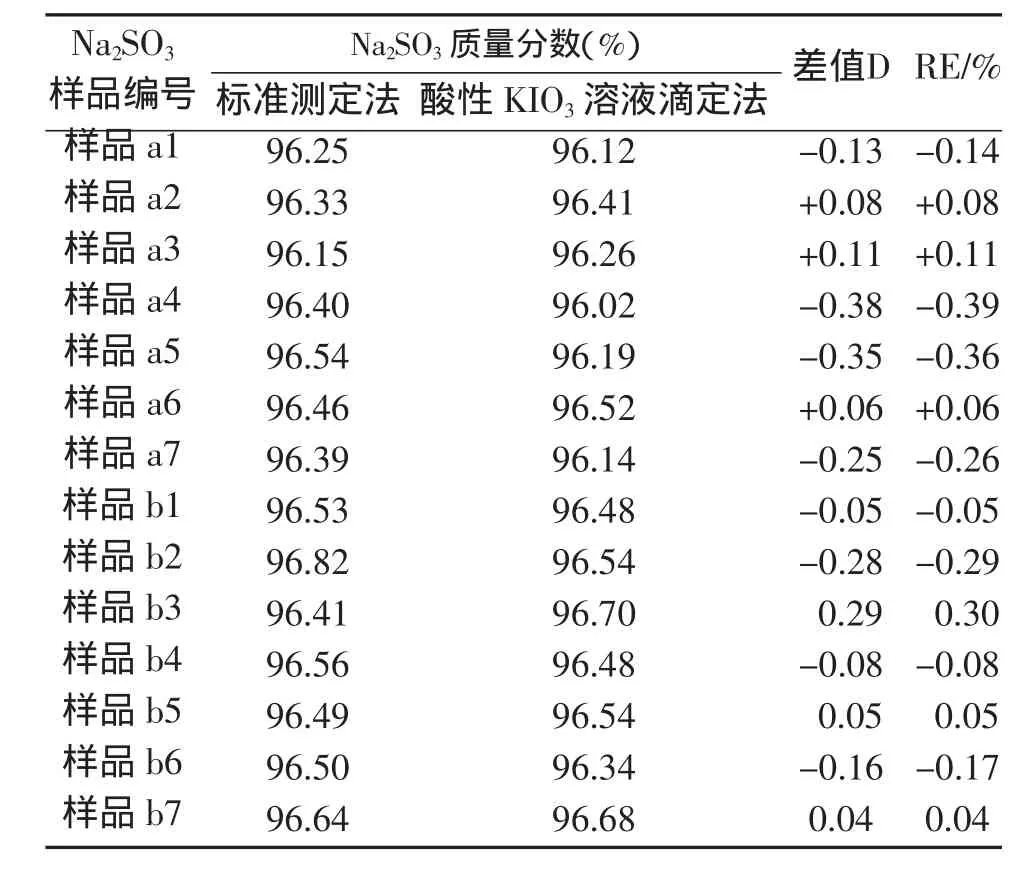
表1 KIO3酸性溶液滴定法与标准测定法对比实验结果
可以看出,对于两种样品两种方法差值很小,样品一相对误差RE<±0.40%,样品二相对误差RE<±0.30%,说明两者结果非常相近。对两种方法用两种样品分别进行显著性检验[4]:

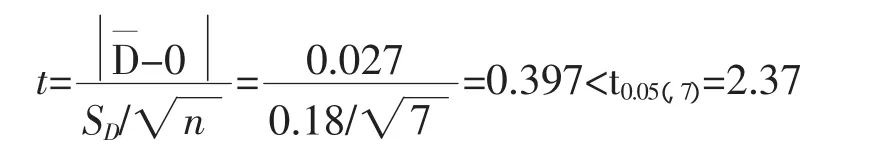
结果表明,两种测定方法无显著差异。酸性KIO3溶液滴定法的准确度与标准方法相当,其测定结果是可靠的。且酸性KIO3溶液滴定法减少了试剂,简化了操作,降低了分析成本,值得推广使用。
[1] 化学工业标准汇编化学试剂(下)1996[M].北京:中国标准出版社.1997.1.252-253.
[2] 上海市化工轻工供应公司、上海化工采购供应站技术室编.化工商品检验方法[M].北京:化学工业出版社,1988.391-392.
[3] 陈集,等.用碘酸钾滴定法标定二氧化硫标准溶液[J].分析实验室,2003,22(4):64-66.
[4] 奚旦立,孙裕生,刘秀英编.环境监测(修订版)[M].北京:高等教育出版社,1995.304.
A method of direct titration to measure the content of Na2SO3with the standard acidic aqua of KIO3
CHEN Zhi-hui1,CHEN Ji2,TAN Jia1
(The Engineering Technololgy Institute of Southwest Petroleum Branch,Sichuan 618000;School of Chemistry and Chemical Engineering,Southwest Petroleum Universiny,Sichuan Chengdu 610500)
Using the method of direct titration to measure the content of Na2SO3by using the standard acidic aqua of KIO3,two kinds of sampleses are respectively mensured In the experiment,the RSD are 0.18%s and 0.13%, compared with the result of standard method,It has no obvious difference,RE<±0.40%。
Na2SO3;titration method;KIO3
book=2010,ebook=155
10.3969/j.issn.1008-1267.2010.04.019
TQ125.1+4
A
1008-1267(2010)04-049-03
2010-03-03
陈智晖(1983-),女,工程师,2006年毕业于西南石油大学研究生院,现从事钻井液研究与应用工作。
