腹主动脉瘤血管平滑肌细胞凋亡和自噬研究
2010-08-28杜亚豪郑月宏李汇华
杜亚豪,郑月宏,田 翠,李汇华
腹主动脉瘤血管平滑肌细胞凋亡和自噬研究
杜亚豪,郑月宏,田 翠,李汇华
目的 探讨血管平滑肌细胞(SMC)凋亡和自噬与腹主动脉瘤(AAA)发病的关系。方法 采用原位末端DNA标记(TUNEL)技术观察AAA和人正常主动脉组织中SMC凋亡的情况,并用免疫组织化学分析其中LC3的蛋白表达。提取AAA和正常主动脉组织RNA,采用RT-PCR方法检测其中与自噬相关的基因Beclin1、Atg4b、Bnip3、Vps34的表达。结果 AAA组织中凋亡的SMC明显高于正常主动脉组织(P<0.05);LC3蛋白在AAA中的表达高于正常主动脉组织(P<0.05);AAA中Beclin1、Atg4b、Bnip3、Vps34表达水平明显高于正常主动脉组织(P<0.05)。结论 SMC凋亡和自噬在AAA的发病中起重要作用。
主动脉瘤,腹;细胞凋亡;自噬;肌,平滑,血管
腹主动脉瘤(abdominal aortic aneurysm,AAA)是一种以腹主动脉局限性扩张为主的血管疾病,多见于65岁以上老年人,病死率较高。AAA的发病机制尚未明确,普遍的观点认为是遗传、环境、血流动力学和免疫等多种因素共同作用的结果。目前认为其发病的主要机制是主动脉细胞外基质的降解和中膜平滑肌细胞(smooth muscle cell,SMC)的减少。SMC是腹主动脉中膜的主要细胞,直接或间接地分泌弹力蛋白、胶原蛋白及其他基质蛋白,对于动脉弹力板层的构筑和修复起着十分重要的作用。细胞凋亡和自噬都是主动而有序的细胞自我消亡,SMC的凋亡和自噬与心血管系统生理病理重构密切相关。本研究通过检测AAA与人正常主动脉组织SMC的凋亡情况,以及在mRNA和蛋白水平上检测其中的细胞自噬情况,探讨SMC的凋亡和自噬在AAA发病中的机制。
1 材料与方法
1.1 组织和试剂 10例AAA组织由北京协和医院血管外科医师术中获取后提供,6例人正常主动脉组织取自健康非正常死亡尸体(死亡时间<10 min)。在无菌、无RNA酶条件下,于平肾动脉下方约4 cm处切取主动脉壁,迅速冻存在液氮中备用。Trizol购自美国Invitrogen公司,LC3抗体购自美国R&D公司。免疫组化试剂盒购自北京中杉金桥生物公司,T UNEL试剂盒购自瑞士Roche公司,RT-PCR试剂盒购自Qiangen公司。其余均为国产分析纯试剂。
1.2 组织凋亡染色 AAA和正常主动脉组织固定、包埋,制作石蜡切片 ,厚度4 μ m ,进行组织凋亡染色,操作程序严格按照T UNEL试剂盒说明书进行,DAB显色,阳性细胞为细胞核中有棕色颗粒,呈散在分布。400倍光学显微镜下随机计数6个视野,共约2000个细胞,计算每个视野阳性细胞的百分数后进行统计学分析。
1.3 免疫组织化学检测LC3蛋白的表达 免疫组化试剂盒为中杉金桥PV-9000二步法检测试剂,严格按照说明书操作,一抗用兔抗人LC3抗体,工作浓度为1∶1000;DAB显色,苏木素复染。显微镜下观察棕黄色染色为阳性,用计算机彩色图像分析系统分析每张切片上中膜免疫组化染色阳性细胞的染色强度(平均积分吸光度值)。
1.4 RT-PCR法半定量检测 Beclin1、Atg4b、Bnip3、Vps34基因表达 严格按照按照 Trizol说明书提取AAA和正常主动脉组织总RNA,紫外分光光度计检测RNA的浓度和纯度,琼脂糖凝胶电泳检测其完整性。逆转录过程按RT-PCR试剂盒说明书操作,PCR扩增循环参数 Beclin1为94℃3 min,95℃30 s、60℃30 s、72℃30 s ,共 32个循环,72℃终延伸 10 min;Atg4b、Bnip3、Vps34 为 94℃3 min,95℃1 min、58℃1 min、72℃1 min,共 30个循环,72℃终延伸 10 min ;GADPH 为 94℃3 min,95℃1 min、59℃30 s、72℃30 s ,共 30个循环,72℃终延伸10 min,共28个循环,引物序列见表1,由上海生工生物技术有限公司合成。PCR产物经琼脂糖凝胶电泳后,凝胶成像系统拍照,以目的基因与内参对照的积分吸光度比值表示mRNA相对表达量。

表 1 Beclin1、Atg4b、Bnip3、Vps34及 GAPDH引物核苷酸序列
2 结 果
2.1 T UNEL染色及凋亡细胞计数 T UNEL染色结果显示,AAA组织中层组织中几乎所有的SMC显示出 TUNEL染色阳性;而正常主动脉中TUNEL阳性细胞很少(图 1)。统计结果显示,AAA组织中凋亡的SMC比例为(76.2±9.0)%,明显比正常主动脉组织的(6.9±1.3)%高,差异有显著统计学意义(P<0.05,表2)。

表2 正常主动脉和AAA组织TUNEL染色阳性细胞的比例

图1 正常主动脉组织(A)和AAA组织(B)平滑肌细胞(黑箭头)(TUNEL染色,×400)
2.2 免疫组织化学 在AAA组织中LC3的表达明显高于正常主动脉组织。AAA组织的阳性表达主要集中于中膜,在中膜染色呈深棕色,内膜和外膜也有一些阳性染色;而在正常主动脉组织中,内膜有较浅阳性染色,中膜和外膜几乎未见阳性染色(图2)。AAA组织中膜细胞阳性染色明显比正常主动脉组织高(P<0.05,表3)。

表3 正常主动脉和AAA组织中膜LC3的表达
2.3 RT-PCR RT-PCR结果可以看出,自噬相关基因在AAA组织中的含量明显高于正常主动脉组织(图 3)。Beclin1、Atg4b、Bnip3、Vps34在正常动脉组织中含量很少,而在AAA组织中含量较高,差异有显著性(P<0.05,表 4)。
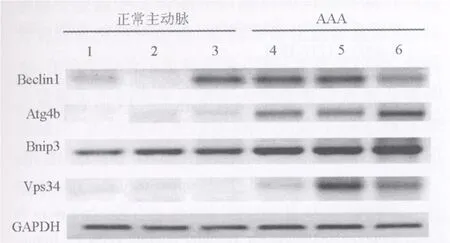
图 3 Beclin1、Atg4b、Bnip3、Vps34在正常主动脉和AAA组织中的表达
3 讨 论
AAA具体发病原因至今未明,动脉中膜SMC密度降低是AAA主要病理特征之一。SMC丢失以及导致的细胞外基质合成减少使得腹主动脉结构严重受损,这是AAA形成中不可忽视的原因。Cailhier等[1]通过抑制胱天蛋白酶(caspase-3)抑制组织蛋白酶(cathepsin L)的释放和细胞外基质的降解,证明了AAA的发病与细胞凋亡有一定的关系。Rowe等[2]观察动脉瘤组织和正常主动脉组织,发现动脉瘤组织中的SMC密度低于正常主动脉组织。郭付有等[3]RT-PCR法检测了颅内动脉瘤、AAA及正常主动脉中caspase-3的表达情况,发现AAA中的caspase-3含量明显高于正常主动脉,这些结果说明中膜SMC凋亡与AAA形成有关。目前SMC凋亡发生的启动因素及发生过程中确切的机制尚未清楚。笔者利用T UNEL染色可以看到,在AAA组织的中膜SMC上,阳性染色的细胞占了大多数,而正常主动脉组织中凋亡的细胞比例很小。进一步证明动脉SMC的凋亡导致中膜SMC密度降低,从而诱导AAA发病。
自噬是凋亡之外的程序性细胞死亡方式,在进化过程中高度保守。细胞自噬参与了绝大多数长半衰期蛋白质的降解[4]。近年来越来越多的研究提示相同诱导因素在不同细胞中可分别诱发自噬或凋亡。Terman等[5]通过研究发现心肌细胞自噬在心肌病中发挥一定作用。最新研究发现[6],在动脉粥样硬化中存在着血管SMC自噬,并且SMC自噬受到肿瘤坏死因子-α和胰岛素样生长因子-1的调节。LC3是哺乳动物细胞中酵母Atg8基因的同源物,定位于前自噬泡和自噬泡膜表面,是细胞自噬泡膜的通用标志物,LC3修饰过程对自噬泡的形成必不可少[7]。本研究通过免疫组化发现LC3在AAA组织中膜SMC中呈阳性表达。说明AAA中存在着SMC自噬,导致中膜SMC的减少。

图2 正常主动脉组织(A)和 AAA组织(B,黑箭头)LC3免疫组化染色(×100)

表4 Beclin1、Atg4b、Bnip3、Vps34在正常主动脉和AAA组织中相对表达量
参与酵母自噬的相关基因Atg6在哺乳动物则称为Beclin 1。有研究指出,Beclin 1-/-小鼠细胞自噬缺陷,凋亡正常,说明Beclin 1是自噬的调控基因[8]。Atg4b在自噬过程中起着较为重要的作用,Yoshimura等[9]用 RNA干扰技术证明,Atg4b与LC3密切相关。Bnip3属于BH3-only亚家族,是HIF的下游应答基因之一。Bnip3可促进线粒体自噬[10]。研究发现,在转染了Bnip3的细胞中很早就出现了等离子膜通透孔、线粒体损害、过多的细胞质空泡和线粒体自噬现象[11]。Bnip3在缺氧和营养缺乏时促进细胞自噬的能力会有所增强[12]。最新研究发现,转录因子FoxO3引起了骨骼肌细胞的自噬过程。FoxO3控制着与自噬相关的 Bnip3和LC3基因转录,而Bnip3能调节FoxO3在自噬过程中所起的作用[13]。自噬小泡在形成过程中有3型PI3K复合体参与,这一复合体包括Vps34,Beclin 1和紫外线抵抗相关肿瘤抑制基因[14]。Ambra1可以通过与Beclin 1作用从而激活Vps34来刺激自噬过程。为此,本研究通过 RT-PCR发现,Beclin1、Atg4b、Bnip3、Vps34等自噬相关基因在AAA组织中表达水平高于正常主动脉组织,从而证实SMC自噬参与AAA发病过程。
另外,应认识到以下两个问题:(1)AAA病理过程中SMC凋亡和自噬都导致SMC减少,因此对它们的比较研究可能比单一因素的研究更有意义。(2)应用AAA动物模型利于对主动脉SMC形态功能进行动态观测,从而进一步研究 AAA发病的原因。
综上所述,本研究发现AAA的发病与SMC凋亡、自噬有密切关系。对于SMC凋亡和自噬这两种细胞死亡方式的研究能为AAA发病提供理论依据。因此,应用药物或基因治疗的手段抑制SMC凋亡和自噬,并阻断相关基因的表达,将是早期AAA治疗中值得深入研究的方案。
[1] Cailhier JF,Sirois I,Laplante P,et al.Caspase-3 activation triggers extracellular cathepsin L release and endorepellin proteolysis[J].J Biol Chem,2008,283(40):27220-27229.
[2] Rowe VL,Stevens SL,Reddick TT,et al.Vascular smooth muscle cell apoptosisin aneurysmal,occlusive,and normal human aortas[J].J Vasc Surg,2000,31(3):567-576.
[3] Guo F,Li Z,Song L,et al.Increased apoptosis and cysteinyl aspartate specific protease-3 gene expression in human intracranial aneurysm[J].J Clin Neurosci,2007,14(6):550-555.
[4] Klionsky DJ,Emr SD.Autophagy as a regulated pathway of cellular degradation[J].Science,2000,290(5497):1717-1721.
[5] Terman A,Brunk UT.Autophagy in cardiac myocyte homeostasis,aging,and pathology[J].Cardiovasc Res,2005,68(3):355-365.
[6] Jia G,Cheng G,Gangahar DM,et al.Insulin-like growth factor-1 and TNF-alpha regulate autophagy through c-jun N-terminal kinase and Akt pathways in human atherosclerotic vascular smooth cells[J].Immunol Cell Biol,2006,84(5):448-454.
[7] Tanida I,Ueno T,Kominami E.LC3 conjugation system in mammalian autophagy[J].Int J Biochem Cell Biol,2004,36(12):2503-2518.
[8] Yue Z,Jin S,Yang C,et al.Beclin 1,an autophagy gene essential for early embryonic development,is a haploinsufficient tumor suppressor[J].Proc Natl Acad Sci USA,2003,100(25):15077-15082.
[9] Yoshimura K,Shibata M,Koike M ,et al.Effects of RNA interference of Atg4B on the limited proteolysis of LC3 in PC12 cells and expression of Atg4B in various rat tissues[J].Autophagy,2006,2(3):200-208.
[10] Zhang H,Bosch M arce M,Shimoda LA,et al.Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia[J].J Biol Chem,2008,283(16):10892-10903.
[11] Cleven AH,Wouters BG,Schutte B,et al.Poorer outcome in stromal HIF-2 alpha-and CA9-positive colorectal adenocarcinomas is associated with wildtype TP53 but not with BNIP3 promoter hypermethy-lation or apoptosis[J].Br J Cancer,2008,99(5):727-733.
[12] Tracy K,Dibling BC,Spike BT,et al.BNIP3 is an RB/E2F target gene required for hypoxia-induced autophagy[J].MolCellBiol, 2007, 27(17):6229-6242.
[13] M ammucari C,Milan G,Romanello V,et al.FoxO3 controls autophagy in skeletal musclein vivo[J].Cell Metab,2007,6(6):458-471.
[14] 张志才,邵增务.自噬分子机制的研究进展[J].现代生物医学进展,2008,8(1):177-179.
Apoptosis and autophagy of vascular smooth muscle cells of abdominal aortic aneurysm
DU Yahao,Z HENGY uehong,T IAN Cui,et al Insititute of Basic Medicine,Chinese Academy of Medical Sciences,Beijing100730,China
Objective To investigate the relationship of apoptosis and autophagy of vascular smooth muscle cells(SMC)with the pathogenesis of abdominal aortic aneurysm(AAA).MethodsInsituterminal transferase-mediated dUTP nick end-labeling(TUNEL)was used to detect the apoptosis of SMC of AAA and human normal aorta.The expression of LC3 was measured by immunohistochemistry.RNA extraction from the tissue of AAA and human normal aorta was performed.The mRNA levels of autophagy-related genes Beclin1,Atg4b,Bnip3,and Vps34 are tested by RT-PCR.Results The number of TUNEL-positive SMC in AAA was higher than that in normal aorta(P<0.05).The expression level of LC3 protein was significantly increased in AAA compared with that in normal aorta(P<0.05).The mRNA expression levels of Beclin1,Atg4b,Bnip3 and Vps34 were markedly up-regulated in AAA compared with that in normal aorta(P<0.05).Conclusion The apoptosis and autophagy of vascular SMC play an important role in the pathogenesis of AAA.
aortic aneurysm,abdominal;apoptosis;autophagy;muscle,smooth,vascular
R363.2
A
1671-5403(2010)03-05
100730北京市,中国医学科学院基础医学研究所(杜亚豪、田翠、李汇华);100730北京市,北京协和医院血管外科(郑月宏)
李汇华 ,Tel:010-65296494,E-mail:hhli1935@yahoo.cn
2010-02-01;
2010-05-05)
