蓝莓多糖的优化提取及抗氧化性研究
2010-08-27孟宪军孙希云朱金艳李斌高哓旭
孟宪军, 孙希云, 朱金艳, 李斌, 高哓旭
(沈阳农业大学食品学院,辽宁沈阳 110161)
蓝莓多糖的优化提取及抗氧化性研究
孟宪军, 孙希云, 朱金艳, 李斌, 高哓旭
(沈阳农业大学食品学院,辽宁沈阳 110161)
研究了将纤维素酶法和超声波辅助法用于从提取花色苷后的蓝莓残渣中提取多糖的工艺,以达到优化工艺的目的;同时将粗多糖脱色脱蛋白后经二乙氨基乙基纤维素DE52柱层析纯化得到的精多糖SPⅠ进行抗氧化试验,检测其抗氧化性。通过正交试验设计,确定了最佳酶解提取工艺。结果为:酶法:酶解时间为100 min,酶解温度为40℃,酶添加量为0.6%,料水比为1 g∶60 mL,条件最佳,蓝莓多糖的得率为2.319%。超声波辅助法:提取时间为40 min,提取温度为50℃,超声波功率为80 W,料水比为1 g∶60 mL,条件最佳蓝莓多糖的得率为2.335%。工艺比传统水提法简单,得率高;抗氧化试验显示SPⅠ具有较强的抗氧化性质。
蓝莓;多糖;提取;纤维素酶;超声波;抗氧化性
蓝莓(blueberry),又称越橘、蓝浆果,属杜鹃花科越橘属多年生落叶或常绿灌木。蓝莓是一种耐寒性极强的野生植物,可抵御零下-50℃的严寒,原产于北美、苏格兰和俄罗斯,是一种森林中天然生长的野生资源[1]。蓝莓因具有独特风味及营养保健功能,如抗氧化防衰老、改善记忆和视力、消炎抗菌、治疗心血管疾病等,被联合国粮农组织列为人类五大健康食品之一[2]。在我国古代医学书籍中,有很多关于越橘入药的记载,而现在欧美国家对蓝莓的营养保健功能也进行了大量研究,其含有花色苷,SOD等都得到广泛的研究[3],目前国际市场上开发利用的蓝莓保健品主要就是花色苷的提取物,在进行大量提取后会产生部分副产物,如不能对这部分加以充分合理利用,势必造成蓝莓果的大量浪费,因此对于这部分副产物的综合利用以及其中活性成分的研究是很有意义的。目前,蓝莓中多糖研究国内外尚未见报道,鉴于此,作者探索纤维素酶法和超声波辅助法用于从脱去花色苷的蓝莓残渣中提取多糖的工艺,提高多糖得率,同时验证蓝莓多糖是否有功能性质,为蓝莓多糖的生产和应用提供一定的理论依据。
1 材料与方法
1.1 主要材料与试剂
蓝莓残渣:沈阳农业大学食品学院蓝莓脱花色苷后所得;纤维素酶(酶活性≥15 000 u/g,生化级):国药集团化学试剂有限公司产品;二乙氨基乙基纤维素DE52:中国医药上海化学试剂公司产品;乙酸钾:国药集团化学试剂有限公司产品;聚酰胺:国药集团化学试剂有限公司产品;邻苯三酚:国药集团化学试剂有限公司产品;三羟甲基氨基甲烷:国药集团化学试剂有限公司产品;邻氮二菲:国药集团化学试剂有限公司产品;抗坏血酸:国药集团化学试剂有限公司产品;葡萄糖,浓硫酸,盐酸,磷酸,苯酚,乙醇,EDTA,丙酮,均为分析纯试剂。
1.2 主要仪器与设备
7200型可见分光光度计,尤尼柯(上海)有限公司产品;电热恒温水浴锅,常州国华电器有限公司产品;RE-52型旋转蒸发仪:上海博通经贸有限公司产品;SHZ-IIIB型循环水真空泵:上海华琦科学仪器有限公司产品;TDL-5000B型离心机:上海安亭科学仪器厂产品;DZF6050真空干燥箱:上海一恒科技有限公司产品;粉碎机:上海世邦有限公司产品;数显PH计:上海精密科学仪器有限公司产品;SBS-100数控计滴自动部分收集器:上海青浦沪西仪器厂产品;HL-2恒流泵:上海青浦沪西仪器厂产品;超声波反应器(KQ-250A型):昆山市超声仪器有限公司产品。
1.3 多糖提取
1.3.1 多糖含量测定 采用硫酸—苯酚法。准确称取105℃烘干至恒重的标准葡萄糖25.0 mg于250 mL容量瓶中,加水至刻度并摇匀,分别取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL葡萄糖标准溶液,分别加水补至1.0 mL,然后加入质量分数5%苯酚1.6 mL及浓硫酸7.0 mL,充分摇匀,室温放置25 min以后于490 nm测吸光度,以蒸馏水按同样显色操作为空白,以多糖质量浓度(x)为横坐标,吸光度(y)为纵坐标,绘制标准曲线,计算出回归方程。
精确吸取多糖样品溶液1.0 mL,加入质量分数5%苯酚1.6 mL及浓硫酸7.0 mL,同标准曲线之操作,测定吸光度值。将其代入回归方程,即可得多糖的含量。
样品多糖得率(%)=多糖质量∕样品质量× 100%
1.3.2 从蓝莓果与蓝莓残渣中提取多糖的得率比较 分别取10 g蓝莓果和蓝莓残渣粉,加入600 mL蒸馏水,90℃水浴4 h,醇沉(醇体积分数达80%),离心去沉淀,经丙酮,乙醇洗涤抽滤,真空干燥得粗多糖,溶解于水中的多糖含量。
1.3.3 酶法优化蓝莓多糖的提取
1)提取工艺 蓝莓残渣→粉粹→加水60倍搅拌均匀→将p H值调至7.0→加入纤维素酶→100℃灭酶15 min→水浸1 h→3 000 r/min离心10 min→醇沉(醇体积分数达80%)→3 000 r/min离心10 min→丙酮,乙醇洗涤抽滤→真空干燥得粗多糖。
2)正交试验 选择纤维素酶对多糖提取有显著影响的三项因素,做L9(33)正交试验,得出酶法优化多糖提取的最佳工艺条件。
1.3.4 超声波辅助提取蓝莓多糖
1)提取工艺 称取干燥至恒重的一定条件下粉碎的蓝莓10 g,溶于60 mL蒸馏水中,不同超声功率、超声时间,超声温度处理,并不断搅拌,取出后再以3 000 r/min离心10 min,弃去下层不溶物,取上清液,加入无水乙醇至乙醇体积分数为80%,冰箱中静置过夜,取出,以3 000 r/min离心10 min,取沉淀,先后用丙酮、乙醚、乙醇冲洗抽滤,真空干燥得粗多糖。
2)正交试验 选取超声波对多糖提取有显著影响的三项因素,做L9(33)正交试验,因素水平范围如下:时间(A)分别为40、60、80 min;温度(B)分别为:40、50、60℃;时间(C)分别为:40、60、80 w。得出超声波辅助提取多糖的最佳工艺条件。
1.4 多糖分离纯化
采用聚酰胺脱色法,将一定量质量浓度为1 000 mg/L、p H值为7的多糖溶液加入到已处理好聚酰胺中,震荡10 min,静置过夜,取上清液;向上清液中加入乙酸钾至乙酸钾浓度为2 mol/L,4℃下静置过夜,3 000 r/min离心10 min,取沉淀,真空干燥后溶于一定量的水中,蒸馏水透析过夜,真空干燥;将所得多糖配成5 mg/mL的溶液,过二乙氨基乙基纤维素DE52柱,采用0.3 mol/L的NaCL洗脱,测定得到两组多糖SPⅠ,SPⅡ,前者较多,后者较少。
1.5 多糖抗氧化测定
1.5.1 消除羟自由基能力的测定 利用Fenton反应原理。取1 mL 0.75 mol/L邻二氮菲溶液于试管中依次加入2 mL 0.2 mol/L磷酸盐缓冲液p H 7.4和1 mL蒸馏水,充分混合均匀加入1 mL 0.75 mol/L FeSO4混合后,加入1 mL 0.01 mol/L双氧水,置于37℃水浴中60 min后,536 nm测A损。未损伤管以1 mL蒸馏水代替1 mL 0.01 mol/L,测A未损,样品管以1 mL样品代替损伤管中1 mL蒸馏水,测A样。1.5.2 消除超氧自由基能力测定 利用邻苯三酚自氧化原理。4.5 mL 0.1 moL/lTris-HCl缓冲液(p H 8.2),依次加入1.00 mL 0.5mol/L EDTA溶液,1 mL样品溶液,2.4 mL蒸馏水混匀于25℃水浴中反应10 min,再加入100μL 9 mmol/L邻苯三酚,加入时计时,混匀,准确反应60 min,加入50μL 12 mol/L HCl溶液终止反应,325 nm处测定吸光度AS,空白以1 mL蒸馏水代替1 mL样品,测AC。
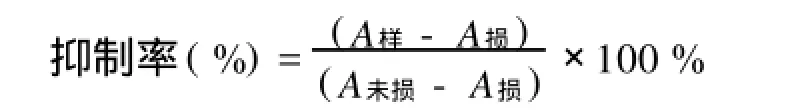

2 结果与分析
2.1 苯酚—的硫酸法测定多糖含量标准曲线
按照本实验方法,所得标准曲线见图1。回归方程为:y=6.836 9x+0.089 7,r=0.999 0。
2.2 蓝莓果与蓝莓残渣中提取多糖的得率比较
实验测得蓝莓多糖得率得率为2.332%,蓝莓残渣多糖得率为2.108%。除去花色苷的蓝莓残渣多糖含量与蓝莓果中的多糖含量相差不大,蓝莓中90%的多糖都残留在残渣中。重要是因为提取花色苷的工艺对多糖的溶解并不算高,使多糖遗留在残渣中。所以从蓝莓残渣中提取多糖可以达到资源再利用的效果,减少资源浪费。

图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
2.3 酶解条件对蓝莓多糖得率的影响
根据以上单因素试验结果,确定因素水平范围如表1,正交试验的结果如表2,方差分析如表3。

表1 蓝莓多糖提取试验因素水平Tab.1 Level and factor on extraction test of blueberry polysaccharides
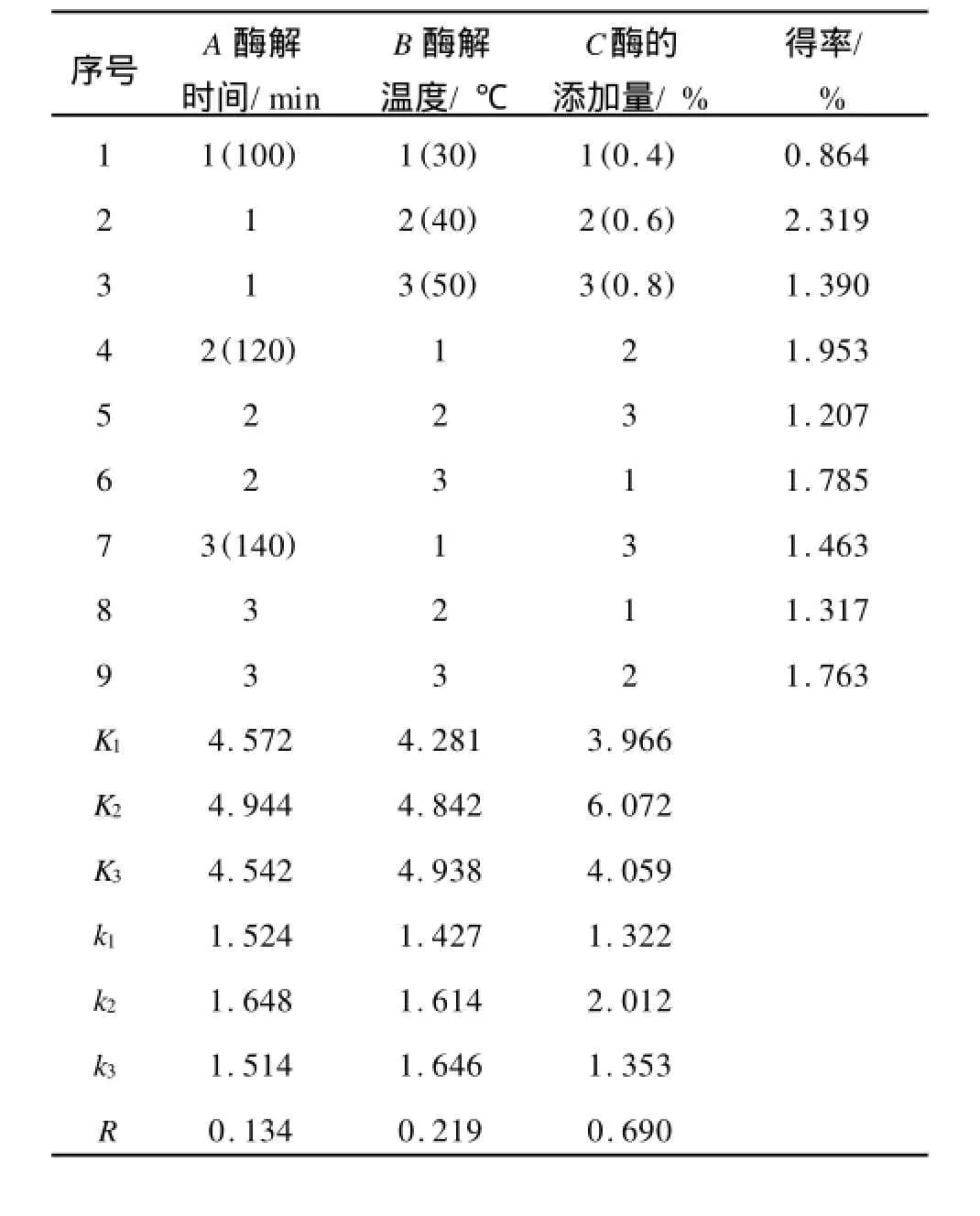
表2 正交试验方案及结果分析Tab.2 The schemes and results analysis of orthogonal design
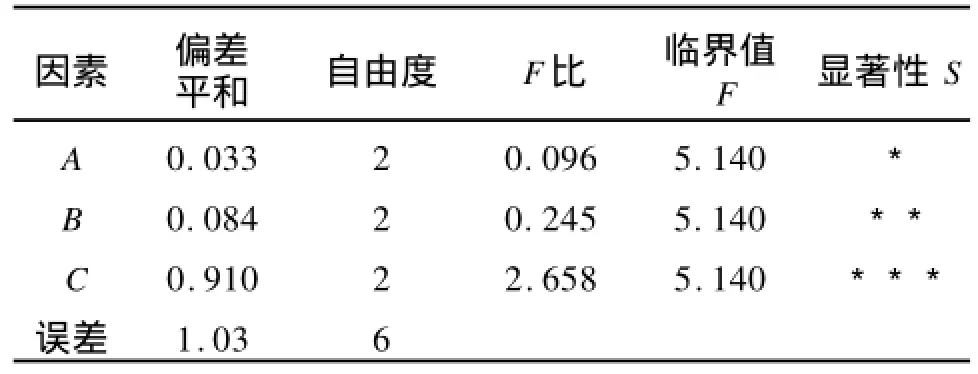
表3 蓝莓多糖得率方差分析Tab.3 V arianceanalysis for yield of blueberry polysaccharides
从正交试验和方差分析可以看出:R酶的添加量> R酶解温度>R酶解时间,说明酶的添加量(C)对多糖得率的影响最为显著,其次是酶解温度(B)和酶解时间(A)。根据正交试验得到的最佳工艺条件为A1B2C2:即酶解时间为100 min,酶解温度为40℃,酶添加量为0.6%,蓝莓多糖的得率为2.319%。
2.4 超声波辅助提取蓝莓多糖
根据以上单因素试验结果,确定因素水平范围,正交试验的结果如表4,方差分析如表5。
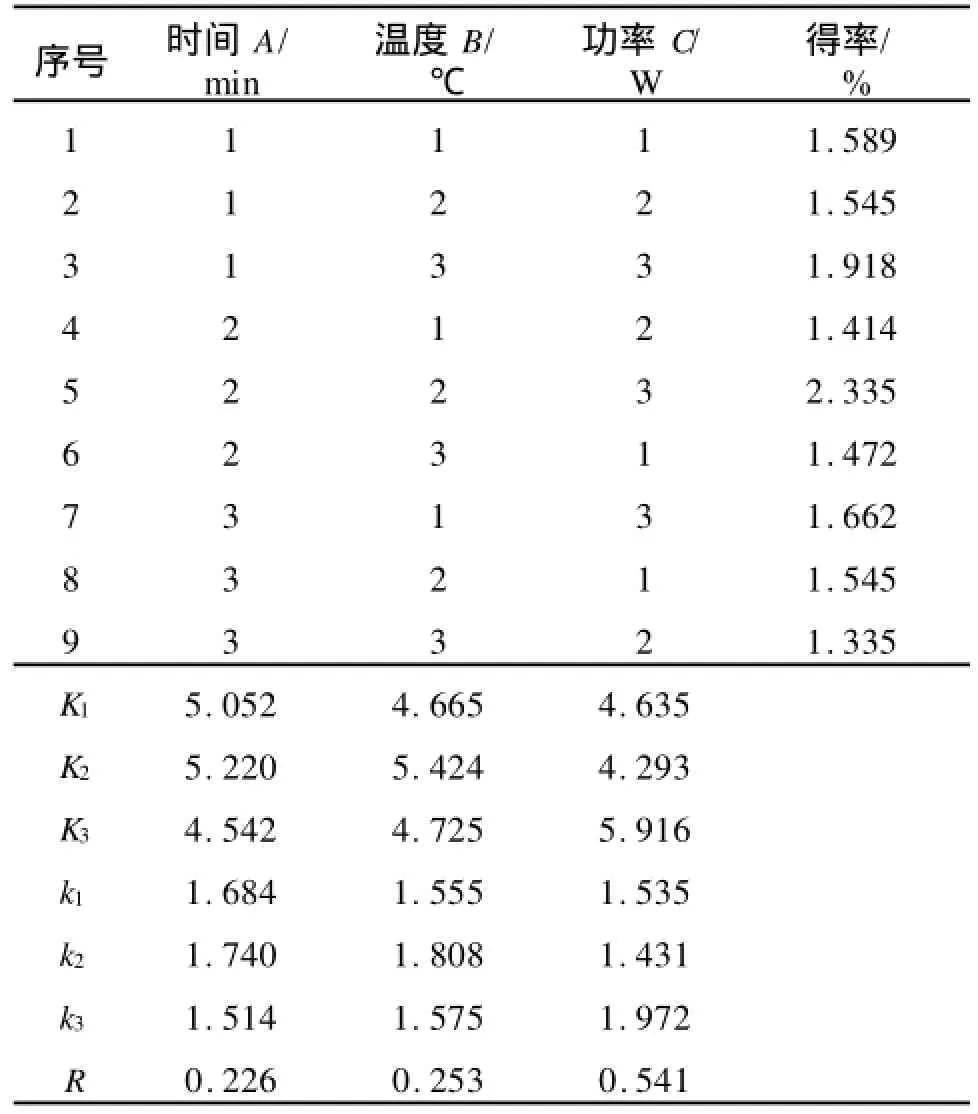
表4 正交试验方案及结果分析Tab.4 The schemes and results analysis of orthogonal design
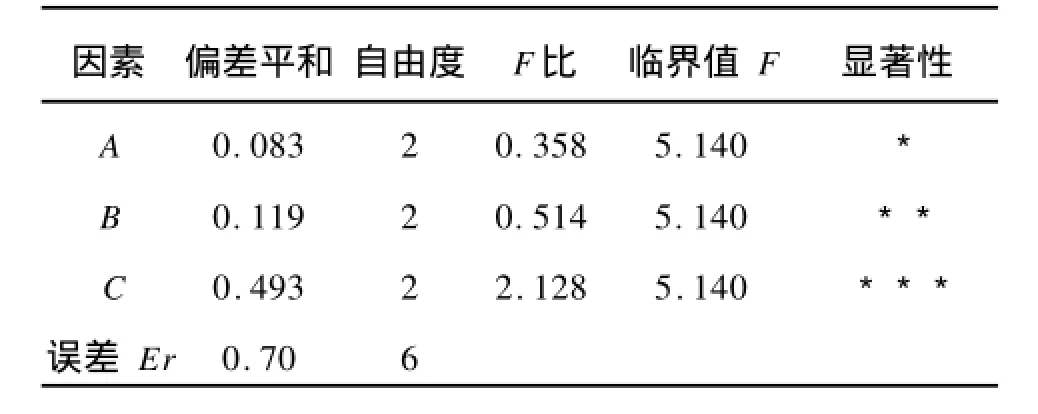
表5 蓝莓多糖得率方差分析Tab.5 V arianceanalysis for yield of blueberry polysaccharides
从正交试验和方差分析可以看出:功率>温度>时间,说明超声波功率(C)对多糖得率的影响最为显著,其次是提取温度(B)和提取时间(A)。根据正交试验得到的最佳工艺条件为A2B2C3:即提取时间为40 min,提取温度为50℃,超声波功率为80 W,蓝莓多糖的得率为2.335%。
2.5 抗氧化性的测定
2.5.1 消除羟自由基能力的测定 由图2可以看出,SPⅠ的抑制率在0.2~1.0 mg/L质量浓度范围内,
随质量浓度的上升而不断增强,在低质量浓度范围内它与VC的抗氧化能力接近,质量浓度大于0.8 mg/ mL以后抑制率将明显低于VC,这说明SPⅠ在低质量浓度范围内就具有较强的消除羟基自由基的能力。
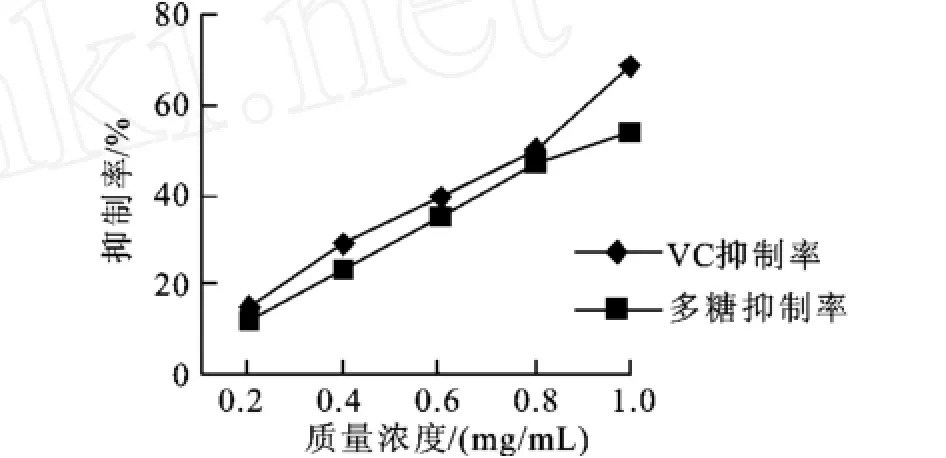
图2 SPⅠ和VC清除羟自由基的能力的比较Fig.2 The comparison of scavenging hydroxyl radicals between SPⅠand VC
2.5.2 消除超氧自由基能力的测定 由图4可知,在邻苯三酚自氧化反应体系中,SPⅠ具有消除超氧自由基的能力,并随质量浓度的上升,消除能力增强;与VC的抑制率略低,质量浓度越高,两者的抑制率越接近。说明SPⅠ同样具有较强的消除超氧自由基的能力。
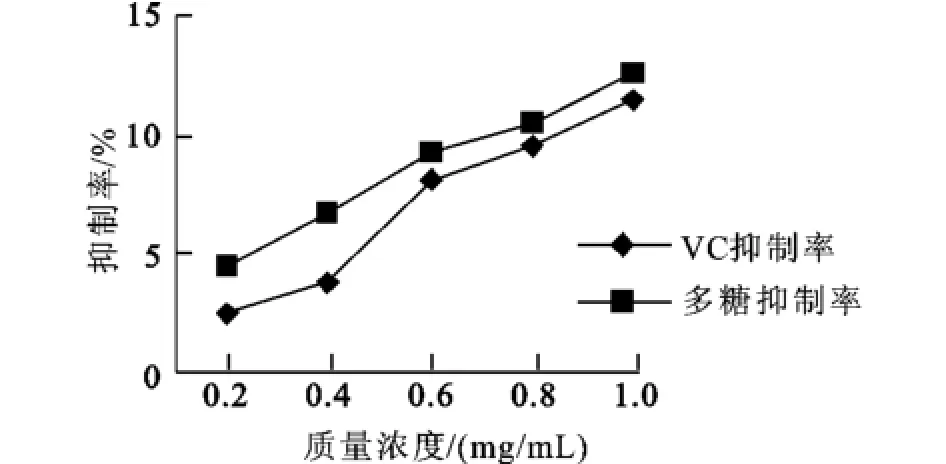
图3 SPⅠ和VC清除超氧自由基的能力的比较Fig.3 The comparison of scavenging superoxide anion between SPⅠand VC
3 讨 论
1)在提取蓝莓粗多糖时,发现酶法和超声波法辅助提取多糖比传统的水浸法提取多糖得率都要高,并且工艺简单,能耗比较低,是可以考虑的优化工艺。需要探索的地方在于,酶法和超声波法相结合,是否可以更好地提高蓝莓多糖的提取率,设定相关联的条件,是两者有机结合,有待进一步研究。
2)作者就蓝莓多糖SPⅠ清除自由基能力进行测定,结果表明其具有一定得清除能力,需要进一步研究的是对经Sephacryl S-300柱层析所得的精多糖,测定其抗氧化能力是否有提高,抗肿瘤,抗病毒能力如何,也可对其进行化学修饰,引入其他官能团,测定是否提高其活性,以充分利用蓝莓多糖资源。
4 结 语
1)除去花色苷的蓝莓残渣多糖含量与蓝莓果中的多糖含量相差不大,所以从蓝莓残渣中提取多糖可以达到资源再利用的效果,减少资源浪费。
2)酶法提取多糖单向试验和正交试验的分析结果可以看出,酶的添加量对多糖得率的影响最为显著,其次是酶解温度和酶解时间,最佳酶解时间为100 min,酶解温度为40℃,酶添加量为0.6%,蓝莓多糖的得率为2.319%,此水浸提取法相比,温度,时间都减少了很多,使得提取工艺简洁,能量消耗减少,并且多糖得率有所提高,是一种良好的提取工艺。
3)超声波提取多糖单向试验和正交试验的分析结果可以看出,超声波功率(C)对多糖得率的影响最为显著,其次是提取温度(B)和提取时间(A)。根据正交试验得到的最佳工艺条件为A2B2C3:即提取时间为40 min,提取温度为50℃,超声波功率为80 W,蓝莓多糖的得率为2.335%,可以看出超声波对蓝莓多糖提取的影响比酶法更显著,并且在资源和能耗方面也很简单,适合用蓝莓多糖的提取。
4)通过清除自由基试验可以看出,SPⅠ具有一定的抗氧化活性,这为蓝莓多糖生物活性的研究进一步研究提供了借鉴意义。
[1]李颖畅,孟宪军.蓝莓中花色苷的提取工艺[J].食品科技,2008,(20):74-76.
LI Ying-chang,MENG Xian-jun.Study on the processing of the extraction of anthocyanin from the fruit of blueberry[J]. Food Science and Technology,2008,(20):74-76.(in Chinese)
[2]聂飞,韦吉美,文光琴.蓝莓的经济价值以及其在我国产业化发展中的前景探讨[J].贵州农业科学.2007,35(1):117-119.
Nie Fei,WEI Ji-mei,WEN Guang-qin.Discussion on economical values of vaccinium ssp.and its industrial development prospect in China[J].Guizhou Agricultural Sciences,2007,35(1):117-119.
[3]李颖畅,孟宪军,张琦,等.蓝莓中主要物质含量及处理方式对花色苷的影响[J].食品工业科技.2008,29(05):163-164.
LI Ying-chang,MENG Xian-jun,Zhang Qi,et al.Essential substance content of different blueberry and the effect of treatment on the blueberry anthocyanins[J].Science and Technology of Food Industry,2008,29(05):163-164.
[4]牛广财.马齿苋多糖及黄酮类化合物的研究[D].沈阳市:沈阳农业大学,2005.
[5]丁利君,吴倩萍.黄芪多糖的提取及其对自由基的清除作用[J].食品与机械.2003(4):7-9.
DINGLi-jun,WU Qian-ping.Extraction of polysaccharide from astragalus membranaceus and effects of scavenging free radicals[J].Food&Machinery,2003(4):7-9.
[6]周国华.黑木耳多糖酶法提取条件的研究[J].食品研究与开发,2005,26(3):89-91.
ZHOU Guo-hua.Studies on the extractive conditions of Auricularia Auricular polysaccharide in enzymatic methods[J]. Food Research and Development,2005,26(3):89-91.
[7]刘利萍,钟引飞.海带多糖的超声波提取及对自由基清除作用研究[J].绍兴文理学院学报.2005.29(7):49-51.
LIU Li-ping,ZHONG Yin-fei.Supersonic Extraction of laminaria and scavenging action to free radical[J].Journal of Shaoxinc University,2005.29(7):49-51.
[8]Yuan Z,He P,Takeuchi H,et al.Ameliorating effects of water-soluble polysaccharides from woody ear(Auricularia auricula—judae Que1)in genetically diabetic KK—Ay mice[J].J Nutr Sci Vitaminol(Tokyo),1998,44(6):829-840.
[9]Guihao Yin,Yuli Dang.Optimization of extraction technology of the Lycium barbarum polysaccharides by Box–Behnken statistical design[J].Carbohydrate Polymers,2008,74(3):603-610.
[10]Wentao Xu,Fangfang Zhang,YunBo Luo.Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J].Carbohydrate Research,2009,344(2):217-222.
[11]Cui J,Chisti Y.Polysaccharopeptides of Coriolus versicolor:physiological activity,uses,and production[J].Biotechnol Adv, 2003,21(2):109.
[12]Yongxu Sun,Jicheng Liu.Purification,structure and immunobiological activity of a water-soluble polysaccharide from the fruiting body of Pleurotus ostreatus[J].Bioresource Technology,2009,100(2):983-986.
[13]Filomena Freitas,Vitor D.Alves Characterization of an extracellular polysaccharide produced by a Pseudomonas strain grown on glycerol[J].Bioresource Technology,2009,100(2):859-865.
[14]You Lv,Xingbin Yang,Yan Zhao.Separation and quantification of component monosaccharides of the tea polysaccharides from Gynostemma pentaphyllum by HPLC with indirect UV detection[J].Food Chemistry,2009,11(3):742-746.
(责任编辑:朱明)
Extraction and Antioxidant Capability of Blueberry Polysaccharides
MEN G Xian-jun, SUN Xi-yun, ZHU Jin-yan, LI Bin, GAO Xiao-xun
(Shenyang Agriculture University,College of Food,Shenyang 110161,China)
Theextractiontechnologyofpolysaccharidesfromblueberryafterextracting anthocyanin by cellulase and ultrasonic was studied in this manuscript.Also,decolorizate rough polysccharides and remove protein,then through column chromatography,finally test the antioxidant capability of the refined polysccharides SP.the optimum conditions for process was determined by Orthogonal test experiment and listed as follows:time 100 min,temperature 40℃and enzyme additive 0.6%,the extraction percent 2.319%.In the extraction process by ultrasonic,the optimum conditions were:the extraction time 40min,temperature 50℃,power 80 W,the extraction percent 2.335%.Compared with that of the traditional extraction process by water,the process suggested in this manuscript has been proven easier manipulation and get higher extraction yield.Furthermore,the results also strong demonstrated that SPⅠhas stronger antioxidant activity.
blueberry,ploysaccharides,exraction,cellulase,ultrasonic,antioxidant capability
Q 949.91
:A
1673-1689(2010)01-0056-05
2009-03-10
辽宁省科技厅项目(1102-01082609001)。
孟宪军(1960-),男,内蒙古赤峰人,教授,博士生导师,主要从事果蔬加工的教学与科研。Email: mengxjsy@126.com
