S-烯丙基别半胱氨酸对缺血 /再灌注大鼠神经细胞凋亡的影响
2010-08-25刘国平秦海军
张 峰, 刘国平, 申 捷, 秦海军
脑缺血是危害人类的重大疾病之一,在发达国家,致死率第三,致残率第一[1],我国致死率上升至第一、二位[2]。目前除溶栓外尚无有效的治疗方法。但是由于时间窗的限制,溶栓仅适用于小部分患者。因此寻找能够有效缓解脑缺血损伤的药物非常必要。脑缺血的过程中,凋亡是非常关键的环节,是迟发性神经细胞死亡的主要方式。线粒体功能的损伤在凋亡的过程中起着很重要的作用,目前认为,脑缺血后,缺氧缺糖,导致线粒体膜通透性的改变,引起大量离子内流,导致膜电位的丧失,同时 AIF和 Cytc释放至细胞质中,引发凋亡[3]。S-烯丙基别半胱氨酸(SAC)具有抗炎、抗氧化等广泛药理作用[4],已有报道,它有较好的抗脑缺血的作用,具有抗氧化和抗凋亡的作用[5]。本实验主要观察其通过线粒体途径的抗凋亡作用。
1 材料和方法
1.1 药品和试剂 SAC购自 Sigma公司,TUNNEL试剂盒购自海门碧云天生物试剂公司,AIF、Cytc以及 GAPDH一抗,HRP标记二抗均购自Abacm公司。
1.2 动物分组及给药 30只雄性 SPF级别成年 SD大鼠,体重 220~250g,由复旦医学院实验动物中心提供。动物随机分成 3组:假手术组(sham)、缺血 /再灌注组 (I/R)、SAC100组 (100mg/kg,ip)。缺血后 30min给药。
1.3 模型制备 参照 Longa等的线栓改良法制备大鼠右侧大脑MCAO局灶性脑缺血模型。大鼠用 10%水合氯醛(350mg/kg)腹腔注射麻醉,仰卧固定,颈部正中切口,分离并暴露右侧颈总动脉及颈内外动脉,结扎右侧颈总动脉及颈外动脉根部,由颈总动脉近分叉处剪一小口插入尼龙线(长 50mm,直径0.23mm在 18mm处作标记),插入长度约(18±0.5)mm感到有轻微阻力时停止,扎紧并固定线栓,缝合皮肤,阻断血流 2h后,拔掉线栓实现再灌注。假手术组除不插线栓外,其余步骤同上,再灌注时间24h后处死,取皮质备用。
1.4 梗死体积测定 大鼠局灶性脑缺血后24h断头取脑,将脑置-20℃冰箱内 20min,去除嗅球、小脑后,沿冠状平面每片约 3mm切 8刀片。然后迅速将脑片置于 5ml浓度为 1%的红四氮唑溶液中,避光 37℃,温孵 30min,其间每隔 7~8min翻动 1次,经染色后,正常脑组织呈玫瑰红色,而梗死组织呈白色,照相用 imagetool3软件计算缺血区体积。
1.5 AIF和 Cytc蛋白表达 从超低温冰箱中取出冻存的皮质,经 RIPA液匀浆裂解后,12000r/mim离心 20min,弃沉淀,收集上清液用 Bradford法测定总蛋白含量.加样蛋白含量 50μg经 10%SDSPAGE电泳分离,4℃条件下经 3~4h将蛋白电转移PVDF膜,置膜于含 50g/L脱脂奶粉中(TBST缓冲液稀释)封闭 1h,分别加入特异性兔抗鼠 AIF、Cytc Ab(1∶1000稀释)、GAPDH抗体以及辣根过氧化物酶标记的兔抗鼠多克隆抗体(1∶8000稀释)进行免疫反应,以增强化学发光显色系统显色,ECL超敏曝光,以 GAPDH为内参。Image-pro5.0软件分析灰度值。
1.6 线粒体膜电位检测 rhodamine 123本身具有荧光,进入细胞后,可以选择性地富集在线粒体上,线粒体内 rhodamine 123的量随膜电位的变化而变化。通过测定线粒体 rhodamine 123荧光强度,反映膜电位及其变化。新鲜制备线粒体,各测定管先加入膜电位反应缓冲液 (蔗糖 15mmol/L,MgCl25mmol/L,琥珀酸钠 5mmol/L,K2HPO4,Hepes20mmol/L,pH7.4)2.5ml,26μmol/L 40μl,然后加入 20μl线粒体蛋白混悬液,室温下 10min,激发波长 503nm,发射波长 527nm,荧光酶标仪检测,记录数值,以荧光值的改变代表膜电位的改变。
1.7 TUNEL染色 将大鼠麻醉,开胸经升主动脉插管,依次灌注生理盐水和 10g/L的甲醛各200ml,断头取脑,取缺血侧前 1/2皮质置于同一甲醛溶液中固定 3d,石蜡包埋。面连续冠状切片,片厚 4μm。采用碧云天公司凋亡检测试剂盒染色。光镜(400×)下观察凋亡细胞数(个/高倍镜下)。任意选取 3个高倍镜视野,取平均值。
2 结 果
2.1 SAC对梗死体积的影响 模型组梗死体积为 25.33%±2.1%,SAC治疗组能够显著降低MCAO引起的梗死(16.31%±1.8%,P)<0.01)(见图1)。
2.2 SAC对 AIF和 Cytc蛋白表达的影响 假手术组大鼠皮质均表达一定量的 AIF(0.32±0.02)、Cytc(0.30±0.01)蛋白,模型组大鼠表达量较正常组显著增加(0.51±0.01,P<0.01;0.54±0.05,p<0.01),SAC治疗组能够显著降低 MCAO引起的 AIF和 Cytc表达增高(0.35±0.03,P<0.01;0.33±0.04,P<0.01)(见图2)。
2.3 SAC对线粒体膜电位的影响 SAC能够显著降低缺血再灌注所引起的 OD值下降,表明SAC能够提高缺血再灌注引起的线粒体膜电位下降(见图3)。
2.4 TUNNEL染色 假手术组仅有少量凋亡阳性细胞。缺血再灌注组出现极强的凋亡信号。SAC能够显著降低凋亡信号。随机选取 3个高倍境视野(×200),计数 TUNEL染色阳性细胞数求平均值(见图4)。
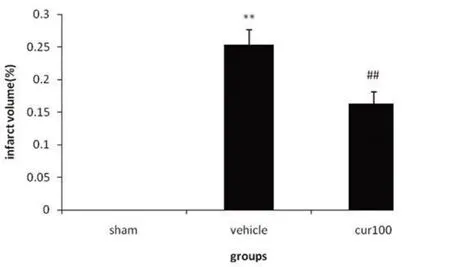
图1 SAC对脑缺血再灌注引起的梗死体积的影响
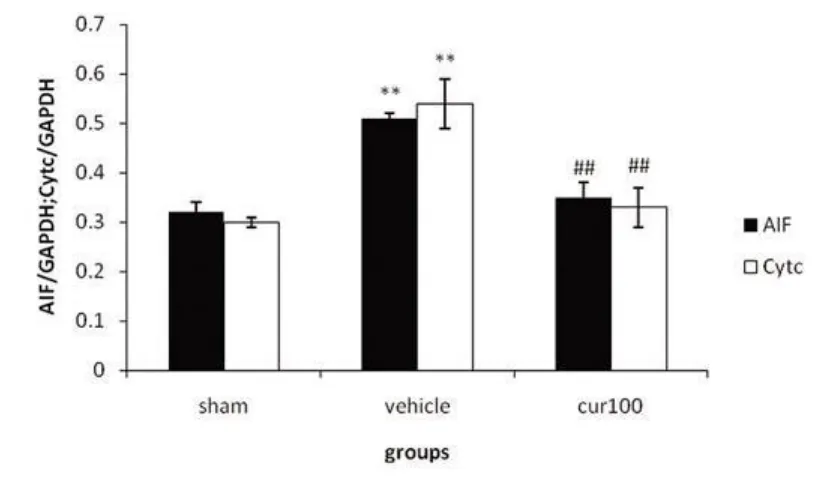
图2 SAC对 AIF和 Cytc蛋白表达的作用
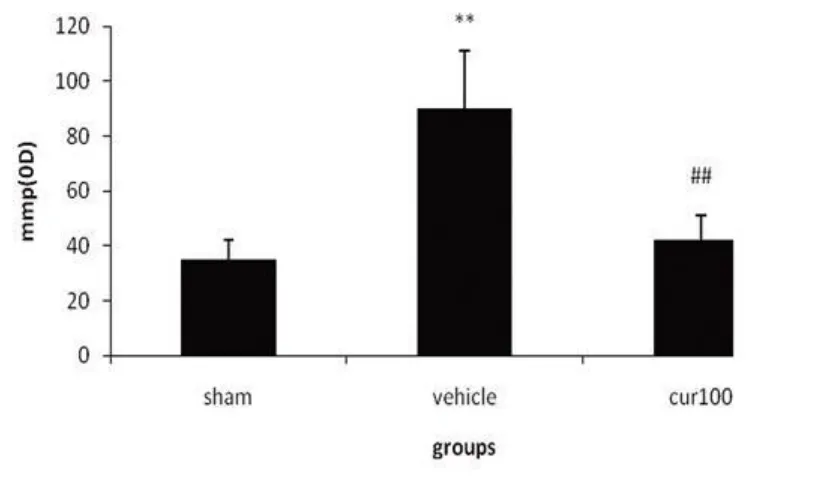
图3 SAC对缺血再灌注后膜电位的影响
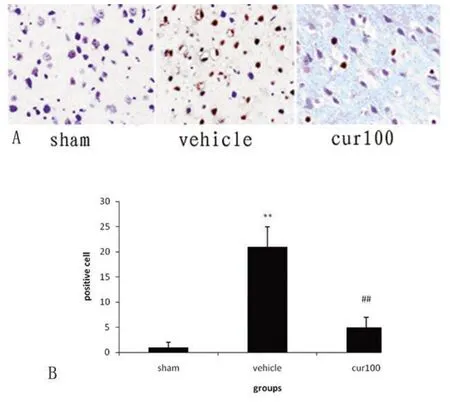
图4 SAC对脑缺血再灌注引起凋亡的影响
3 讨 论
卒中引起的细胞死亡是由兴奋性神经毒性、酸中毒、炎症反应、氧化应激等复杂机制所引起,缺血时,血流完全阻断的区域(即梗死中心区),迅速发生坏死;而由于周围血管部分代偿,梗死周围神经细胞主要死亡方式是细胞凋亡。这一部分也是我们抢救的重点。寻找具有抗凋亡活性的药物,并且确定其作用机制也显得尤为重要。细胞凋亡激活途径包括线粒体依赖的和非线粒体依赖的途径。
线粒体是多种促细胞凋亡信号传导分子的靶点,无论内源性途径还是外源途径都起着重要的作用[6]。在各种促细胞凋亡信号作用下,线粒体膜通透转运孔不可逆性过渡开放,导致线粒体跨膜电位屏崩解,呼吸链解偶联,线粒体基质渗透压升高,内膜肿胀,位于线粒体膜间隙的 Cytc和 AIF及酶原等释放于细胞质内,通过激活下游的 caspase启动细胞凋亡[7]。Cytc在细胞凋亡过程中,从线粒体释放进人胞质,与胞质中凋亡蛋白酶活化因子-1(Apaf-1)和 caspase-9相互作用,形成复合物,最终导致caspase酶活化[8]。AIF从线粒体转位进人胞质和胞核,直接导致染色质凝聚和大片段降解,这些效应不依赖于 caspase酶[9]。线粒体通过不断产生能量维持细胞存活,而通过释放多种促凋亡分子启动细胞凋亡过程,二者既相互联系又相互矛盾,成为细胞死与活的调控中枢。已有文献报道,SAC能够通过抗氧化作用,和调节兴奋性氨基酸的表达保护缺血性脑损伤[10]。在肿瘤方面,也有报道其能够抑制正常细胞凋亡,促进肿瘤细胞凋亡[11]。本研究表明 SAC能够通过保护线粒体,减少 AIF和 Cytc的释放,从而起到抗凋亡的作用。至于对线粒体的保护,是直接的作用,还是抗氧化作用的间接途径,还有待进一步研究。
总而言之,100mg/kg SAC缺血后 30min给药能减少大鼠缺血再灌注后皮质神经细胞凋亡,这可能是通过减少 Cytc和 AIF蛋白从线粒体的释放发挥作用。
[1] Lees KR,Zivin JA,Ashwood T,et al.NXY-059 for acute ischemic stroke[J].N Engl J Med,2006,354(6):588-560.
[2] 饶明俐.中国脑血管病防治指南[M].北京:人民卫生出版社,2005.1.
[3] Brad RS,David C,Christopher G.Apoptotic mechanisms after cerebral ischemia[J].Stroke,2009,40(5):331-339.
[4] Kim JM,Lee JC,Chang N,et al.S-Allyl-L-cysteine attenuates cerebral ischemic injuryby scavenging peroxynitrite and inhibiting the activity of extracellular signal-regulated kinase[J].Free Radic Res,2006,40(8):827-835.
[5] Fahim A,Seema Y,Sandeep KA.S-Allyl L-cysteine diminishes cerebral ischemia-induced mitochondrial dysfunctions in hippocampus[J].Brain Res,2009,1265:128-137.
[6] Lorenzo G,Eugenia M,Oliver K,et al.Targeting post-mitochondrial effectorsof apoptosis for neuroprotection[J].Biochim Biophys Acta,2009,1787(5):402-413.
[7] Green GR,Reed JC.Mitochondria and apoptosis[J].Science,1998,281:1309-1312.
[8] Li P,Nijhawan D,Budihardjo I,et al.Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade[J].Cell,1997,91(4):479-489.
[9] Zhang X,Chen J,Graham SH,et al.Intranuclear localization of apoptosis-inducing factor(AIF)and large scale DNA fragmentation after traumatic brain injury in rats and in neuronal cultures exposed to peroxynitrite[J].J Neurochem,2002,82(1):181-191.
[10] Thiyagarajan M,Sharma SS.Neuroprotective effect of curcumin in middle cerebral artery occlusion induced focal cerebral ischemia in rats[J].Life Sci,2004,74(8):969-985.
[11] Zhu YG,Chen XC,Chen ZZ,et al.Curcumin attenuates tert-butyl hydroperoxide induced oxidative damage in cortical neurons[J].Chin Pharmacol Bull,2004,20(10):153-156.
