多聚磷酸钠/壳聚糖多孔微载体的制备研究
2010-08-13刘宝林韩宝三杨晓昀彭承宏
周 燕 刘宝林* 韩宝三 杨晓昀 王 欣 杨 波 彭承宏
1)(上海理工大学医疗器械与食品学院 生物热科学研究所,上海 200093)
2)(上海交通大学医学院附属瑞金医院普外科、乳腺疾病诊治中心,上海 200025)
3)(上海消化外科研究所 上海 200025)
引言
借鉴人工肾技术发展起来的人工肝(artificial liver,AL),为肝功能衰竭的患者等待肝移植或自身肝再生争取了时间、创造了条件,为肝功能衰竭患者的治疗提供了新的希望。AL研究的近50年历史表明,只有以肝细胞为主要材料的生物人工肝(bioartificial liver,BAL)才具备真正意义上的“肝脏”功能,为肝功能衰竭病人提供可靠的人工肝支持。BAL中的肝细胞必须达到两个标准:一是要求一定数量的肝细胞,至少为109~1010个;二是培养的肝细胞必须具有肝脏的特异性功能。这就需要一种能实现肝细胞高密度、高活性培养的方法,而目前已发表文献中提及的肝细胞培养方法还难以实现这个目标。肝细胞的微载体(microcarrier)培养法的优点是有较大的比表面积,可以明显提高肝细胞的培养密度。
细胞微载体通常有两种形式:实心微球[1]和微胶囊[2]。实心微球的表面积有限,细胞只能黏附在其表面;而对于微胶囊,细胞只能包裹在其里面。两种情况均不利于细胞的大量繁殖和生长,而表面开孔、内部具有多孔结构的微载体则较好地解决了这一问题。多孔微载体的表面积大大增加,将有利于黏附更多的细胞,开孔结构也有利于营养物质的传输和细胞的生长。
在国外,有学者开展了多孔微载体培养肝细胞的研究,但尚处于起始阶段,代表性的是瑞典Pharmacia Biotech公司的Cytopore系列。在国内,近年有学者用胶原、壳聚糖等材料结合材料表面化学接枝改性技术从事实心微载体的研究,效果不理想。目前,国内尚未见用多孔微载体进行肝细胞的三维立体培养并成功运用于BAL研究的报道。
壳聚糖分子中含有大量的—NH2[3],酸溶液中被质子化,形成—NH3+而溶解。多聚磷酸钠由于其分子上的多个负电基团可以与壳聚糖分子中的大量—NH+3形成分子内和分子间的交联[4-5],从而使壳聚糖分子沉析出来。壳聚糖和多聚磷酸盐的结构示意图分别见图1和图2。

图1 图1 壳聚糖的结构Fig.1 Structure of chitosan

图2 多聚磷酸盐的结构Fig.2 Structure of tripolyphosphate
笔者通过研究高聚物多聚磷酸钠与壳聚糖之间通过静电交互作用形成聚电解质复合物(PEC),并与戊二醛和NaOH进行沉积交联作比较,同时结合冷冻干燥方法以,制备出机械强度和生物相容性均符合要求的多孔微载体。
1 材料和方法
1.1 材料
高压脉冲微胶囊成型装置(上海理工大学);微机控制降温仪(上海理工大学);Virtis冻干机(Virtis公司,美国);扫描电镜 SEM(FEI公司,美国);光学显微镜(Nikon公司,日本);SHA-C水浴恒温振荡器;多聚磷酸钠(分析纯,国药集团化学试剂有限公司,中国);壳聚糖(脱乙酰度≥90%,国药集团化学试剂有限公司,中国);其他试剂均选用分析纯。
1.2 方法
1.2.1 壳聚糖溶液配制
分别称取壳聚糖3 g和2 g,并溶解于100 mL、1%的稀醋酸中;将壳聚糖溶液置于37℃的水浴恒温振荡器中,持续振荡至其完全溶解,静置一段时间使壳聚糖中气泡消失,4℃保存备用。
1.2.2 高压脉冲微胶囊成型装置制备微球[6-9]
利用高压脉冲微胶囊成型装置(见图3)制备微球,根据预实验的结果,确定高压脉冲微胶囊成型装置参数(见表1),微球制备单因素试验见表2。

图3 高压脉冲微胶囊成型装置原理(1-多聚磷酸钠溶液;2-注射器;3-壳聚糖酸溶液;4-输液泵;5-铁架台;6-负极接线;7-正极接线;8-高压发生器)Fig.3 Principle of preparation of microsphere by high voltage field(1 sodium tripolyphosphate;2 injector;3 chitosan solution;4 infusion pump;5 iron support;6 negative terminal;7 positive terminal;8 high-voltage generator)

表1 高压脉冲微胶囊成型装置参数Tab.1 Parameters of the microsphere forming apparatus by high voltage field

表2 微球制备单因素实验表Tab.2 Single factor experiment for the preparation of microsphere
用7#注射器抽取适量的壳聚糖溶液,输液泵以一定速度向下推压,结合电场力作用,壳聚糖溶液通过7#平针头成滴地滴入烧杯中的多聚磷酸钠溶液,液滴固化交联形成多聚磷酸钠/壳聚糖微球。静置微球悬液30 min。SEM观察,微球出现皱缩塌陷现象(见图4),显示此时的微球为空心微球。

图4 多聚磷酸钠/壳聚糖空心微球Fig.4 The SEM image of tripolyphosphate/chitosan hollow microsphere
根据表2,分别滴加一定量5%的NaOH溶液和1%的戊二醛溶液交联微球。48 h后,取蒸馏水清洗微球数遍,至无残留戊二醛。处理后,将微球置于4℃冰箱保存备用。
1.2.3 冷冻干燥制备多孔微载体
利用微机控制降温仪,以恒定降温速率1℃/min,使微球从室温降至不同的预冻温度[10](-15、-20、-25、-30、-35℃),并恒温 2 h使其完全冻结。冻结后微球转至已预冷至相应温度的冻干机中进行一次干燥,该过程中控制冻干箱的真空度为10~30 Pa,以除去微球中的自由水。二次干燥时,设置搁板温度为20℃,除去微球中的结合水。冻干曲线见图5。

图5 冷冻干燥过程中冻干曲线Fig.5 Lyophilization curves of the freeze drying process
1.2.4 多孔微载体的表征
1.2.4.1 扫描电镜制样及分析
取10颗微载体,真空喷金后SEM观察。选择合适的放大倍数,观察微载体粒度分布和内孔特征。
1.2.4.2 微载体的吸水性
称取干态时微载体质量W1。室温下,将其浸泡在蒸馏水中12 h,取出后用滤纸吸干表面的水分,称重为W2,则微载体的吸水率为

1.2.4.3 孔隙率[11]
采用液体置换方法,测定微载体的孔隙率。这里选无水乙醇作为置换液体。将一定量干态微载体浸泡在V1体积无水乙醇中5 min,之后刻度管显示为V2;取出微载体后,管中显示为 V3。所以微载体的体积V=V2-V3,孔隙率为

2 结果
2.1 高压脉冲微胶囊成型装置的参数设置
实验表明,该装置的电压、推进速度、液面距、脉宽、频率以及壳聚糖和多聚磷酸钠的浓度,均会对微载体的成型产生影响。
根据前人的经验及单因素试验结果,高压脉冲微胶囊成型装置的参数设置如下:电压55 kV,推进速度90 mm/h,液面距25 mm,脉宽6,频率90 Hz。
随着壳聚糖和多聚磷酸钠浓度的增加,微球的的均匀性增加,空心度减小。戊二醛和NaOH促使微球加快实心化。48 h后,壳聚糖与0.1 mM多聚磷酸钠静电作用所得微球,经两种交联剂沉积后,微球外层会破裂,渗出中间物(见图6)。而壳聚糖与0.08 mM多聚磷酸钠静电作用所得微球,戊二醛交联沉积后微球颜色泛黄,但表面光洁度高,沉积结实稳定;经NaOH沉积后,微球颜色无明显变化,但沉积耗时长,且沉积难以完全彻底,见图7。
2.2 冷冻干燥过程的参数设置
实验结果表明,当预冻速度为1℃/min、预冻温度在-35℃时,制得的微载体效果最好,见图8中的(a)和(b),微载体的孔隙率超过80%,内部孔洞之间相互连通,但微球的表面孔隙不明显。同时可以看出,经NaOH交联沉积后的微球(见图8(a))部分表面会出现孔隙,而经戊二醛沉积的微球(见图8中的(c)和(d))表面则没有任何孔隙存在。从图8(c)观察可知:冷冻干燥后的微载体粒径较刚制出的微球粒径小,这是因为冷冻干燥过程引起微球有一定的收缩。但是,这种尺寸范围的微载体仍适宜于生物人工肝的应用。
3 讨论
3.1 影响多孔微载体成型和粒径的因素分析
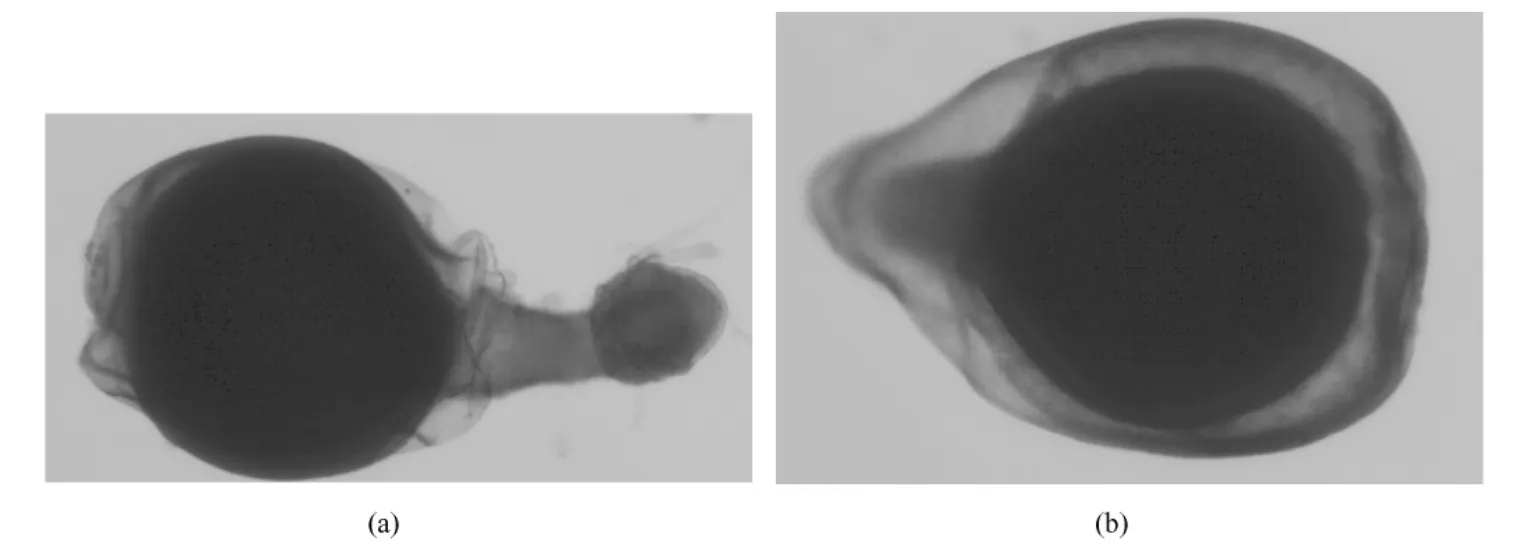
图6 0.1 mM多聚磷酸钠静电作用微球的显微镜照片。(a)NaOH沉积;(b)戊二醛沉积Fig.6 Microscope images of 0.1 mM sodium tripolyphosphate microspheres.(a)NaOH deposition;(b)GA deposition

图7 0.08 mM多聚磷酸钠静电作用微球的显微镜照片。(a)NaOH沉积;(b)戊二醛沉积Fig.7 Microscope images of 0.08 mM sodium tripolyphosphate microspheres.(a)NaOH deposition;(b)GA deposition
电压升高,微球的平均粒径快速减小。输液泵的推进速度提高,壳聚糖溶液向针尖的流速增大,形成微球的速度增加,微球的平均粒径增大且均匀性好。液面距增加,液滴所受的电场力减小,微球粒径逐渐增大。脉宽增加,微球粒径增大。频率与粒径相关性不高,但影响粒径的均匀性。
3.2 影响多孔微载体内部孔径和孔隙率及吸水性的因素
从微载体内部形成孔洞结构的机理来看,微球内部形成的冰晶越大,最后形成的孔径也就越大。预冻过程不仅是为了保护物质的主要性能不变,更重要的是使冻结后的样品有合理的结构,以利于水分的升华。预冻效果主要由3个因素决定:预冻速度、预冻温度和时间。预冻速度较大时,形成的冰晶细小且数量较多。升华之后留下的孔道小,水蒸气逸出的阻力大,升华速率减慢;但冻干品外观质量好、比表面积大,易于复水。预冻温度过低,会使材料出现玻璃化,不符合形成多孔微载体的要求。
微载体表面的孔隙不明显,原因可能是壳聚糖与多聚磷酸钠反应过度,且表面孔隙可能是NaOH与壳聚糖反应的结果。这还有待进一步研究验证,并考虑在后期实验中加入致孔剂,以使微载体表面和内部均有孔隙。
微载体的吸水性随其孔隙率提高而加强。吸水性好的微载体有很强的保水性,这样的微载体可以防止体液和营养成分的流失,有利于细胞的生长。
4 结论
采用高压静电技术和冷冻干燥技术制备多聚磷酸钠/壳聚糖微载体,改善了传统乳化法制备微载体时粒径不可控、圆整度不好等缺点,且操作方便。应用冷冻干燥技术,能获得内部有孔洞且孔径均匀的微载体,但微载体的连通性没有达到预期要求,微载体的外层有硬壳,且微载体的机械强度有待进一步增强。后期的工作重点将放在如何制备表面和内部均有孔径的微载体,同时需进一步提高微载体的机械强度。只有这样,制备的微载体方能适合细胞的生长繁殖和组织再生。

图8 微载体扫描电镜照片。(a)和(b)NaOH沉积微载体的外表面和内部结构;(c)和(d)戊二醛沉积微载体外表面和内部结构Fig.8 SEM images of microcarriers.(a)and(b)the outer surface structure and internal structure of the microcarrier by NaOH deposition;(c)and(d)the outer surface structure and internal structure of the microcarrier by GA deposition
[1]Choi YS,Park SN,Suh H.Adipose tissue engineering using mesenchymal stem cells attached to injectable PLGA spheres[J].Biomaterials,2005,26: 5855-5863.
[2]薛伟明,于炜婷,王为,等.细胞移植用微胶囊的制备材料与制备方法[J].化学通报,2003,66(w12):1-7.
[3]Wu Chen,Pan Jilun,Bao Zhiming,et al.Fabrication and characterization of chitosan microcarrier for hepatocyte culture[J].Journal of Materials Science: Materials in Medicine,2007,18: 2211-2214.
[4]杨光,杨波,钱大钧.多聚磷酸钠交联淀粉的制备及理化性质研究[J].食品工业科技,2007,28(12):126-129.
[5]Yokogawa Y, Nishizawa K, Nagata F, et al. Bioactive Properties of Chitin/Chitosan—Calcium Phosphate Composite Materials[J].Journal of Sol-Gel Science and Technology,2001,105-113.
[6]张可达,徐冬梅,王平.微胶囊化方法[J].功能高分子学报,2001,14(4):476-477.
[7]朱盛山.药物新剂型[M].北京:人民卫生出版社,1993.164-174.
[8]张永成,方岩雄,范会强,等.医药微胶囊技术[J].河北化工,2002,6-8.
[9]李保国,华泽钊,刘占杰.高压静电场制备微胶囊的研究[J].上海理工大学学报,2000,22(3):189-193.
[10]刘华国,王迎军,宁成云,等.冷冻干燥/粒子沥滤复合法制备聚己内酯组织工程支架[J].材料导报,2007,126-127.
