单级自养脱氮反应器效能与微生物群落结构的相关性
2010-08-11郭劲松杨国红
方 芳,秦 宇,2,郭劲松,贾 丽,杨国红
(1.重庆大学城市建设与环境工程学院,重庆400045;2.重庆交通大学 河海学院,重庆400074)
单级自养脱氮工艺是新型生物脱氮工艺的一种,在处理低碳高氨废水上具有简易、高效、低耗等特点而具有较大的潜力,成为生物脱氮领域中的研究热点[1-3]。不少学者从溶解氧(DO)、氨氮负荷率、具有自养脱氮功能的污泥富集形式等对该工艺的实现和运行进行了探讨[4-7]。由于该工艺研发较晚,目前对其微观作用机理研究仍显滞后。主流观点认为,系统内主要功能菌为亚硝化菌(ammonium oxidizing bacteria,AOB)、硝化菌(nitrite oxidizing bacteria,NOB)及厌氧氨氧化菌(anaerobic ammonium oxidizing bacteria,ANAMMOX)3大类自养菌[7-10]。由于自养菌世代周期较长,且难以模拟其生长繁殖的条件而不能获得细菌的纯培养,加上系统内微生物的多样性,使得传统微生物学方法不能完全满足自养脱氮系统微观层面的研究。近年来,采用生物标记技术,特别是以16S rDNA为基础的分子生物学技术,在环境领域应用研究的迅速发展[11-13],使得掌握该工艺中主要功能菌的微生物群落结构及微生物多样性,并探讨数量和结构对反应器效能的影响成为可能。
该文从宏观控制参数条件相同、运行稳定但效能有明显差异的2套序批式生物膜单级自养脱氮(SBBR)反应器中,采集生物膜及活性污泥样品,利用变性凝胶梯度(PCR-DGGE)、实时PCR(real-time PCR)等技术对其进行微生物群落结构研究,了解SBBR自养脱氮系统的微生物组成、群落结构及其影响因素,分析宏观运行效能与自养脱氮系统微观组成相关性。
1 材料与方法
1.1 试验装置
试验装置如图1所示,共有A、B 2组有机玻璃反应器同时运行,反应器有效容积均为30 L。其中A反应器应用了空心球与弹性填料组合,而B反应器只采用软性填料。
研究采用人工配液进行试验,即称取适量的NH4HCO3加入自来水中,控制进水约为160 mg/L。加入一定量的NaHCO3调节进水p H值为8(±0.2);加入适量的KH2PO4作为微生物代谢所需的磷源;按每L溶液2 mL微量元素贮存液加入反应器。系统保持在30℃条件下运行,HRT为2 d,不人工排泥。控制系统温度在30℃左右。
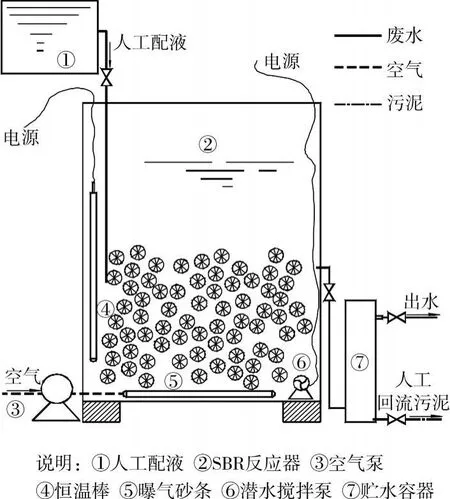
图1 试验装置示意图
A、B系统前期分别在DO为0.8~1.5 mg/L和1.5~2.0 mg/L连续曝气的状态下完成了启动,但脱氮效能不理想,之后将供氧方式改为间歇曝气,并控制反应器DO均为2.0~2.5(曝气)/0.2~0.4(停曝)mg/L,曝停比2 h:2 h[14]。在该控制条件下,A、B 2组反应器的运行效能有所提高,均具有一定的氨氮转化率及总氮去除率,研究在该条件下取样进行。
1.2 DNA提取
分别从反应器中采取活性污泥样品及生物膜样品,于10 000 rpm高速离心5 min,取沉淀污泥约100 mg,按文献[15]方法提取样品DNA。
1.3 PCR-DGGE
PCR扩增、DGGE电泳的具体运行条件及图谱相关性分析详见文献[15]。
1.4 Real-time PCR
分别选用好氧氨氧化菌(AOB)、亚硝酸氧化菌(NOB)及厌氧氨氧化菌(ANAMMOX)特异性引物用以real-time PCR,表1为各类细菌的PCR引物。以各细菌序列片段的 T质粒载体克隆作为定量标准品,采用TA粘末端克隆法制备重组质粒,将其进行倍比稀释后在荧光定量PCR检测中利用标准品扩增得到定量标准曲线,并结合标准曲线对样品进行定量分析。具体操作详见文献[16-18]。

表1 各类细菌PCR引物
1.5 分析测试项目与方法
悬浮固体(SS)和挥发性悬浮固体(VSS):标准重量法[19];pH:Sension2型便携式p H/ISE测量仪;溶解氧:LDOTMHQ10便携式溶解氧测量仪;COD:重铬酸钾-硫酸银氧化法;总氮:过硫酸钾氧化-紫外分光光度法[19];亚硝酸盐:N-1-奈基-乙二胺比色法[19]。
2 结果与分析
2.1 反应器运行
A反应器进出水各形态氮浓度及系统运行效能如图2所示。该反应器出水水质在本试验阶段稳定,进行监测的70余天内,出水氨氮浓度保持在0~17 mg/L,转化率超过90%;总氮浓度约25 mg/L左右,去除率介于81%~87%。

图2 A反应器氮转化关系图
B反应器进出水水质如图3所示。在试验过程中,反应器出水氨氮在70~90 mg/L范围波动,好氧氨氧化过程反应不充分,系统只有40%~60%左右的氨氮转化率,系统内基本上无NO2--N积累,NO3--N除少数几天浓度低于10 mg/L外,一直在30~40 mg/L波动。由 NH4+-N氧化生成的NO2--N很大一部分又被进一步氧化成NO3--N,其余与残余NH 4+-N发生了厌氧氨氧化过程,所以系统TN去除率不高,除个别时候达到40%外,其余试验期间均仅在20%~30%。与A反应器相比,B反应器同期时间内运行效能明显较差。
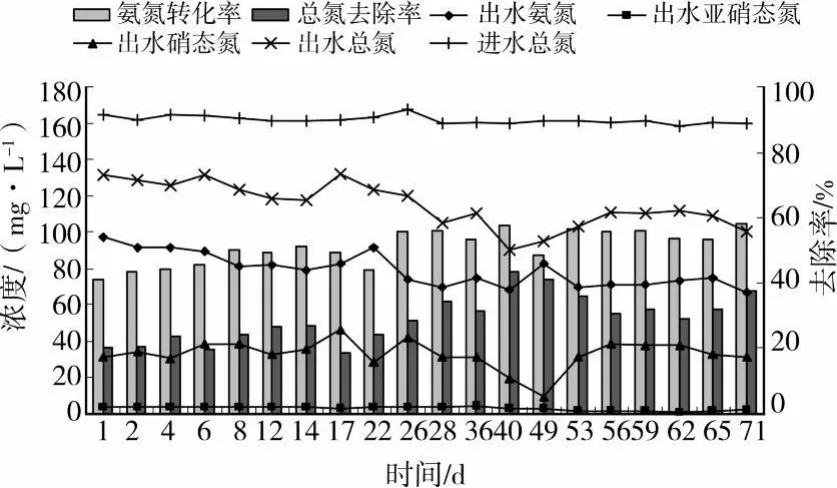
图3 B反应器氮转化关系图
2.2 反应器微生物群落结构
图4 、图5分别为SBBR自养脱氮系统接种污泥及A、B反应器中活性污泥与生物膜样品DNA(a)、PCR扩增产物(b)琼脂糖凝胶电泳图谱和DGGE结果。
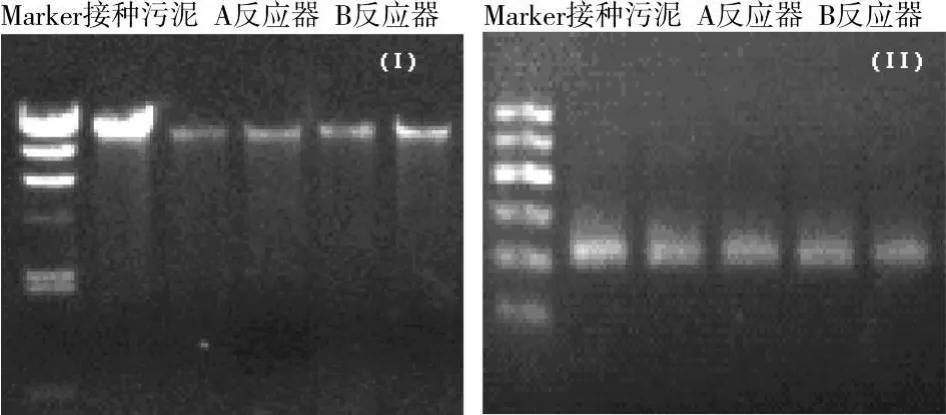
图4 DNA(I)及PCR扩增产物(II)琼脂糖凝胶电泳图谱
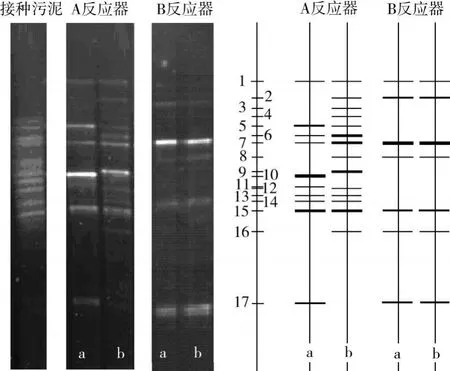
图5 PCR产物的DGGE图谱及其强度分析
图4中从左到右分别为:Marker(λ-HindⅢ)、接种污泥、A反应器活性污泥、A反应器生物膜、B反应器活性污泥、B反应器生物膜。
图5显示,接种污泥样品条带数明显多于驯化后的SBBR自养脱氮系统,相比于接种污泥,稳定运行的SBBR自养脱氮系统内微生物群落结构种群多样性降低,这是由于在整个驯化过程中,人工配液里不含有机碳源,随着反应器内有机碳源的减少,系统中自养细菌在和异养细菌的竞争中逐渐占据优势地位,适应能力较弱或对有机碳源量要求较高的异养细菌则被大量淘汰,从而使得该SBBR自养脱氮反应器中微生物的种群结构变得相对简单。
A反应器,成功启动后具有较高的运行效能,氨氮转化率超过 90%,总氮去除率达到 80%以上。DGGE条带图谱统计分析结果显示,该系统中,活性污泥样品含有10条优势功能菌条带,生物膜有14条,二者微生物群落丰富度值分别为0.588和0.824,相似性为58.3%。而B反应器,从接种驯化开始,除单纯采用软性填料外,虽运行控制条件等均与A反应器相同,但运行效能明显低于A反应器。B系统挂膜不理想,活性污泥与生物膜样品微生物构成没有明显差异,二者微生物群落相似性达到100%,2种样品中均含有7条条带,微生物群落丰富度值为0.412。试验同期测得A与B反应器内活性污泥浓度分别为728 mg/L和757 mg/L,生物膜浓度分别为844 mg/L和433 mg/L。显然,与A反应器相比,B反应器中活性污泥浓度与之相当,但生物膜浓度却只有A反应器生物膜的一半左右。若将相同比表面积下生物膜厚度与生物膜浓度视为正比关系,则可以认为B反应器中生物膜没有较好形成,厚度较薄,难以在膜内形成DO梯度,故膜内DO的分布可以视为与完全混合的活性污泥相当,使得生物膜与活性污泥的微生物群落结构无显著差异。
2.3 SBBR自养脱氮系统功能菌定量化研究
A、B反应器各类功能菌荧光定量PCR结果见图6。

图6 A、B系统功能菌数量示意图
由图6可以看出,AOB在A反应器中数量明显多于B反应器,活性污泥和生物膜样品分别比B系统高出2个和1个数量级。AOB在自养脱氮过程中负责氨氮转化的第一步,以NH4+-N为底物,将其氧化为NO2--N,丰富的AOB数量使得A系统具有较高的氨氮转化率,达到90%左右。B系统AOB较A系统少,有限的AOB只能将一部分NH 4+-N进行代谢,从而直接影响到系统后续的运行效能。
NOB在A、B系统中的分布与AOB有较大差别,该类细菌在A反应器中不占优势,与其它功能菌相比,相差2~3个数量级,但在B系统中,NOB数量级与AOB相当。造成该现象的原因有2点:1)A系统前期在DO=0.8~1.5 mg/L连续曝气的状态下启动,而B系统启动时DO=1.5~2.0 mg/L。有研究表明[20],在溶解氧浓度较低的情况下,AOB与NOB的增长速率均下降,但NOB的下降趋势比AOB要快。低DO浓度,尤其是在 DO低于1.0 mg/L的情况下,AOB与NOB的竞争中AOB比较有利。所以在A系统中NOB数量上不占优,而B系统中NOB与AOB数量相当,从而推动了NO2-向NO3-的转化;2)B系统在前期启动过程中有较多的NO2--N积累,由于系统没有较好地形成生物膜,缺乏足够的厌氧环境,阻碍了厌氧菌ANAMMOX的代谢,积累的NO2--N很大程度上为NOB的代谢提供了充足的底物,为NOB所利用。以上2点原因造成B系统中NOB没有被完全“洗脱”,在该系统中数量较多,成为了优势功能菌。从B系统运行效能图(图3)中也可以看出,B反应器内NO3--N浓度较高,一直在30~40 mg/L波动,由NH4+-N氧化生成的NO2--N很大一部分又被进一步氧化成NO3--N。
ANAMMOX无论在A反应器还是B反应器,数量上均为占优的。运行效能优秀的A反应器中ANAMMOX数量级达到1012,而脱氮效果不好的B系统中数量级仅为1010,说明ANAMMOX的数量在一定程度上直接与整个系统的脱氮效能相关,ANAMMOX数量越多,系统出水的水质越高。
3 讨论
目前,单级自养脱氮工艺氮去除机理的主流观点认为:系统内氨氮首先由AOB将之部分氧化为亚硝氮,剩余的氨氮再和第一步反应生成的亚硝态氮在ANAMMOX作用下进一步反应生成氮气[8-9]。AOB为好氧菌,而 ANAMMOX对氧气相当敏感[21]。因此,若想使SBBR自养脱氮系统具有良好的运行效能,其技术关键是控制反应器中的溶解氧浓度,创造一个既利于AOB又不阻碍ANAMMOX代谢的微生态环境,推动亚硝化和厌氧氨氧化这2个过程顺利进行。在试验的控制条件下,DO为2.0~2.5(曝气)/0.2~0.4(停曝)mg/L,曝气时的DO浓度将对厌氧氨氧化菌正常生理代谢产生抑制。因此,需要利用各类微生物对DO的不同适应性,根据生物膜内的DO梯度,在生物膜内有序生长。生物膜外表面溶解氧浓度较高,以好氧亚硝化菌为主;深入生物膜内部,氧传递受阻,并且因外部好氧菌对氧的消耗,在生物膜深处产生缺氧区和厌氧区,厌氧氨氧化菌将占优势。因此在运行效能较好的A反应器中,生物膜与活性污泥样品微生物区系组成具有差异,二者相似性仅为58.3%,生物膜样品的丰富度值高于活性污泥样品,且脱氮功能菌 AOB、ANAMMOX数量均明显多于B反应器。在该系统中,活性污泥与生物膜之间构成了一个微小的生态系统,氮的去除是其中各种微生物相互平衡、协同代谢作用的结果。较高的生物膜浓度及微生物多样性为SBBR自养脱氮创造了一个良好环境。
B反应器,活性污泥与生物膜样品中均含有7条条带,微生物群落丰富度值为0.412,二者微生物群落相似性达到100%,活性污泥与生物膜样品微生物构成并没有明显差异,NOB在系统内没有被完全“洗脱”,功能菌AOB、ANAMMOX数量优势与A系统相比不明显,生物膜没有很好形成,厚度较薄。从反应器氮转化关系图(图3)中可以看出,B反应器在运行期间内具有40%~60%左右的氨氮转化率,可以认为该反应器能够实现自养脱氮的第一步:好氧亚硝化过程。但系统的总氮去除率只有20%~30%,转化的氨氮以NO3--N残留在系统内,只有部分发生了厌氧氨氧化过程,较差的生物膜特性没有为厌氧氨氧化菌创造一个良好的代谢环境,厌氧微生物数量较低,使自养脱氮过程停留在好氧阶段。此外,虽然B反应器中活性污泥及生物膜2种样品均存在多种微生物,但从DGGE图谱中可以看出,系统内优势功能菌单一,带7所代表的微生物在系统中显得尤为强大,从而使系统没有良好的微生物协同代谢过程,系统只完成了少量的自养脱氮过程,宏观表现则为较差的运行效能。
4 结论
1)在稳定运行的SBBR自养脱氮系统内,与接种污泥相比,微生物群落结构较为简单,自养菌被富集而大量异养菌则被淘汰,AOB、NOB及ANAMMOX数量大幅增长,成为系统中优势功能菌。
2)运行效能好的A反应器,生物膜与活性污泥微生物区系组成相似性低,活性污泥与生物膜之间构成了一个微小的生态系统,氨氮通过各种微生物之间的相互平衡、协同代谢去除。运行效能较差的B反应器,由于生物膜没有很好形成,活性污泥与生物膜的微生物群落结构相似,功能菌单一不利于系统脱氮。
3)运行效能好的A反应器,AOB及ANAMMOX数量上与NOB相比占有绝对优势,系统能够较好的完成NH 4+-N向NO2--N的转换及厌氧氨氧化过程;运行效能较差的B反应器,NOB没有被完全“洗脱”,系统中出现NO3--N积累,阻碍厌氧氨氧化过程,从而影响了整个脱氮效能。
4)维持SBBR自养脱氮系统微生物群落结构的稳定及平衡性,生物膜是一关键性因素,尤其在高DO范围内,厌氧菌对生物膜的依赖性强,利用生物膜内多种微生物的协同代谢作用可以为反应创造适宜条件,使系统有较好的运行效能。
[1]YOUNG-HO AHN.Sustainable nitrogen elimination biotechnologies:A review[J].Process Biochemistry,2006,41:1709-1721.
[2]郑平,冯孝善.废物生物处理[M].北京:高等教育出版社,2006.
[3]JETTEN M S M,CIRPUS I,KARTAL B,et al.1994-2004:10 years of research on the anaerobic oxidation of ammonium[J].Biochem1 Soc Trans,2005,33(1):119-123.
[4]HIPPEN A,ROSENWINKEL K H,BAUMGARTEN G,et al.Aerobic deammonification:a new experience in the treatment of wastewater[J].Water Science Technology,1997,35:111-120.
[5]廖德祥,李小明,曾光明,等.单级SBR生物膜中全程自养脱氮的研究[J].中国环境科学,2005,25(2):222-225.LIAO DE-XIANG,LI XIAO-MING,ZENG GUANGMING,et al.Studies on deammonification process in single SBR biofilm[J].China Environmental Science,2005,25(2):222-225
[6]HELMER C,TROMM C,HIPPEN A,et al.Single stage biological nitrogen removal by nitrification and anaerobic ammoniium oxiadation in biofilm systems[J].Water Science Technology,2001,43(1):311-320.
[7]DONG X,TOLLNER E W.Evaluation of anammox and denitrification during anaerobic digestion of poultry manure[J].Bioresource Technology,2003,86(2):139-145.
[8]HAO X D,HEIJNEN J J,VAN LOOSDRECHT M C M.Sensitivity analysis of a biofilm model describing a one-stage completely autotrophic nitrogen removal(CANON) process [J].Biotechnology and Bioengineering,2002,77(3):266-277.
[9]SLIEKERS A O,DERWORTH N,GOMEZ J L C,et al.Completely autotrophic nitrogen removal over nitrite in one single reactor[J].Water Research,2002,36:2475-2482.
[10]THIRD K A,SLIEKERS A O,KUENEN J G,et al.The CANON(completely autotrophic nitrogen removal over nitrite)under ammonium limitation:interaction and competition between three groups of bacteria[J].Systematic and Applied Microbiology,2001,24:588-596.
[11]傅以钢,王峰,赵建夫,等.高浓度硝酸盐对城市污水活性污泥中微生态种群结构的影响[J].环境科学学报,2005,25(3):372-378.FU YI-GANG,WANG FENG,ZHAO JIAN-FU,et al.Influence of high concentration nitrate ion on the microbial ecosystem of activated sludge of municipal sewage[J].Acta Scientiae Circumstantiae,2005,25(3):372-378.
[12]MUTTRAY A F,MOHN W W.Quantitation of the population size and metabolic activity of a resin acid degrading bacterium in activated sludge using slot-blot hybridization to measure the rRNA:rDNA ratio[J].Microbiol Ecol,1999,38(4):348-357
[13]ROWAN AK,SNAPE JR,FEA RNSIDE D,et al.Composition and diversity of ammonia oxidising bacterial communities in wastewater treatment reactors of different design treating identical wastewater[J].FEMS Microbiol Ecol,2003,43:195-206
[14]方芳,郭劲松,秦宇,等.单级自养脱氮生物膜SBR工艺的启动研究[J].中国给水排水,2006,22(1):58-61 FANG FANG,GUO JIN-SONG,QIN YU,et al.Start-up research of one-step autotrophic nitrogen removal process in SBR biofilm reactor[J].China Water&Waste Water,2006,22(1):58-61.
[15]秦宇,郭劲松,方芳,等.溶解氧及曝停比对单级自养脱氮系统微生物群落结构影响研究[J].环境科学,2009,30(2):191-196 QIN YU,GUO JIN-SONG,FANG FANG,et al.Effect of DO and aeration/non-aeration ratio on the microbial community structure in one-step SBBR completely autotrophic nitrogen removal process[J].2009,30(2):191-196.
[16]GILLIAN D,SPEKSNIJDER A G C L,ZWART G J M,et al.Genetic diversity of the biofilm covering Montacuta ferruginosa(Mollusca ,Bivalvia)as evaluated by denaturing gradient gel electrophoresis analysis and cloning of PCR amplified gene fragment coding for 16S rDNA[J].Appl Environm Microbiol,1998,64(9):3464-3472.
[17]MUTTRAY A E,HOLLIBAUGH J T,ORREGO C.Phylogenetic composition of bacterioplankton from two California estuaries compared by denaturing gradient gel electrophoresis of 16S rDNA fragments[J].Appl Environm Microbiol,1996,62(7):2676-2680.
[18]秦宇,方芳,郭劲松,等.溶解氧对单级自养脱氮系统功能菌数量的影响[J].微生物学报,2009,49(6):773-779.QIN YU,FANG FANG,GUO JIN-SONG,et al.Quantification of functional bacteria in one-step completely nitrogen removal process influenced by dissolved oxygen[J].Acta Microbiologica Sinica,2009,49(6):773-779.
[19]国家环保局编.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[20]BERNET N,PENG D C,DELGENES J P,et al.Nitrification at low oxygen concentration in biofilm reactor[J].Journal of Environment and Engineering,2001,127(3):266-271.
[21]STROUS M,VAN GERVEN E,KUENEN JG,et al.Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing(Anammox)sludge[J].Applied and Environmental Microbiology,1997,63(6):2446-2448.
