芸薹属植物对四种土传病原微生物熏蒸效果的研究
2010-08-09乔世佳李淑敏孟令波
乔世佳,李淑敏*,孟令波,2
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.哈尔滨学院生物与化学学院,哈尔滨 150086)
生物熏蒸是利用含有硫代葡萄糖苷的植物,抑制或杀死土壤中有害生物的一种土壤消毒方法[1]。硫代葡萄糖苷在植物组织受到切碎、咀嚼等伤害时会引发“芥子气爆炸”,降解成一系列的水解产物[2],其中的异硫氰酸酯具有抑制植物寄生线虫[3-4]、杂草[5]、病原真菌[6]的功能,并能改善土壤结构,提高作物产量[7]。目前已经证明,利用芥菜、甘蓝、芜菁等芸薹属植物提取物进行土壤熏蒸,能够抑制马铃薯疫霉绯腐病菌(Phytophthora erythroseptica)、菌核病菌(Sclerotinia sclerotiorum)、根腐丝囊霉(Aphanomyces euteiches)、尖孢镰刀菌(Fusarium oxysporum)、黄萎病(V.dahliae)等土传病害[8-12]。然而,芸薹属不同植物间以及同一植物不同品种间的硫代葡萄苷浓度和降解产物异硫氰酸酯形式都具有很大的差异,其所起作用也受环境条件和植物生长状况影响。为了确定芸薹属植物对更多种类的土传病害是否具有潜在的抑制能力,以及是否特定芸薹属植物对特定土传病害有更好的控制效果。本研究通过培养皿试验,以抑菌率、菌丝干重、产孢量、孢子萌发率四个指标来评价春夏秋冬小白菜、苏州青油菜、小花叶芥菜、红圆芜菁、香港迟花芥蓝和香港白花芥蓝等六种芸薹属植物对黄瓜枯萎病、黄瓜灰霉病、黄瓜立枯病和水稻稻瘟病等四种病原菌的抑制效果,从中选出具有较好生物熏蒸能力的植物材料,为进一步利用生物熏蒸技术防治土传病害提供新的思路,为揭示硫代葡萄糖苷抑菌机理奠定理论基础。
1 材料与方法
1.1 材料
供试菌种为黄瓜枯萎病(Fusarium oxysporu f.sp.cucumerinum Owen)、黄瓜灰霉病(Botrytis cinerea)、黄瓜立枯病(Rhizoctonia solani Kahn)、水稻稻瘟病(Pyricularia grisea(Cooke)Sacc.),均由东北农业大学农学院采集、分离和保存。供试植物材料为春夏秋冬小白菜(B.chinensis L.)、苏州青油菜(B.campestris L.)、香港迟花芥蓝(B.albograbra Bailey)和香港白花芥蓝(B.albograbra Bailey)的茎叶,小花叶芥菜(B.juncea)和红圆芜菁(B.rapa)的块根。六种蔬菜均为作者种植所得。
1.2 方法
1.2.1 植物提取液的制备和菌种的准备
采集生长50 d左右的新鲜植物的茎叶和块根,清洗干净,用5%的NaClO溶液表面消毒3 min,用无菌水冲洗后切成小块,将60 g植物组织与20 mL蒸馏水混匀后,用榨汁机将植物组织打碎,纱布过滤,-80℃保存备用。将保存的四种病菌菌株恢复活性,纯化培养于PDA培养基(马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL)中备用。
1.2.2 不同芸薹属植物对病原菌抑菌率的测定
用直径为0.5 cm的打孔器在菌落边缘打孔,取生长水平相同的菌饼接种于已倒有PDA平板的9.0 cm培养皿中央,然后加入4 mL植物提取液(加入4 mL蒸馏水为空白对照),迅速将接种菌饼的培养皿底盖盖上,置28℃培养箱内黑暗培养。每处理4次重复。每隔24 h测定1次菌落直径,连续测定6次,以第6次菌落直径大小衡量不同植物材料对病原菌的熏蒸抑菌能力。

1.2.3 不同芸薹属植物对病原菌的生物量累积的测定
用打孔器将四种病原菌接种于铺有无菌玻璃纸的 PDA平板中央,取植物提取液(4 mL)按1.2.2方法熏蒸6 d后,刮下玻璃纸上的菌丝,装入塑料管内。60℃烘烤72 h后测定干重,以确定生物熏蒸处理对不同病原菌生物量累积的影响。设4 mL蒸馏水的处理为空白对照,重复4次。
1.2.4 不同芸薹属植物对病原菌的产孢量和所产孢子萌发率的测定
按1.2.3所述方法,经4 mL植物提取液生物熏蒸处理6 d后刮下菌丝,放入装有20 mL无菌水的离心管中,振荡器上摇匀,过200目无菌钢筛后定容至20 mL,取滤液滴于血球计数板,显微镜下计数。重复测定3次。将孢子悬浮液稀释到10-4倍,涂布于孟加拉红培养基平板上,测定所产孢子的萌发率[13]。重复测定3次。

1.3 数据分析方法
采用Excel 2003和SAS 7.0软件进行统计分析。
2 结果与分析
2.1 不同芸薹属植物对病原菌抑菌率的测定
由表1可知,在熏蒸第6天,六种芸薹属植物提取液对四种植物病原菌都有抑制效果,与对照相比均有显著差异,但程度不同;芥菜的抑菌程度最高,对四种植物病原菌的抑菌率均为100%,显著高于其他五种植物;红圆芜菁对黄瓜枯萎病、黄瓜灰霉病、黄瓜立枯病和水稻稻瘟病的抑菌率分别为55.7%、62.7%、79.9%、60.5%,除芥菜外,与其他四种植物相比抑菌作用明显。在5%的显著水平上迟花芥蓝与白花芥蓝对四种植物病原菌的抑菌效果有显著差异,前者的抑菌效果高于后者;油菜对四种植物病原菌的抑菌率均高于40%;白菜除对黄瓜枯萎病的抑菌率为37.8%外,对其他病菌的抑菌率均高于40%;油菜和白花芥蓝抑菌效果无显著差异。

表1 六种芸薹属植物对四种病原菌的抑菌效果Table 1 Inhibiting effects of six Brassica plants on the four pathogens
由图1可知,小花叶芥菜对四种土传病害病菌都有直接杀死效果。春夏秋冬小白菜、苏州青油菜、红圆芜菁、香港迟花芥蓝、香港白花芥蓝等其他五种芸薹属植物对病原真菌只起抑制作用,其抑菌效果随时间延长产生改变,最大抑菌效果均在第1天,随着时间延长,总体上呈现先降后升的规律,且最后的抑菌效果均低于第1天。这说明生物熏蒸的抑菌效果会随着时间的推移而逐渐下降。
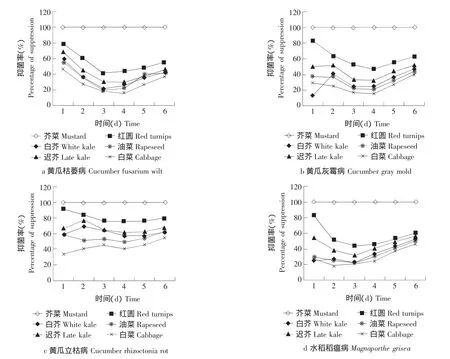
图1 六种芸薹属植物随时间变化对四种土传病病菌的抑制Fig.1 Inhibition of six different treatments conditions on the four pathogens with time change
2.2 不同芸薹属植物对病原菌生物量累积的影响
结果见图2。
图2表明,六种芸薹属植物对四种土传病害病原菌生物量积累均有明显的抑制作用,但抑制效果不同。小花叶芥菜对四种土传病害病原菌生物量积累的抑制效果最佳,经其处理后,各菌菌丝干重均为0 mg。其余五种芸薹属植物抑制效果高低排序为:红圆芜菁>香港迟花芥蓝>香港白花芥蓝>苏州青油菜>春夏秋冬小白菜。除小花叶芥菜对所有病原菌生物量积累完全抑制外,另外五种植物对黄瓜枯萎病病原菌生物量积累的抑制效果均强于其他三种土传病害。
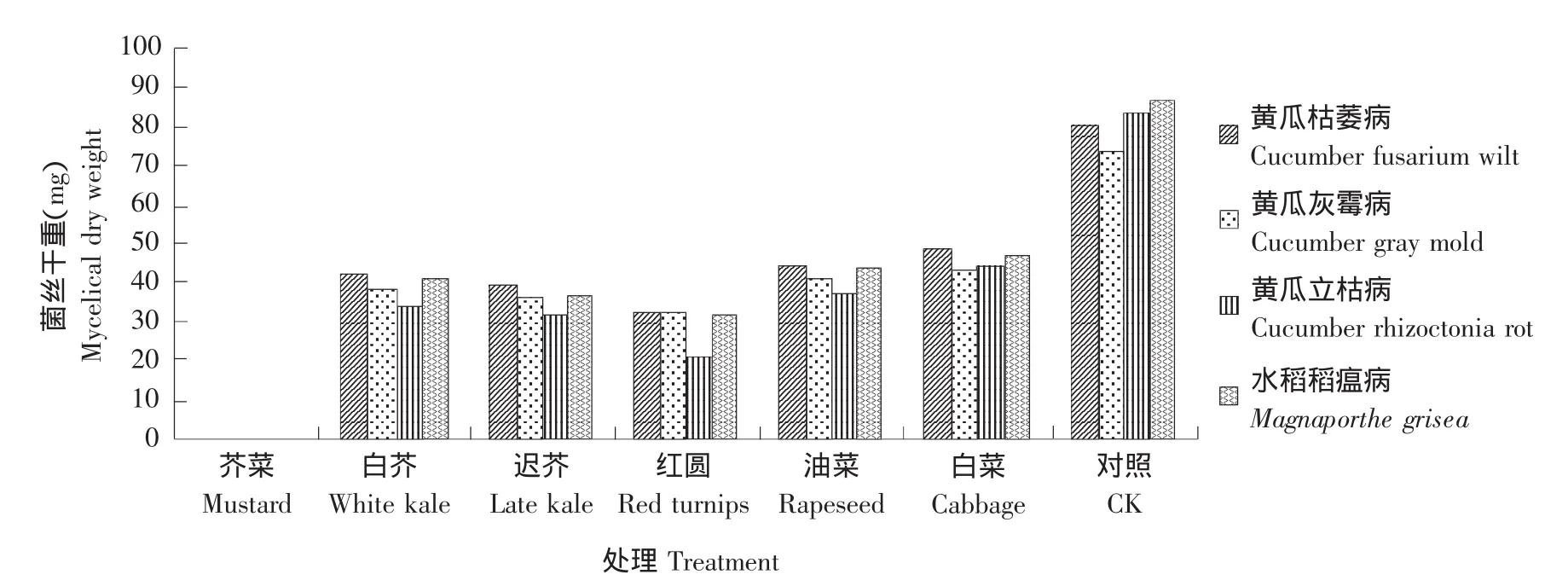
图2 六种芸薹属植物对四种土传病害病原菌生物量积累的影响Fig.2 Effect of six different treatments on four pathogens biomass accumulation
2.3 不同芸薹属植物对病原菌产孢量与孢子萌发率的影响
结果见图3。
图3表明,经六种芸薹属植物处理,四种土传病害病原菌的产孢量明显低于对照。由此可知,芸薹属植物明显抑制了植物病原菌分生孢子的产生,但抑制效果不同。小花叶芥菜对四种土传病害病原菌产孢量的抑制效果最佳,经其处理后,各菌产孢量为0。其余五种芸薹属植物抑制效果高低排序为:红圆芜菁>香港迟花芥蓝>香港白花芥蓝>苏州青油菜>春夏秋冬小白菜。除小花叶芥菜对所有病原菌生物量积累完全抑制外,另外五种植物对黄瓜枯萎病菌病原菌产孢量的抑制效果均强于其他三种土传病害。
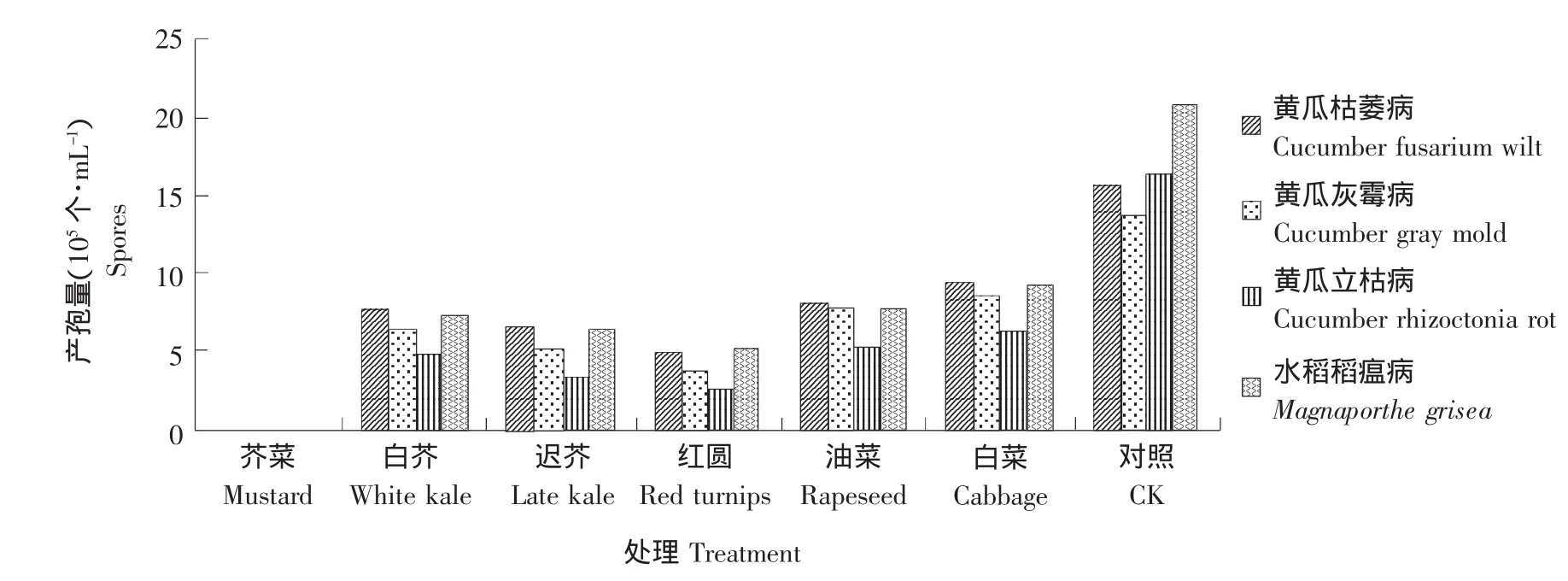
图3 六种芸薹属植物对四种土传病害病原菌产孢量的影响Fig.3 Effect of six different treatments on four pathogens spores
由表2可知,小花叶芥菜、红圆芜菁、香港迟花芥蓝、香港白花芥蓝等四种植物对四种土传病害病原菌孢子萌发有显著的抑制作用,经它们处理后,病原菌孢子萌发率显著低于对照。小花叶芥菜完全抑制四种土传病害病原菌孢子萌发,抑制效果其次的是红圆芜菁,其中对黄瓜立枯病的孢子萌发也达到了完全抑制。对病原菌孢子萌发抑制较弱的是苏州青油菜和春夏秋冬小白菜,尤其是春夏秋冬小白菜,除对黄瓜枯萎病孢子萌发有一定的抑制作用外,对另三种病害均无明显抑制效果。以上分析表明,不同芸薹属植物对土传病害病原菌孢子萌发的抑制存在差异,而且同种芸薹属植物对不同土传病害病原菌孢子萌发的抑制也存在差异。
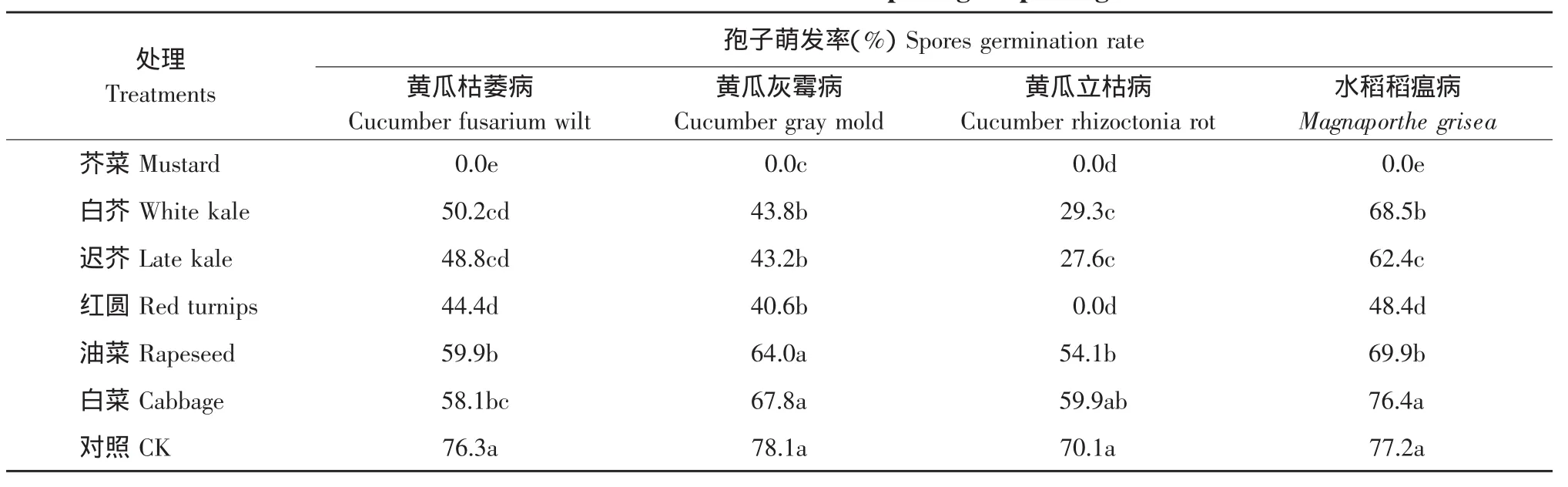
表2 六种芸薹属植物对四种土传病害病原菌孢子萌发率的影响Table 2 Effect of six different treatments on four pathogen spores germination rate
3 讨论与结论
近年来随着化学农药的使用造成有害物质在土壤中富集,不仅危害人类健康,还破坏生态平衡并对脊椎动物有毒害作用[14-17]。这推动了人们寻找更好的良性替代品[18]。而生物熏蒸由于具有污染少、危害低、减少水土流失、改善土壤肥力等优点,越来越被人们所重视[7]。诸多研究表明,芸薹属植物在防治土壤病虫害方面具有良好的效果。2006年,李明社等报道用芸薹属植物进行土壤消毒[1],效果优于太阳能和土壤还原消毒法;2007年,Larkin等报道用芸薹属植物控制多种马铃薯病虫害[8],防治效果明显;2007年,范成明等报道在对病原菌防治方面芸薹属植物要好于非芸薹属植物[19]。本研究表明,春夏秋冬小白菜、苏州青油菜、小花叶芥菜、红圆芜菁、香港迟花芥蓝和香港白花芥蓝等六种芸薹属植物对黄瓜枯萎病、黄瓜灰霉病、黄瓜立枯病和水稻稻瘟病等四种病原菌具有抑制效果,进一步证明了芸薹属植物在防治土壤病害方面的良好效果。研究中还表明,不同芸薹属植物对病原菌的抑制效果存在差异,小花叶芥菜抑制效果最好,其次为红圆芜菁、香港迟花芥蓝、香港白花芥蓝和苏州青油菜,春夏秋冬小白菜抑菌效果最弱;同种芸薹属植物对不同土传病害病原菌抑制也存在差异,试验植物对黄瓜立枯病的抑制效果要好于其他三种病害。
芸薹属植物对于病原菌的抑菌强弱,主要取决于其所含硫代葡萄糖苷的种类和含量。据文献报道,芥菜中主要硫苷成分是2-丙稀基硫苷(占85%以上)[20];芥蓝中3-丁烯基硫苷为主要硫苷[21];芜菁中最主要硫苷为3-丁烯基硫苷,其次为苯乙基硫苷[21];小白菜中的主要硫苷为3-丁烯基硫苷和1-甲氧基-3-吲哚基甲基硫苷[22];油菜中主要含有3-丁烯基硫苷和4-戊烯基硫苷(两者占80%以上)[23]。由此可以得出,本试验所选用的六种芸薹属植物所含硫代葡萄糖苷的含量和总类是不同的,它们所释放的挥发性物质的熏蒸效果也不相同,具体是哪种硫苷的分解产物在起作用,还需要进一步研究。
本试验虽然只是在实验室内检验植物提取液对四种病原菌的抑菌效果,但为今后利用芸薹属植物在土传病害的治理方面提供了理论依据,但如何最大限度地使芸薹属植物材料中的硫代葡萄糖苷快速水解成异硫氰酸酯,提高其生物熏蒸效果,还有待于在田间试验中进一步验证。
[2]Halkier B A,Gershenzon J.Biology and bioehemistry of glueosinolates[J].The Annual Review of Plant Biology,2006,57∶303-333.
[3]Riga E,Mojtahedi H,Ingham R E,et al.Green manure amendments and management of root-knot nematodes on potato in the Pacific Northwest of USA[J].Nematology Monographs and Perspectives,2004(2)∶151-158.
[4]Zasada I A,Ferris H.Nematode suppression with brassicaceous amendments application based upon glucosinolate profiles[J].Soil Biology and Biochemistry,2004,36(3)∶1017-1024.
[5]Brown P D,Morra M J.Glucosinolate containing plant tissues as bioherbicides[J].Journal of Agricultural and Food Chemistry,1995,43∶3070-3074.
[6]Kirkegaard J A,Wong P T W,Desmarchelier J M.In vitro suppression of fungal root pathogens of cereals by Brassica tissues[J].Plant Pathology,1996,45∶593-603.
[7]Matthiessen J N,Kirkegard J A.Biofumigation and enhanced biodegradation∶opportunity and challenge in soilborne pest and disease management[J].Critical Reviews in Plant Sciences,2006,25∶235-265.
[8]Larkin R P,Griffin T S.Control of soilborne potato diseases using Brassica green manures[J].Crop Protection,2007,26∶1067-1077.
[9]Lewis J A,Papavizas G C.Effect of sulfur-containing volatile compounds and vapors from cabbage decomposition on Aphanomyces euteiches[J].Phytopathology,1971,61∶208-214.
[10]Smolinska U,Morra M J,Knudsen G R,et al.Isothiocyanates produced by Brassicaceae species as inhibitors of Fusarium oxysporum[J].Plant Dis,2003,87∶407-412.
[11]Charron C S,Sams C E.Inhibition of Pythium ultimum and Rhizoctonia solani by shredded leaves of Brassica species[J].J Am Soc Hort Sci,1999,124∶462-467.
[12]Mayton H S,Olivier C,Vaughn S F,et al.Correlation of fungicidal activity of Brassica species with allyl isothiocyanate production in macerated tissue[J]Phytopathology,1996,86∶267-271.
[13]方中达.植病研究方法[M].北京∶农业出版社,1998.
[14]李云龙,李孱,李景鹏,等.微生物技术在农业和环保中的应用[J].东北农业大学学报,1996,27(4)∶406-413.
[15]Cox C.Fumigant factsheet∶metam sodium[J].Journal of Pesticide Reform,2006,26∶12-16.
[16]Schreiner R P,Ivors K L,Pinkerton J N.Soil solarization reduces arbuscular mycorrhizal fungi as a consequence of weed suppression[J].Mycorrhiza,2001(11)∶273-277.
[17]李永刚,文景芝,郝中娜.植物源杀菌剂的研究现状与展望[J].东北农业大学学报,2002,33(2)∶198-202.
[18]Martin F N.Development of alternative strategies for management of soilborne pathogens currently controlled with methyl bromide[J].Annual Review of Phytopathology,2003,41∶325-350.
[19]范成明,刘建英,吴毅歆,等.具有生物熏蒸能力的几种植物材料的筛选[J].云南农业大学学报∶自然科学版,2007,22(5)∶654-658.
[20]陈新娟.中国芸薹属蔬菜硫代葡萄糖苷及其影响因子研究[D].杭州∶浙江大学,2006.
[21]陈新娟,周胜军.3个芜菁品种硫代葡萄糖苷含量的比较研究[J].浙江农业科学,2009(2)∶415-417.
[22]何洪巨,陈杭.芸薹属蔬菜中硫代葡萄糖苷鉴定与含量分析[J].中国农业科学,2002,35(2)∶192-197.
[23]黄界颍,马友华.油菜硫甙特征功能及其测定方法[J].植物生理学通讯,2003,39(5)∶496-500.
