白细胞介素-10对脑梗死再灌注大鼠p53AIP1蛋白表达的影响
2010-08-09李科刘健任红英蒋鑫
李科,刘健,任红英,蒋鑫
脑卒中是临床常见的神经系统急症之一,以高病死率、高致残率为主要特点,抢救生命与脑功能的保护是治疗重点,可是到目前为止,治疗这类患者的手段还是乏善可陈。近几年,随着对脑卒中病理生理研究的进展,人们研究的焦点逐渐集中于如何减少脑卒中患者继发炎症反应致脑神经细胞凋亡。白细胞介素-10(IL-10)是目前研究较多的一种抗炎因子,目前认为 IL-10 能通过抑制肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)和其他前炎性细胞因子的产生减轻缺血后脑损伤,有利于神经元的修复和存活,在脑缺血中有神经保护作用[1]。
1 材料与方法
1.1 主要试剂和仪器
36 只 6~8 周成年 SD 雄鼠,清洁级,体重200~250 g,实验动物由岭南实验动物中心提供。兔抗大鼠 p53AIP1 抗体为英国 Abcam 公司产品;羊抗兔 HRG 标记二抗为美国 SANTA Crus公司产品;重组大鼠白细胞介素-10(rrIL-10)为英国 Peprotech EC 公司产品;总蛋白提取试剂盒为北京普利莱公司产品;Tunel 法凋亡检测试剂盒为美国默克公司产品(目录号:QIA39);SDS-PAGE胶配制试剂盒为北京碧云天公司产品;HRP 标记的GAPDH 内参抗体为上海康成生物工程有限公司产品;26 号尼龙线栓为北京沙东生物技术有限公司产品;浓缩多聚赖氨酸为广州威佳公司产品。
1.2 方法
1.2.1 大鼠脑梗死再灌注模型的构建 36 只大鼠随机抽取 6 只作为假手术组,其余 30 只为手术组。大鼠禁食 12 h 与禁水 6 h 后,氯胺酮100 mg/kg 大鼠肌肉注射麻醉。采用改良 MCAO(middle cerebral artery occlusion)法[2],将预先经多聚赖氨酸浸渍,60 ℃ 烘干处理过的直径为 0.26 mm的线栓经大鼠右侧颈内动脉(carotid artery,CA)置入约 18~22 mm(根据动物大小调整插入线栓的深度),阻塞右侧大脑中动脉,记录梗阻开始时间,固定外端的线栓并标记留在皮肤外面线栓的长度,缝合皮肤。大鼠麻醉未苏醒时注意保暖。缺血 2 h后,拔出线栓约 10 mm,使线栓退至颈总动脉杈处,实现脑缺血再灌注。
1.2.2 动物模型评分 动物模型评分标准(Zea longa评分标准)[2]如下:
0 分:无神经缺损症状,活动正常;
1 分:不能完全伸展对侧前肢(轻度局灶性神经功能缺损);
2 分:行走时身体向偏瘫侧转圈(中度局灶性神经功能缺损);
3 分:行走时向偏瘫侧倾倒(重度局灶性神经功能缺损);
4 分:不能自发行走,意识丧失。
评分 1~3 分即符合本实验要求,否则另选大鼠再行手术补足手术组,符合要求的大鼠随机分为2组,一组经尾静脉给予 rrIL-10(称为 IL-10组),按照药物/大鼠 = 10 mg/kg 的比例经鼠尾静脉泵入浓度 20 mg/L 的 IL-10,速度为 15 µg/h;另 1组不做任何干预,为对照组。假手术组:除不插线栓外,其余操作与对照组相同。
1.2.3 大鼠分组 各组内大鼠分别按照术后 24、48 和72 h 随机分为 3 个亚组,于相应时间点处死,快速断头取右侧大脑;沿视交叉处冠状切开,向枕部方向切取约 2 mm 厚脑组织,液氮快速冷冻,–70 ℃ 冷藏备用。
1.2.3.1 石蜡切片与 HE 染色 样本常规中性甲醛固定过夜-梯度酒精、二甲苯脱水-浸蜡-包埋-切片(厚度3 μm)-HE染色-光镜观察。
1.2.3.2 冰冻切片与 Tunel 染色 样本规冰冻切片机切片,厚度 5 μm 冰冻切片应用 Tunel 染色试剂盒染色,程序严格按照试剂盒要求进行;防荧光淬灭封片,荧光显微镜(485/535 nm)观察。
1.2.4 p53AIP1 蛋白表达的测定
1.2.4.1 蛋白样品制备 蛋白提取采用北京普利来公司的总蛋白试剂盒,严格按照说明书进行。每100 mg 脑组织提取的总蛋白溶解在 1 ml 2.5%SDS 溶液中备用。
1.2.4.2 SDS-PAGE 电泳 北京普利来公司生产的配胶试剂盒 12% 分离胶、5% 浓缩胶,100 V 恒压电泳 2 h,170 mA 恒流湿式电转 PVDF 膜 2 h;1xTBST 洗膜 3 次;5% 脱脂奶粉溶液封闭 2 h,1∶1000 一抗孵育 4 ℃ 过夜,1xTBST 洗膜 3 次;1∶2000 二抗孵育 2 h,1xTBST 洗膜 3 次;北京普利来公司电致化学(ECL)发光液发光处理,X 线曝光检查蛋白条带;GAPDH 内参实验过程同上。
凝胶成像结果使用 Gelpro Analyzer 4 软件分析蛋白条带光密度值,数据引入 EXCEL。数据采用 SPSS13.0 进行统计学分析。统计学处理所得数据采用的比较采用单因素定量资料的方差
1.3 统计学处理
分析。方差齐,组间多重比较采用 LSD 分析,方差不齐,组间多重比较采用 Dunnett’s T3 分析;以P < 0.05 认为差异有统计学意义。多个总体均数的两两比较采用 q 检验,以 P < 0.05 为差异有统计学意义。
2 结果
2.1 各组动物模型评分情况(见表 1)

表1 各组动物评分结果Table 1 Score results in each group
2.2 石蜡切片、HE 染色
观察可见对照组梗死区细胞稀少,广泛的神经元坏死,细胞溶解伴软化灶形成;细胞结构模糊,细胞体缩小变形,染色加深,核消失,血管可见粒细胞附壁及浸润;细胞及组织间隙水肿,梗死灶周围可见“气球样改变”和间质水肿,水肿以皮层下结构及梗死区向非梗死区的移行区为重。IL-10组相对较轻。假手术组则无上述病理改变(图 1)。
2.3 冰冻切片、Tunel 染色
Tunel 免疫荧光显微镜不同波长(485/535 nm)观察也可见到无论哪个时间段,IL-10组细胞凋亡情况均较对照组轻;假手术组极少见凋亡细胞(图 2)。
2.4 p53AIP1 蛋白表达情况

图1 各组大鼠不同处死时间的石蜡切片 HE 染色结果(A:假手术组 24 h;B:对照组 24 h;C:白细胞介素-10组 24 h;D:假手术组 48 h;E:对照组 48 h;F:白细胞介素-10组 48 h;G:假手术组 72 h;H:对照组 72 h;I:白细胞介素-1072 h)Figure 1 The HE staining of paraffin section at all time piont of treatment groups.A: Sham group after 24 h; B: Control group after 24 h; C: IL-10 group after 24 h; D: Sham group after 48 h; E: Control group after 48 h; F: IL-10 group after 48 h; G: Sham group after 72 h; H: Control group after 72 h; I: IL-10 group after 72 h.
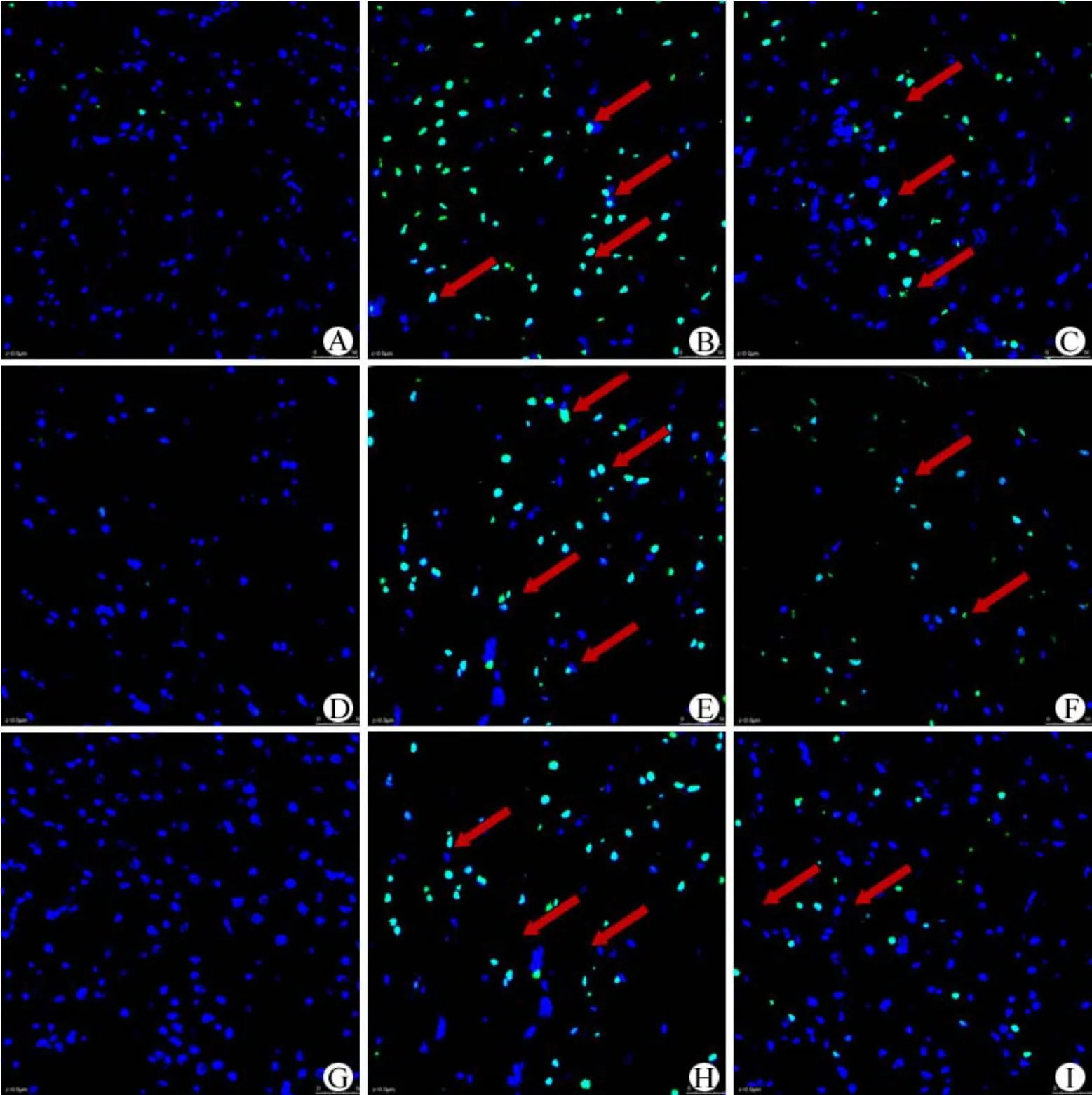
图2 各组大鼠不同处死时间的 Tunel 染色冰冻切片免疫荧光(485/535 nm)(A:假手术组 24 h;B:对照组 24 h;C:白细胞介素-10组 24 h;D:假手术组 48 h;E:对照组 48 h;F:白细胞介素-10组 48 h;G:假手术组 72 h;H:对照组 72 h;I:白细胞介素-1072 h)Figure 2 The Tunel staining of frozen sections with immunofluorescence at all time piont of treatment groups.A: Sham group after 24 h; B: Control group after 24 h; C: IL-10 group after 24 h; D: Sham group after 48 h; E: Control group after 48 h; F: IL-10 group after 48 h; G: Sham group after 72 h; H: Control group after 72 h; I: IL-10 group after 72 h.
假手术组 p53AIP1 蛋白表达各时间点均为弱阳性[正常脑组织里有微量的凋亡细胞存在,可产生微量的凋亡蛋白。光密度比值(IOD ratio)≤0.05],手术组各时间点的 p53AIP1 蛋白表达均为阳性光[密度比值(IOD ratio)> 0.05];手术组与假手术组各时间点 p53AIP1 蛋白表达均有统计学意义(各时间点 P < 0.01),且手术组中的 IL-10组和对照组各时间点 p53AIP1 蛋白表达均有统计学意义(各时间点 P < 0.01)。结果见图 3 和4。

图3 蛋白质印迹检测 p53AIP1 蛋白表达(A:白细胞介素-10组;B:对照组;C:假手术组)Figure 3 The expression of protein p53AIP1 was detected by Western blotting.A: IL-10 group; B: Control; C: Sham group.

图4 p53AIP1蛋白光密度值Figure 4 The IOD ratio of p53AIP1
3 讨论
脑缺血一定时间恢复血液供应后,其功能不但未能恢复,却出现了更加严重的脑功能障碍,称之为脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIR)。脑缺血再灌注损伤目前认为可能与自由基的生成、细胞内钙超载、兴奋性氨基酸毒性、白细胞高度聚集和高能磷酸化合物的缺乏等有关。急性局灶性脑缺血引起的缺血中心区死亡以细胞坏死为主,缺血中心区与正常脑组织之间的所谓半暗带区域内的神经元细胞于再灌注后出现了迟发性神经元死亡(delayed neuronal death,DND),此DND 表现为细胞凋亡(programmed cell death,PCD),确切机制目前仍不完全清楚,尚需进一步深入研究。而抢救这些 DND 神经元、减少神经元的凋亡正是临床上的治疗重点之一。
p53 调节的凋亡诱导蛋白 1(p53-regulated apoptosis-inducing protein l,p53AIP1)基因是2000年由日本东大医科学研究所中村佑辅教授[3]带领的研究小组首先发现的,其研究历史短暂;目前认为它是p53 下游的一个促凋亡基因,其表达受野生型 p53 的调控诱导,在 p53 依赖性的凋亡调控通路中起重要作用。在 p53AI P1 介导的线粒体凋亡途径中,p53AIP1 作为 BH3-only 样蛋白,转位于线粒体后激活 Bax[4]。Bax 在线粒体膜上寡聚化,形成一个跨膜通道,导致线粒体内外膜之间的电势能降低,细胞色素 C 释放,启动细胞凋亡途径。在 p53 依赖性的促凋亡调控通路中,p53AIP1 通过调节线粒体膜电化学梯度的方式介导细胞凋亡。而其在体内的具体促凋亡机制目前仍不清楚。
IL-10 于 1989 年由 Dnax 研究所[5]首次在小鼠的 TH2 细胞培养上清中发现,1990 年,Moore将其命名为 IL-10[6-7]。IL-10 具有广泛的生物学活性,在机体中主要起着免疫调节(免疫抑制及免疫刺激)和抗炎症两大作用。Dietrich 等[8]在全脑缺血小鼠海马定量病理组织学分析中发现,联合应用IL-10 较单纯应用低温疗法更能提高神经元存活率。在外伤性脑损伤,静脉或皮下给予 IL-10,能提高神经元的修复和存活能力。Van Exel 等通过对伦敦 599 名 85 岁以上老人血清 IL-10 水平分析后,发现低 IL-10 水平人群发生中风的危险性较高,指出抗炎因子 IL-10 在缺血性脑血管病中起着重要的保护作用[1,9]。Clarkson 等[10]发现,去除IL-10 的小鼠大脑中动脉闭塞(MCAO)后脑梗死的面积较正常野生型小鼠大 30%,在体外,其大脑皮质细胞培养物对兴奋性神经毒性的敏感性增加,对缺血缺氧耐受性较野生型小鼠差,而将重组IL-10 加入培养液后,则可减轻兴奋性神经毒性和缺血缺氧造成的损伤,结果说明外源性及内源性IL-10 在脑缺血时都具有神经保护作用。以上研究证明,对于脑损伤,应用 IL-10 治疗可明显减弱炎症反应,产生重要的抗炎保护作用。
但目前对于 IL-10 的神经保护作用机制尚不十分了解,推测IL-10 在急性脑缺血后抑制炎性反应的机制,主要通过以下 3 个途径:①减少 γ 干扰素(IFN-γ)、白细胞介素-1(IL-1)和TNF-α 等前炎性细胞因子的合成[11-12];②抑制炎性细胞因子受体表达;③降低炎性细胞因子活性[13]。IL-10 的抗炎保护作用始终与TNF-α水平降低有关,国外很多文献在全身性疾病研究中有所报道[14-15]。IL-10能对多种类型细胞发挥免疫抑制和免疫激励效力,在中枢神经系统具有神经保护和神经营养作用,是一种与脑缺血损伤和损伤修复过程相关的重要抗炎细胞因子。
本实验在观察 MCAO 大鼠应用 IL-10 与细胞凋亡的关系中,发现应用 IL-10 后无论哪个时间段,MCAO 大鼠脑组织细胞凋亡情况均明显低于对照组(P < 0.01)。
本实验在研究中发现,脑组织 p53AIP1 蛋白在脑梗死再灌注后含量是呈动态变化的。发病 24 h测得 p53AIP1 蛋白显著增高,48 h达高峰,随后逐渐下降,但发病第 3 天对照组仍显著高于 IL-10组。
总之,我们认为脑缺血急性期的机体免疫系统处于激活状态,p53AIP1 蛋白在神经元细胞损伤凋亡过程中扮演了一定角色,但具体情况尚缺乏足够的研究;IL-10 是一种与脑缺血损伤和损伤修复过程相关的重要抗炎细胞因子,具有神经保护和神经营养作用。通过本实验,我们可以确定 IL-10 对p53AIP1 蛋白的表达具有一定的抑制作用,其机制尚待进一步的研究;为将来 IL-10 应用于临床积累经验。
[1]Huber TS, Gaines GC, Welborn MB 3rd, et al.Anticytokine therapies for acute inflammation and the systemic inflammatory response syndrome: IL-10 and ischemia/reperfusion injury as a new paradigm.Shock, 2000, 13(6):425-434.
[2]Longa EZ, Weinstein PR, Carlson S, et al.Reversible middle cerebral artery occlusion without craniectomy in rats.stroke, 1989, 20(1):84-91.
[3]Oda K, Arakawa H, Tanaka T, et al.p53AIP1, a potential mediator of p53-dependent apoptosis, and its regulation by Ser-46-phosphorylated p53.Cell, 2000, 102(6):849-862.
[4]Yang ZY, Yu P.BH3-only protein and apoptosis.J Xiangnan Univ(Med Sci), 2006, 8(2):70-73.(in Chinese)杨志英, 余平.BH3-only蛋白与凋亡.湘南学院学报(医学版), 2006,8(2):70-73.
[5]Moore KW, Vieira P, Fiorentino DF, et al.Homology of cytokine synthesis inhibitory factor (IL-10) to the Epstein-Barr virus gene BCRFI.Science, 1990, 248(4960):1230-1234.
[6]Liu N, Chen RH, Zheng A, et al.The study of the protective mechanism of interleukin-10 on cerebral ischemia in rats.Chin J Cerebrovasc Dis, 2004, 1(4):178-181.(in Chinese)刘楠, 陈荣华, 郑安, 等.白细胞介素-10对大鼠脑缺血的保护作用.中国脑血管病杂志, 2004, 1(4):178-181.
[7]Xia CF, Huo Y, Tang CS.The study of the signal transduction and Cell Biology’s affection of Interleukin-10.Foreign Med Scie (Section Immunol Foreign Med Sci), 2001, 24(5):269-272.(in Chinese)夏春芳, 霍勇,唐朝枢.106 白细胞介素10的细胞生物学效应及其信号转导.国外医学(免疫学分册), 2001, 24(5):269-272.
[8]Dietrich WD, Busto R, Bethea JR.Postischemic hypothermia and IL-10 treatment provide long-lasting neuroprotection of CA1 hippocampus following transient global ischemia in rats.Exp Neurol,1999, 158(2):444-450.
[9]van Exel E, Gussekloo J, Houx P, et al.Atherosclerosis and cognitive impairment are linked in the elderly.The Leiden 85-plus Study.Atherosclerosis, 2002, 165(2):353-359.
[10]Clarkson AN, Liu H, Schiborra F, et al.Angiogenesis as a predictive marker of neurological outcome following hypoxia-ischemia.Brain Res, 2007, 1171:111-121.
[11]Rabuffetti M, Sciorati C, Tarozzo G, et al.Inhibition of caspase-1-like activity by Ac-Tyr-Val-Ala-Asp-chloromethyl ketone induces long-lasting neuroprotection in cerebral ischemia through apoptosis reduction and decrease of proinflammatory cytokines.J Neurosci,2000, 20(12):4398-4404.
[12]Sun YM, Tian Y, Li X, et al.Effect of atorvastatin on expression of IL-10 and TNF-alpha mRNA in myocardial ischemia-reperfusion injury in rats.Biochem Biophys Res Commun, 2009, 382(2):336-340.
[13]Zhai QH, Futrell N, Chen FJ.Gene expression of IL-10 in relationship to TNF-alpha, IL-1beta and IL-2 in the rat brain following middle cerebral artery occlusion.J Neurol Sci, 1997, 152(2):119-124.
[14]Stoll G, Jander S, Schroeter M.Cytokines in CNS disorders:neurotoxicity versus neuroprotection.J Neural Transm Suppl, 2000,59:81-89.
[15]Cavriani G, Domingos HV, Oliveira-Filho RM, et al.Lymphatic thoracic duct ligation modulates the serum levels of IL-1beta and IL-10 after intestinal ischemia/reperfusion in rats with the involvement of tumor necrosis factor alpha and nitric oxide.Shock,2007, 27(2):209-213.
