菌丝生长速度与呼吸消耗及胞外酶活性的关系*
2010-08-08倪新江赵艳丽
倪新江,李 洁,初 洋,赵艳丽,尹 茜
(烟台大学化学生物理工学院,山东 烟台 264005)
在原种和栽培种生产中发现,在相同培养条件下,不同食用菌的菌丝生长速度具有一定差异。然而,不同食用菌菌丝生长速度与它们的胞外酶活性大小和呼吸消耗量的关系,尚未见报道。以棉籽壳为主料,对6种食用菌原种培养期间菌丝生长速度、呼吸消耗量和胞外酶活性大小进行跟踪测定,旨在为食用菌营养生理研究提供基础资料。
1 材料与方法
1.1 菌种
灵芝、平菇、金针菇、刺芹侧耳、黄伞和香菇,均为烟台大学应用微生物实验室保藏菌种。
1.2 试剂
羧甲基纤维素钠、木聚糖、果胶和半乳糖醛酸均为Sigma公司产品,其它多为国产分析纯。
1.3 培养基配方
棉籽壳88%、麦麸10%、石膏1%、葡萄糖1%。
1.4 装瓶、灭菌、接种、培养
每个罐头瓶装棉籽壳 79.2 g、麦麸9 g、石膏0.9 g、葡萄糖0.9 g,水126 mL。拌料、装瓶、灭菌按常规方法。接平板尖端菌丝 (用灭菌的打孔器切割)约1 cm2,25℃恒温培养,满瓶后再培养10 d。
1.5 菌丝生长速度测定
接种后,记录菌丝满瓶天数,每种食用菌用10瓶计算出平均满瓶天数。
1.6 粗酶液的制备
在菌丝生长发育的不同时期,取3瓶发菌培养基充分混匀后,从中取20 g加水100 mL,20℃浸提4 h,过滤后, 4000 r·min-1离心 10 min, 上清液即为粗酶液。
1.7 酶活性的测定
β-葡萄糖苷酶、羧甲基纤维素酶 (CMC酶)和淀粉酶活力单位分别参照文献 [1~6]的方法。
1.8 呼吸消耗计算方法
分别取接种前、满瓶和满瓶后10 d各3瓶培养基,80℃烘干后称重。菌丝满瓶期呼吸消耗为接种前培养基干重减去满瓶时培养基干重;菌丝生理成熟期呼吸消耗为满瓶时培养基干重减去满瓶10 d时培养基干重;每天呼吸消耗为生长期内呼吸消耗总量与生长期天数之比。
2 结果与分析
2.1 不同食用菌菌丝生长速度
6种食用菌菌丝满瓶天数与呼吸消耗比较情况见表1。
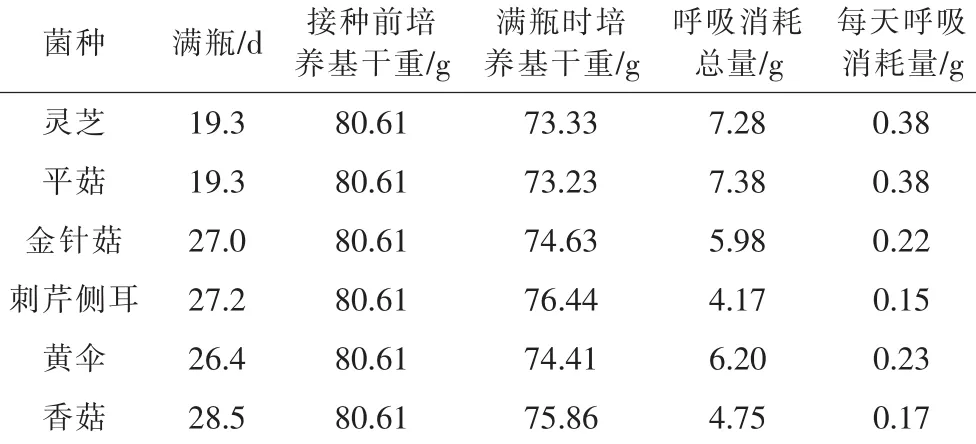
表1 6种食用菌菌丝满瓶天数与呼吸消耗比较
表1显示,6种食用菌在棉籽壳培养基上培养,平菇与灵芝菌丝生长速度相同并且最快,金针菇、刺芹侧耳和黄伞次之,香菇菌丝生长速度最慢。
2.2 菌丝满瓶期的呼吸消耗
表1显示,菌丝满瓶时,灵芝和平菇的呼吸消耗总量大致相同,分别为7.28 g和7.38 g,这2种食用菌平均每天呼吸消耗最大;金针菇和黄伞平均每天呼吸量次之;香菇和刺芹侧耳平均每天呼吸量较小。
2.3 菌丝生理成熟期的呼吸消耗
在生产上,当以棉籽壳为主料培养原种时,菌丝满瓶后往往需要继续培养7 d~10 d,本研究采用10 d。菌丝满瓶后10 d,这一生长期也称之为菌丝生理成熟期。6种食用菌菌丝生理成熟期呼吸消耗比较见表2。
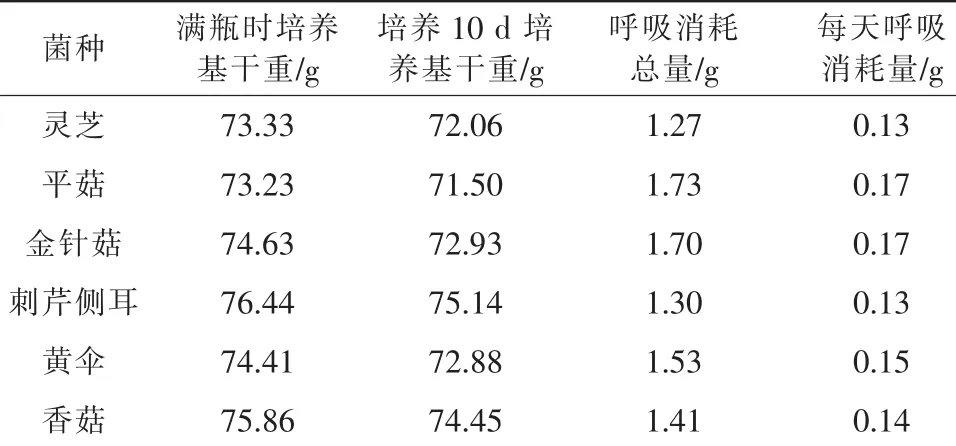
表2 6种食用菌菌丝生理成熟期呼吸消耗比较
表2显示,在菌丝生理成熟期,6种食用菌的呼吸消耗均小于菌丝满瓶期的呼吸消耗,其中灵芝和平菇最明显,菌丝生理成熟期的平均呼吸消耗分别为菌丝满瓶期的34%和45% (由表1、表2推算出)。由于接种后,菌瓶中的菌丝生物量是一个逐渐增多直至满瓶的过程,所以从接种到满瓶这一生长期,菌瓶中的平均菌丝生物量只相当于满瓶后的1/2左右,因而,从表1和表2数据分析可以推测出,6种食用菌的菌丝生理成熟期的呼吸消耗远远小于菌丝满瓶期的呼吸消耗。
2.4 不同食用菌原种生长期间胞外酶活性均值比较
胞外酶活性均值是指在原种生长的不同时期,6次取样测定胞外酶活性所得数据的平均值,它能够简明地反映出原种培养期间某种胞外酶活性的大小,见表3。
表3显示,灵芝除过氧化物酶、淀粉酶和β-葡萄糖苷酶活性低于、略低于或相当于其他5种食用菌相应的胞外酶活性外,另外5种胞外酶活性均高于其他5种食用菌。也就是,从总体上看,灵芝的胞外酶活性比其他5种食用菌高;平菇、刺芹侧耳、黄伞和香菇的胞外酶活性差异不大;金针菇的胞外酶活性最小。

表3 6种食用菌原种生长期间胞外酶活性均值
3 讨论
由表1结合表2可以看出,菌丝生长速度较快的是灵芝和平菇,平均每天呼吸消耗较大;菌丝生长速度较慢的金针菇、刺芹侧耳、黄伞和香菇。据此可得出,食用菌菌丝生长速度与其呼吸消耗正相关。旺盛的呼吸代谢所提供的能量和中间代谢产物能够为菌丝的快速生长提供物质保证。菌丝满瓶后进入生理成熟期,6种食用菌的呼吸消耗均大大降低,这可能是食用菌共有的特征。这进一步表明,尽管菌丝生理成熟期是菌丝细胞内生物量的积累过程,但在这一阶段菌丝体总体代谢水平较低[7]。
由于没有子实体出现,原种培养期间平均每天呼吸消耗可粗略反映出培养基中有机物质的降解速率。由表1、表2结合表3可以看出,平菇平均每天有机物降解量最大,但其胞外酶活性却比灵芝小得多;刺芹侧耳平均每天有机物降解量最小,约为平菇的51% (由表1、表2推算出),但其胞外酶活性却与平菇差异不大;金针菇的胞外酶活性最小,但其有机物降解量与黄伞处于同一水平,比刺芹侧耳和香菇高。这些结果表明,不同的食用菌对培养基中有机物的降解速率与其胞外酶活性的相对大小没有相关性。这是因为食用菌对有机物的降解是一个相当复杂的生理生化过程,不同食用菌对有机物的降解速率不仅取决于胞外酶活性的大小,还与其酶解产物能否及时与酶分离等许多其他因素有关,这可能是由食用菌的基因决定的。
[1]Saswati S, Sengupta S.β-Glucosidase production by the mycelial culture of the mushroom Termitomyces clypeatus[J].Enzyme Microb Technol,1990(12):309-314.
[2]Mandels M,Hontz L,Nystrom,et al.Enzymatic hydrolysis of waste cellulose[J].Biotechnol Bioeng,1974(16):1471-1493.
[3]王玉万,王云.构菌栽培过程中对木质纤维素的降解和几种多糖分解酶的活性变化[J].微生物学通报,1989,16(3):137-189.
[4]Shamala TR,Screekantian KR.Production of cellulases and D-xylanase by some selected fungal isolases[J].Enzyme Microb Technol,1986,8(3):178-182.
[5]潘迎捷,陈明杰,郑海歌,等.香菇和平菇生长发育中漆酶、酪氨酸酶和纤维素酶活性的变化[J].上海农业学报,1991,7(2):21-26.
[6]张志良.植物生理实验指导 (第二版)[M].北京:高等教育出版社,1990.
[7]倪新江,冯志勇 ,梁丽琨,等.鸡腿菇对棉子壳的降解与转化[J].微生物学通报,2002,29(2):1-4.
