酒石酸唑吡坦口溶片的药动学及生物等效性研究
2010-08-06徐家根初立梅许静徐康康南京医科大学附属南京儿童医院南京市210008
徐家根,初立梅,许静,徐康康(南京医科大学附属南京儿童医院,南京市210008)
唑吡坦(Zolpidem)属咪唑吡啶类药,是新一代镇静剂,通过选择性作用于γ-氨基丁酸(GABA)a受体,增加GABA的传递,与ω1受体结合后,增加GABA对GABAa结合位点的亲和性,从而导致氯离子通道开放,使氯离子流入神经细胞内,引起细胞膜超极化,抑制神经细胞元激动[1]。临床常用于治疗偶发性、暂时性、慢性失眠症,口服吸收快,起效迅速,能缩短睡眠潜伏期,减少夜间醒觉次数,增加总的睡眠时间,提高睡眠质量。本研究旨在建立一种快速、灵敏、专属性强、操作简便的高效液相色谱-荧光(HPLC-FLU)法,用以测定血浆中唑吡坦浓度,考察健康志愿者自愿交叉口服受试制剂与参比制剂后,唑吡坦在体内的经时过程,评价2种制剂的生物等效性,为临床合理用药及其新药报批提供试验依据。
1 材料
1.1 仪器
1100系列高效液相色谱仪,包括二元高压泵、在线真空脱气机、自动进样器及其温控系统、半微量池可变紫外检测器和荧光检测器、化学高级色谱数据工作站(美国Agilent公司);十万分之一电子天平(瑞士Toledo Mettler公司);低温离心机(上海科学仪器厂);超纯水仪(美国Millipore公司)。
1.2 试药
受试制剂:酒石酸唑吡坦口溶片(香港澳美制药股份有限公司,规格:每片2.5 mg,批号:081117);参比制剂:酒石酸吡唑坦片(乐坦,规格:每片10 mg,湖南千金湘江药业股份有限公司,批号:080215);酒石酸吡唑坦标准品(香港澳美制药股份有限公司,纯度:99.8%);甲醇为色谱纯,其它试剂为分析纯,试验用水为自制超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Zorbax C18(150 mm×3.0 mm,3.5 μm);流动相:甲醇-水(含1%醋酸溶液)(40∶60);检测波长:激发波长=254 nm、发射波长=390 nm;柱温:22 ℃;流速:0.3 mL·min-1;进样量:2 μL。在该色谱条件下,高效液相色谱图见图1。
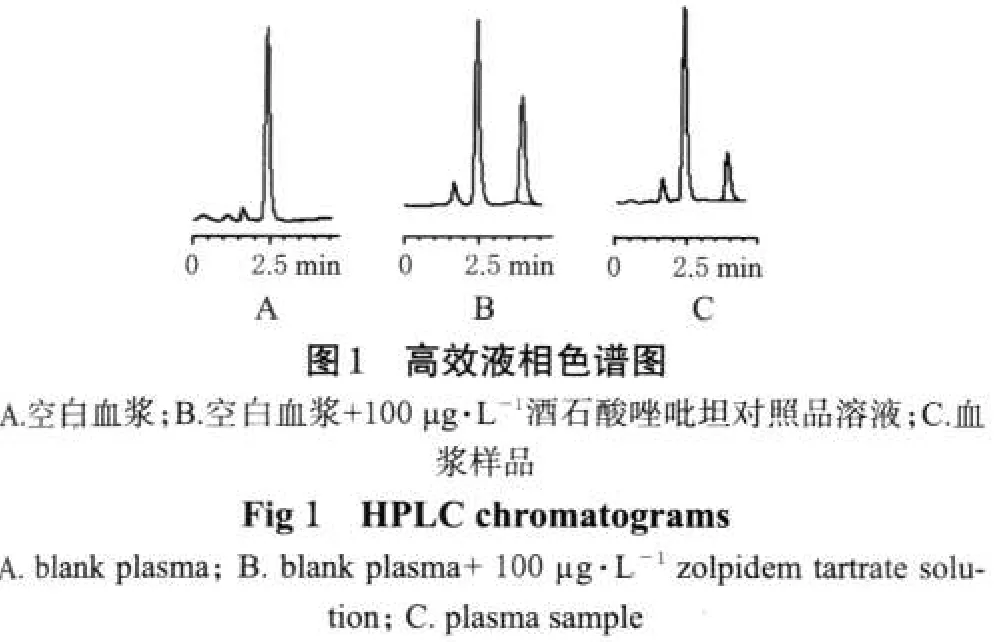
2.2 试验对象
18名男性健康受试者,体质量(66.2±4.7)kg,年龄(23.3±2.9)岁,均为南京在校大学生。经体检证明肝、肾功能正常,心电图正常。试验前2周及试验期间未服用其它任何药物。试验期间统一饮食。本试验经南京医科大学附属南京第一医院医学伦理委员会审批同意,受试者试验前均签署知情同意书。
2.3 试验方案
采用随机自身对照周期交叉试验设计,18名男性受试者随机分成2组,一组先口服受试制剂,另一组口服参比制剂,剂量为7.5、10 mg。服药方式:志愿者禁食过夜(10 h以上),次日早晨7∶00空腹服药,服普通片时用温开水200 mL送服,服口溶片时无需饮水(特殊情况下用10 mL温水冲服),服药4 h后统一进标准餐。间隔2周进行交叉试验。受试者在给药前均抽取空白血,并于口服受试制剂后0.083、0.25、0.5、0.75、1、1.5、2、3、4、5、6、7、9 h时,口服参比制剂后0.25、0.5、0.75、1、1.5、2、3、4、5、6、7、8、10 h时采血3 mL于肝素化试管中,分离出血浆,-35℃保存待测。血样采集在临床监护室中进行,以有经验丰富并经过《药物临床试验质量管理规范》(GCP)培训的医护人员进行监护,及时记录试验期间出现的不良反应。
2.4 血浆样品处理
精密加入血浆样品0.2 mL于离心管中,加入甲醇0.7 mL,涡旋3 min,于16 000 r·min-1离心3 min。自动进样器精密吸取上清液2µL进样分析。
2.5 标准曲线的制备
所建立的高效液相色谱(HPLC)法,吡唑坦峰形良好,无杂峰干扰测定,基线平稳,吡唑坦出峰时间在3.9 min左右。应用加权最小二乘法在2、5、10、20、50、100、300 µg·L-1的标准系列浓度下,按“2.4”项下“加入甲醇0.7 mL”起操作,每种浓度做5份样品,记录色谱图及吡唑坦峰面积。以吡唑坦峰面积平均值(As)对血药浓度(C)作回归计算,得回归方程:As=0.196 75C+0.013 24(r=0.999 5,权重系数W=1/C*C)。定量下限浓度为2 µg·L-1。
2.6 回收率及精密度试验
取离心管数支,分别取吡唑坦标准液适量于离心管中,用甲醇配成含吡唑坦浓度分别为5、20、100 µg·L-1的溶液,每份0.5 mL,以氮气流吹干后,精密加入双重蒸馏水0.2 mL和甲醇0.7 mL溶解残渣,离心后精密吸取2 μL进样分析,记录色谱图,计算峰面积As。另取离心管数支,于离心管中精密加入不同量的吡唑坦标准液适量,以氮气流吹干后,精密加入空白血浆0.2 mL,涡旋15 s,配成含吡唑坦浓度分别为5、20、100 µg·L-1的含药血浆,每种浓度各做5份样品,加入甲醇0.7 mL,涡旋3 min,于16 000 r·min-1离心3 min,精密吸取2 μL上清液进样分析。记录色谱图,计峰面积Ai,上述Ai和As的比值即为唑吡坦的绝对回收率(R),即R=Ai/As×100%。另取离心管数支,于离心管中精密加入不同量的吡唑坦标准液适量,以氮气流吹干后,精密加入空白血浆0.2 mL,涡旋15 s,配成含吡唑坦浓度分别为5、20、100 µg·L-1的含药血浆,按“2.4”项下“加入甲醇0.7 mL”起操作,每种浓度各做15份样品(3 d 3批次),记录色谱图,记下峰面积(A)代入相应标准曲线,计算求得日内与日间精密度,结果见表1。
表1 回收率及精密度试验结果(±s ,n=3)Tab 1 Results of recovery and precision test(±s ,n=3)
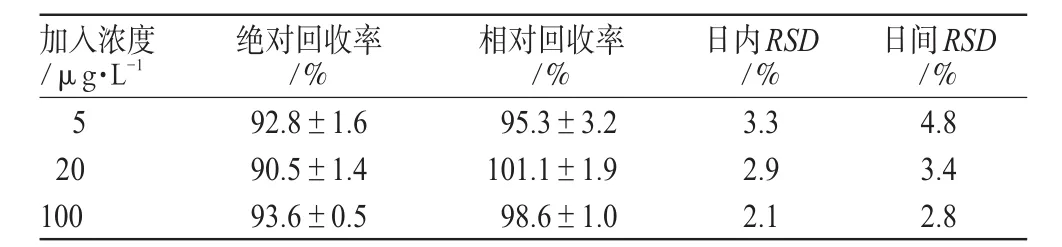
表1 回收率及精密度试验结果(±s ,n=3)Tab 1 Results of recovery and precision test(±s ,n=3)
加入浓度/μg·L-1 5 20 100日间RSD/%4.8 3.4 2.8绝对回收率/%92.8±1.6 90.5±1.4 93.6±0.5相对回收率/%95.3±3.2 101.1±1.9 98.6±1.0日内RSD/%3.3 2.9 2.1
2.7 样品稳定性试验
取干净离心管数支,按“2.5”项下方法制备含唑吡坦浓度分别为5、20、100 µg·L-1的标准含药血浆,平行制备5份,一份配制好后按“2.4”项下方法处理,立即进样分析;一份沉淀后4℃放置4 h同法操作;一份室温放置6 h后同法操作;一份配置好后置冰箱中冷冻保存21 d后取出解冻;另一份在21 d内反复冻融3次,然后同法操作。各浓度样本测定值与加入浓度的RSD均<10%,表明样品在上述条件下稳定性良好。稳定性考察结果见表2。
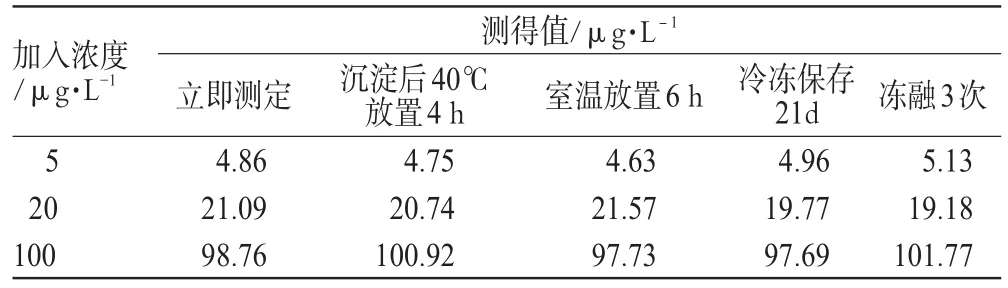
表2 稳定性考察结果Tab 2 Results of stability test
方法学验证结果表明,本方法符合《药物制剂人体生物利用度和生物等效性试验指导原则》生物样品分析要求。本方法特异性强、灵敏度高,适用于唑吡坦的药动学和生物等效性研究,3个浓度的质控样品与受试者血样同步测定,其RSD均<10%。
2.8 数据处理与生物等效性评价方法
志愿者的药-时数据,经BAPP2.3软件处理,用非房室模型法估算药动学参数,达峰浓度(Cmax)和达峰时间(tmax)采用实测值,药-时曲线下面积(AUC)用梯形面积法求得(AUC0~τ和AUC0~∞)。受试制剂的相对生物利用度计算公式为F=AUC0~τ(受试制剂)/AUC0~τ(参比制剂)×100%;t1/2=0.693/λz,λz为末端相消除速率常数。对受试制剂和参比制剂的主要药动学参数进行方差分析、双单侧t检验,考察2种制剂是否具有生物等效性。
2.9 药-时曲线
18名健康志愿者交叉口服酒石酸唑吡坦口溶片7.5 mg和酒石酸吡唑坦片10 mg后,用HPLC-FLU法分别测定各时间点血浆中唑吡坦的浓度,平均药-时曲线见图2。
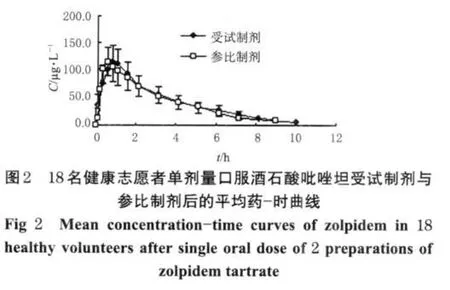
2.10 主要药动学参数
18名健康志愿者单剂量口服酒石酸唑吡坦口溶片7.5 mg和酒石酸吡唑坦片10 mg后,用非房室模型估算其主要药动学参数,见表3。
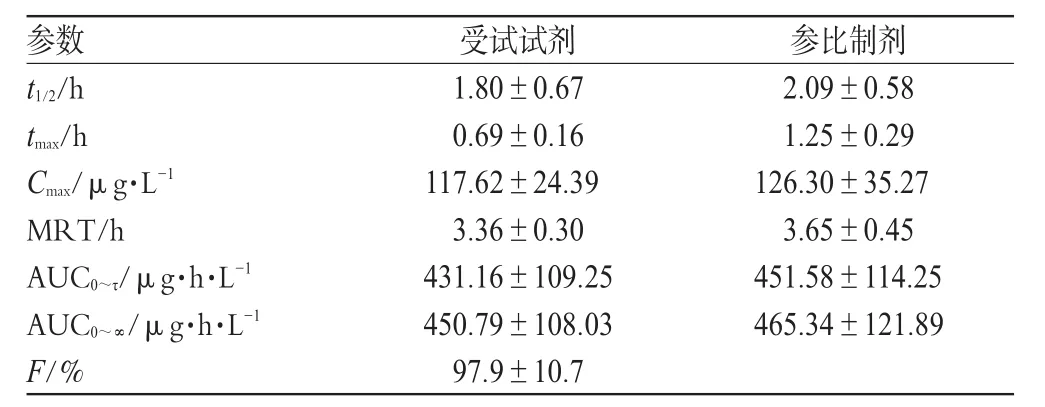
表3 18名健康志愿者单剂量口服酒石酸吡唑坦受试制剂与参比制剂后的主要药动学参数Tab 3 Pharmacokinetic parameters of zolpidem in 18 healthy volunteers after single oral dose of 2 preparations of zolpidem tartrate
2.11 生物等效性评价
参数Cmax自然对数转换后方差分析和双单侧t检验结果:90%可信区间为87.11%~105.18%,P>0.05,生物等效;AUC0~τ自然对数转换后方差分析和统计分析结果:90%可信区间为89.98%~101.56%,P>0.05,生物等效;tmax经非参数法检验(Kruskal and Wallis法),P=0.000 044 3<0.05。结果表明,2种制剂吸收程度等效而吸收速度不等效。
3 讨论
酒石酸唑吡坦口溶片旨在利用制剂学的手段,使制剂在口腔中少量唾液存在时即可迅速溶解而吞咽,使药物在胃中迅速吸收以立即产生药效,同时可增加口服的便利性,但口服后血浆中唑吡坦的浓度较低,且唑吡坦的紫外吸收特征不明显,检测相对比较困难。文献采用毛细管区带电泳(CZE)法[2]或高效液相-紫外(HPLC-UV)法[3],定量下限均为25 mg·L-1,灵敏度较低,适合唑吡坦相关制剂的质量控制,但难以满足其生物样本的分析要求;文献[4]采用液-质联用(LC-MS)法,灵敏度虽得到提高,但试验成本高,仪器普及率低;文献[5,6]采用HPLC-FLU法,磷酸缓冲液作为水相,但该方法色谱柱平衡时间较长,样品保留时间较长,流动相构成比复杂,不易重现,且血浆样品处理分别采用固相萃取柱处理和有机溶剂提取,样品处理成本高,过程复杂,系统误差大,对操作者毒性大。
本试验建立的方法选择甲醇-1%醋酸溶液(40∶60)作流动相,流动相构成比简单,在此条件下,目标化合物峰形良好,无杂峰干扰测定,基线平稳,保留时间适宜,适合大样本量的测试。同时笔者采用了内径小的短柱(150 mm×3 mm,3.5 μm),低流速(0.3 mL·min-1)和小进样体积(2 μL),大大缩短了样品的分析时间,流动相用量少,柱寿命延长,仪器损耗减少。样品处理采取甲醇沉淀蛋白法,操作简单、快速、系统误差小,避免了其他方法的有机溶剂毒性和复杂的操作过程,同时也降低了试验成本。
试验结果表明,18名健康志愿者交叉口服酒石酸唑吡坦口溶片7.5 mg和酒石酸吡唑坦片10 mg后,2种制剂吸收程度等效而吸收速度不等效,原因是受试制剂为口溶片,吸收速度快于参比制剂(普通片)。笔者通过预试验对2种制剂的血样采集时间作了适当调整。在整个研究期间,18名健康志愿者中无一例因不良反应而终止试验,其血液、血液生化、尿常规以及心电图检查在试验前、后未见异常,说明本品在试验剂量下表现出良好的安全性。
[1]李素芳,孙 丽,宗文斌,等.唑吡坦对失眠症患者睡眠影响的多导睡眠图研究[J].中国神经精神疾病杂志,2008,34(5):303.
[2]封宇飞,雷 静,刘志鹤,等.毛细管区带电泳法测定酒石酸唑吡坦片的含量及降解产物[J].中国医院药学杂志,2003,23(2):75.
[3]王守箐.内标HPLC法测定酒石酸唑吡坦及其片剂的含量[J].化学工程师,2005,118(7):19.
[4]刘苍松,于忠山,董 颖.HPLC-MS/MS法测定人全血中唑吡坦成分[J].刑事技术,2008,3:10.
[5]左明新,李可欣,孙春华.国产酒石酸唑吡坦片剂人体生物等效性研究[J].中国新药杂志,2006,15(15):1 293.
[6]宋洪杰,李 珍,石 晶,等.酒石酸唑吡坦药代动力学和生物等效性研究[J].中国临床药理学杂志,2000,16(2):122.
