氯酸钾氧化分光光度法测定水体中总铬浓度
2010-08-03曹桂萍壮亚峰张金涛
曹桂萍,壮亚峰,张金涛,程 辉
(常州工学院化工系,江苏常州 213022)
铬是重要的无机化工产品,被广泛应用于工业生产中。电镀、皮革、染料、橡胶、陶瓷等企业所排出的废水中含有大量的铬,严重污染环境,对水生生物、农作物和生态系统产生极大影响[1]。铬是严重威胁人体健康的基因毒物质[2],被列为一类有害物质,在我国实施优先监测,污水中Cr6+和总铬最高允许排放浓度分别为0.5mg/L和1.0mg/L。
目前普遍采用GB7466—87《高锰酸钾氧化-二苯碳酰二肼分光光度法》测定水体中低浓度总铬的浓度。但是,通过大量的实际分析,发现此方法存在一些问题:①用硝酸-硫酸消解法进行样品预处理时,须将溶液pH值调至中性,这种调节不仅操作麻烦,还会引起总铬成分的损失[3];②在完成酸性氧化过程后,须在溶液中先后加入尿素和亚硝酸钠溶液,以消除过量的高锰酸钾的干扰。但实验证明,仅1 mL 20%尿素溶液就会对显色体系产生影响,过量的尿素溶液会使溶液变浑浊[4],因此,尿素用量不容易控制。③若使用叠氮化钠还原过量的高锰酸钾,不仅因为叠氮化钠属于易爆危险品而存在一定的危险性,而且叠氮化钠每加一次都必须煮沸再冷却,需冷却装置和低温电炉,同时每一试样加入的氧化剂量不同,各加多少叠氮化钠需一一实验,费时费力[5]。
针对上述缺点,笔者对消解预处理过程进行改进,改进后的方法经硝酸-硫酸消解后的水样不需调节pH值就直接进行Cr3+的酸性氧化,并选取新的氧化剂-氯酸钾进行氧化,过量的氯酸钾保留在原溶液中而不必使用其他还原试剂消除。该方法不仅使操作更简便、快捷,节省试剂,可提高大批量水样的分析速度。同时,显色体系具有很好的稳定性,较高的准确度和精密度,与标准方法无显著性差异。
1 实验原理

所以,在酸性溶液中可以使用氯酸钾作为氧化剂,将试样中的Cr3+氧化成Cr6+。Cr6+与二苯碳酰二肼(DPC)反应生成紫红色化合物,10min后于波长540nm处进行分光光度测定。
2 实验部分
2.1 仪器和试剂
722N分光光度计(上海精密仪器厂生产),1cm比色皿;
ρ(Cr6+)=100.0μ g/mL 的标准贮备液:称取于110℃干燥2h的重铬酸钾0.2829g,用水溶解后移入1000mL容量瓶中,加水稀释至标线,摇匀即可。临用时,配制成 ρ(Cr6+)=5.00μ g/mL的标准溶液;ρ(Cr3+)=50.0μ g/mL的 溶 液:称 取 0.1923 g 的Cr(NO3)3◦9H2O溶于水,稀释定容至250mL容量瓶;
显色剂:称取DPC 0.2g溶于50mL无水乙醇中,加水稀释至100mL,摇匀,保存于冰箱中;
氯酸钾饱和溶液:称取不少于7.4g的氯酸钾晶体,略微加热使之完全溶于100mL水中,冷却后存于试剂瓶(有少量晶体析出);
浓硝酸 ρ=1.42g/mL;硫酸溶液 1∶1(V∶V);磷酸溶液1∶1(V∶V)。
以上试剂中,重铬酸钾为优级纯,其余均为分析纯,实验用水为蒸馏水。
2.2 测定方法
2.2.1 硝酸-硫酸消解预处理
样品中含有大量的有机物时需进行消解处理。取50.00mL样品于100mL烧杯中,加入5mL硝酸和0.5mL硫酸溶液,加热蒸发至冒白烟,继续用缓火蒸至无棕红色气体产生,冷却后用水稀释,移入50mL容量瓶,定容至标线,摇匀,供氧化使用。
2.2.2 Cr3+氧化
取50.00mL经预处理的试样,置于150mL锥形瓶中,加入几粒玻璃珠,加入0.5 mL磷酸溶液,摇匀,加0.5mL氯酸钾饱和溶液,加热煮沸至溶液体积为20mL左右,冷却。
2.2.3 总铬的测定
移取氧化后的试样于50mL比色管中,用水稀释至刻线,加入2mL显色剂,摇匀。10min后,在540 nm波长下,用1 cm比色皿,以水作参比,测定吸光度。减去空白试验吸光度,从工作曲线上查得总铬的浓度。
用50mL水代替试样,按照与试样完全相同的处理步骤进行空白试验。
3 结果与讨论
3.1 样品的消解过程
使用硝酸-硫酸进行消解除去有机物时,待溶液清澈后,还必须用小火继续加热至近干,不再有棕色气体产生,使消解剩余的硝酸彻底分解。否则,氯酸钾氧化Cr3+时,ClO3-被还原成Cl-后,溶液中过量的硝酸能将Cl-氧化成Cl2,进而生成少量的HClO,使测得的溶液吸光度偏低。
3.2 显色剂的配制方法
在GB7466—87《高锰酸钾氧化-二苯碳酰二肼分光光度法》中,DPC采用丙酮作溶剂进行配制,而本方法则采用乙醇作溶剂。利用不同浓度的样品,考察两种配制方法的显色效果,结果见表1。
表1的结果表明,对同一样品浓度,DPC-乙醇测得的吸光度与DPC-丙酮测得的吸光度非常相近,完全可以用乙醇代替丙酮配制DPC显色剂。丙酮属微毒类物质,经呼吸道和皮肤进入人体,对中枢神经系统产生麻醉作用,用乙醇替代丙酮可实现配制溶剂的绿色化。
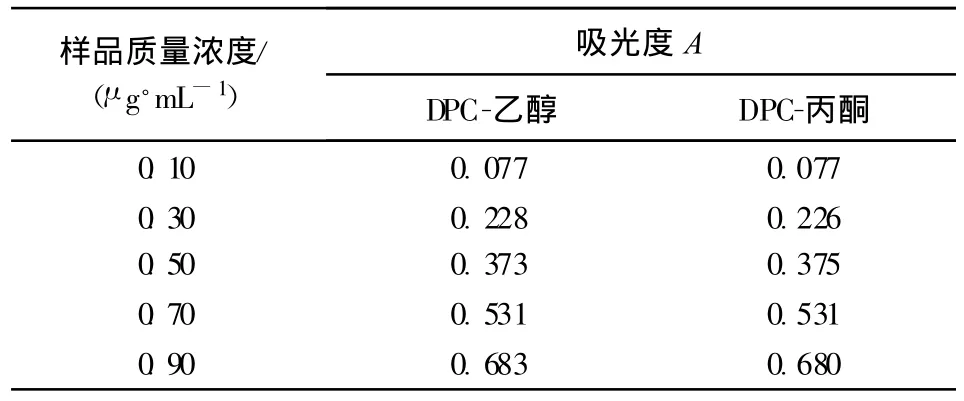
表1 DPC-丙酮和DPC-乙醇的显色吸光度 A
3.3 显色体系的稳定性
按上述实验方法取4.00mL的Cr6+标准溶液测定总铬浓度,考察随着显色时间的延长吸光度A的数值有无变化,结果见表2。
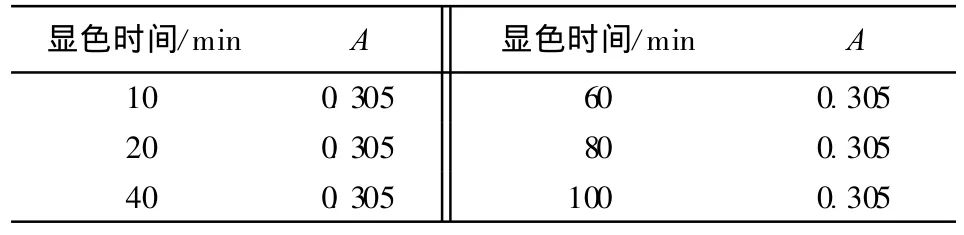
表2 显色时间与吸光度的关系
由表2可见,将含有氯酸钾的显色液放置100min,吸光度无任何改变。这说明在室温下,酸性溶液中剩余的氯酸钾不会氧化DPC与Cr6+形成的紫红色络合物。而氯酸钾是无色晶体,不会干扰本底值。因此,采用氯酸钾作氧化剂,多余的氯酸钾不会干扰显色反应,无须再添加其他试剂消除。
3.4 饱和氯酸钾溶液的用量
取0.9mL的ρ=50μ g/mL的Cr3+溶液于150mL锥形瓶,分别加入0.5mL、1.0mL和1.5mL氯酸钾饱和溶液按上述方法进行氧化,测定溶液总铬的吸光度,结果 3个氯酸钾体积对应的吸光度分别为0.682 、0.683 、0.682 。
研究结果表明,0.5mL氯酸钾饱和溶液的用量足以氧化样品中0.90μ g/mL的Cr3+。所以,本测定方法取氯酸钾饱和溶液的用量为0.5mL。
3.5 工作曲线
向一系列锥形瓶中分别加入0、0.20mL、0.50 mL 、1.00mL 、2.00 mL 、4.00mL 、6.00mL 、8.00mL 和10.00mL铬标准溶液,用水稀释至50mL。按照上述方法进行处理。从测得的吸光度减去空白试验的吸光度后,绘制总铬质量浓度对吸光度 A的曲线,如图1所示。
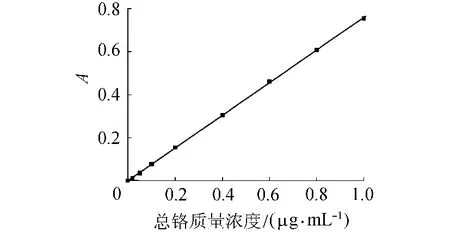
图1 总铬质量浓度与吸光度关系曲线
采用最小二乘法对图1数据进行线性拟合,工作曲线的回归方程为y=0.7582x+0.0002,相关系数 r=0.9999,总铬质量浓度在0.02~1.0μ g/mL,符合朗伯-比耳定律。
3.6 水样测定
按照测定方法,加入标准溶液对地表水、地下水、工业用水和印染工业废水进行回收实验,测定结果列于表3。由表3可知,总铬的加标回收率在95.0%~102.0%,结果令人满意。
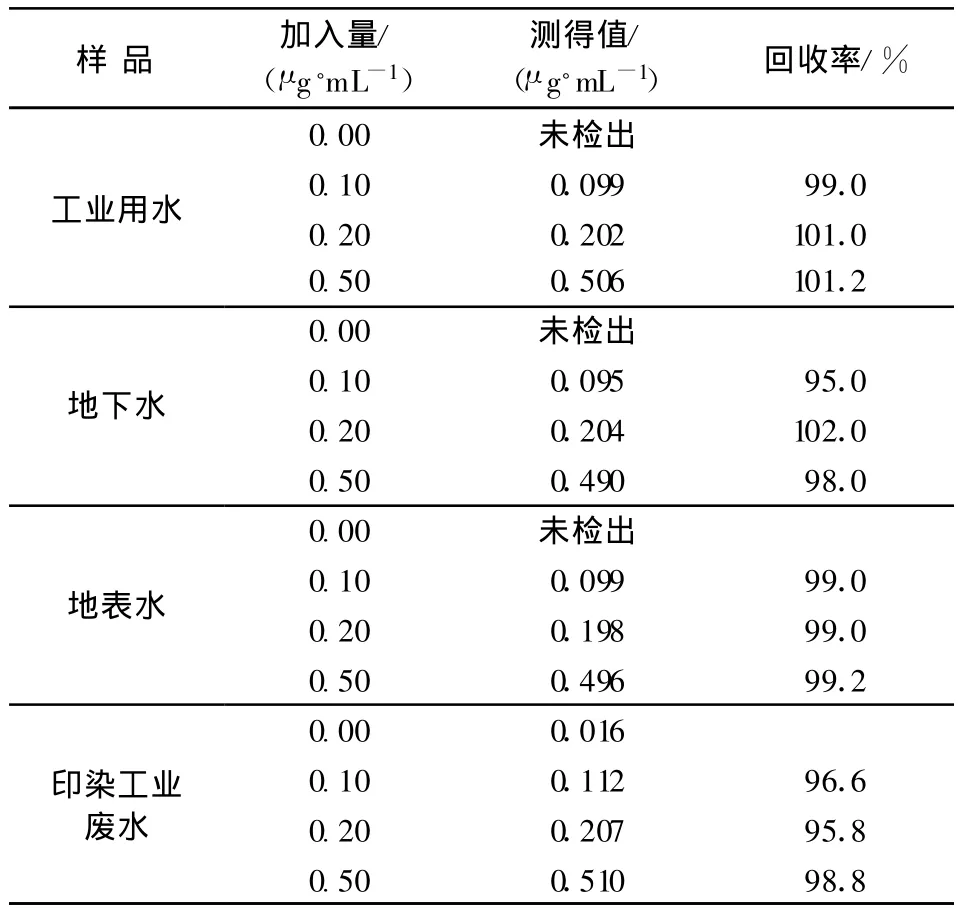
表3 水体样品回收率的测定
3.7 方法检验
同时采用文献[6]中的F检验法和t检验法进行方法检验。分别应用氯酸钾氧化法和高锰酸钾氧化法(国标法)测定某一含铬工业废水,平行测定6次,扣除空白值后,测定结果见表4。
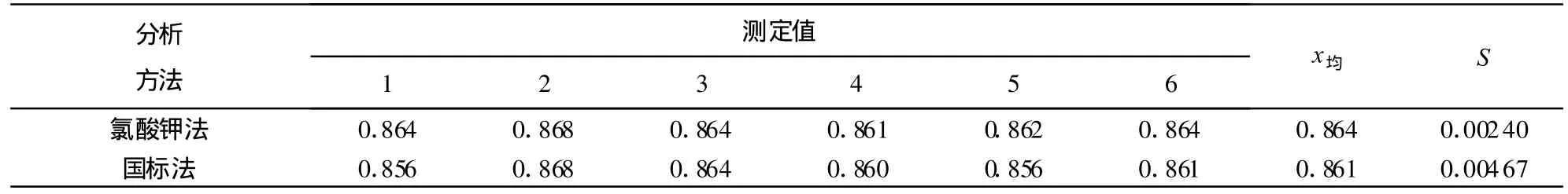
表4 两种分析方法的测定结果μ g/mL
取a=0.05,求得 F=3.79,小于 F0.05(5,5)的临界值5.05,说明两分析方法的精密度无显著性差异;计算 t计=1.40,查表 t0.05,10=2.23,t计<t0.05,10,两方法测得的浓度均值之间没有显著性差异。通过上述检验,以95%的置信度认为两种方法之间不存在系统差异。
4 结 语
本文讨论的测定总铬的新方法使用乙醇配制显色剂更加环保,采用氯酸钾代替高锰酸钾作氧化剂,减少测试过程中重金属锰离子的生成,在整个测定过程中减少了多种试剂的加入,可节约大量实验药品。同时,消解操作简便快捷,避免了pH调节过程中可能产生的总铬损失。水体样品的加标回收率在95.0%~102.0%之内,对含铬废水的测定数据经F检验和t检验与国标法无显著性差异,可在监测各种水体总铬浓度的实践中推广使用。
[1] 许燕滨,冯爱坤,孙水裕.特定污泥对铬(VI)的吸附容量研究[J].水资源保护,2005,21(2):27-30.
[2] 王丽萍,周晓蔚,黄小峰.饮用水水源地健康风险评价[J].水资源保护,2008,24(4):14-17.
[3] 林颖.总铬分析方法的改进[J].重庆环境科学,2002,24(5):76-77.
[4] 李毓,吴丽萍,丁艳梅,等.碱性高锰酸钾氧化测定水样中的总铬含量[J].环境卫生工程,2003,11(3):162-163.
[5] 陈思萍,陈静,田小玲,等.关于总铬测定方法的讨论[J].新疆环境保护,1996,18(3):43-45.
[6] 王英健,杨永红.环境监测[M].北京:化学工业出版社,2004:22-26.
