硫化氢供体对急性支气管哮喘大鼠尾加压素Ⅱ表达的影响*
2010-08-02陈亚红姚婉贞王配配唐朝枢
伍 蕊, 陈亚红△, 姚婉贞, 王配配, 耿 彬, 唐朝枢
(北京大学1第三医院呼吸内科,2医学部生理及病理生理系,北京 100191)
支气管哮喘(简称哮喘)是由多种炎症细胞、炎症介质和神经递质参与的慢性气道炎症性疾病,具有反复发作性气道阻塞和气道反应性增高的特点。我们以往的研究发现在卵白蛋白(ovalbumin,OVA)诱导的大鼠急性支气管哮喘模型中,硫化氢(hydrogen sulfide,H2S)/胱硫醚 - γ-裂解酶(cystathionine-lyase,CSE)体系下调,外源性给予硫氢化钠(NaHS,H2S供体)后,可明显缓解哮喘大鼠的气道炎症,提示H2S/CSE体系参与了哮喘的发病过程[1,2]。支气管平滑肌增殖、肥厚是哮喘的主要病理表现。已有研究表明尾加压素Ⅱ(urotensin II,U-Ⅱ)作为平滑肌细胞及内皮细胞增殖的相关指标参与了干预的发病[3,4]。那么,H2S 是否通过对 U - Ⅱ的调节而在哮喘发病中发挥作用呢,尚不清楚。为此,本实验拟以OVA诱导大鼠急性哮喘模型,探讨应用外源性NaHS处理对哮喘大鼠U-Ⅱ表达的影响,进一步阐明哮喘的发病机制。
材料和方法
1 动物分组及处理
健康SD雄性大鼠(北京大学医学部动物中心)24只,鼠龄5-6周,平均体重(180±10)g,SPF级环境中饲养,按随机数字表法分为对照组、哮喘组和NaHS干预组,每组8只。
1.1 哮喘组 第1 d和第8 d大鼠各腹腔内注射10%OVA抗原混悬液(OVA 100 mg+氢氧化铝干粉100 mg+灭活百日咳菌苗(5×109个)1 mL,第15 d开始激发,雾化吸入1%OVA液每天雾化1次,每次约30 min。连续14 d,处理大鼠前1 h再雾化吸入1次[5]。
1.2 NaHS干预组 第15 d开始于每次激发前30 min给予 NaHS(每天 14 μmol/kg)腹腔注射,溶于0.5 mL生理盐水中,其余致敏及激发同哮喘组[6]。1.3 正常对照组 第1 d和第8 d用生理盐水1 mL代替抗原进行腹腔注射致敏,第15 d开始用生理盐水30 mL雾化激发,每天1次,每次30 min,连续14 d。
2 肺功能测定
按文献[7]方法测定气道阻力,腹腔注射20%乌拉坦麻醉大鼠,气管插管后与Powerlab多导生理测试仪相连,设置呼吸机潮气量为10 mL/kg,呼吸频率为60次/min。经Chart 4.1软件分析测定每只大鼠的最大吸气峰流速(peak inpiratory flow,PIF)、最大呼气峰流速(peak expiratory flow,PEF)、吸气内压(inpiratory pressure,IP)及气道内压上升斜率(inpiratory pressure slope,IPSlope)。
3 支气管肺泡灌洗(bronchoalveolar lavage,BAL)
结扎大鼠左主支气管后经气管插管行BAL(分2次进行),每次注入4℃生理盐水2 mL,反复抽吸3次,回收支气管肺泡灌洗液(BALF),回收率为70.0% -87.5%。取 50 μL计细胞总数,其余以3000 r/min离心10 min后收集上清液,分装于-80℃保存待测。采用离心沉渣涂片,瑞氏-姬姆萨染色作细胞分类计数。
4 病理学观察
实验大鼠放血并处死后取整个左肺于4%多聚甲醛固定,在左肺矢状面距肺外缘约2 mm及4 mm处纵切面取材并苏木精-伊红(HE)染色。按文献[8,9]的方法对各组大鼠气道周围炎症细胞浸润评分。(1)无炎症细胞为0分;(2)少许炎症细胞为1分;(3)较多分布不均的炎症细胞为2分;(4)大量炎症细胞,分布较均匀,少见聚集成团为3分;(5)大量炎症细胞聚集成团为4分。
5 血浆、肺组织及肺泡灌洗液U-Ⅱ含量测定
采用放射免疫测定法,U-Ⅱ放射免疫试剂盒由Phoenix提供,测定方法严格按照说明书进行。
6 统计学处理
病理评分为非正态分布时以中位数(四分位数)表示,相关性检验采用Spearman直线相关分析,组间差异比较采用秩和检验。其余数据符合正态分布时均以均数±标准差()表示,多样本间比较采用单因素方差分析,两组间比较采用独立样本t检验,相关性检验采用Pearson直线相关分析。统计计算均由SPSS 10.0软件完成。
结 果
1 一般情况
哮喘组大鼠于OVA液雾化时均出现喘息、呼吸困难及烦躁症状,雾化吸入后大鼠倦怠,意识差;NaHS干预组大鼠于OVA液雾化吸入时偶见烦躁、雾化吸入后大鼠基本无倦怠表现,意识尚好;对照组大鼠意识好,体重增长相对较快,毛白,有光泽。
2 肺功能
对照组大鼠PEF、IPSlope分别为(6.5±0.1)L/s、(1.4±0.1)L/s,哮喘组分别为(2.9 ±0.7)L/s)、(1.9±0.1)L/s,NaHS干预组分别为(5.7±0.5)L/s、(2.1 ±0.1)L/s,3 组间差异显著(F 值分别为112.129、45.371,均 P <0.01)。
3 组织病理学改变
对照组大鼠支气管纤毛柱状上皮完整,纤毛排列整齐,各级支气管黏膜上皮仅见散在杯状细胞,未见明显平滑肌增生,管腔内无黏液和炎性渗出物,管腔通畅。哮喘组杯状细胞明显增多,黏膜的基底膜增厚伴玻璃样变,管壁平滑肌肥大,黏膜下及肥厚的肌层内可见大量混合性细胞浸润,以浆细胞、肥大细胞、淋巴细胞及嗜酸粒细胞为主。NaHS干预组大鼠支气管黏膜上皮中杯状细胞不明显,黏膜的基底轻度增厚,黏膜下及肌层内可见灶状散在的炎症细胞浸润,以浆细胞、肥大细胞为主,极少见到嗜酸粒细胞。
3组大鼠光镜下支气管周围炎症细胞浸润程度评分[中位数(四分位数)]依次为对照组1(0-1)分、哮喘组3(2-4)分,NaHS干预组1(1-2)分,3组间差异显著(H=16.925,P<0.01)。
4 肺泡灌洗液中细胞总数及分类比较
3组大鼠肺泡灌洗液回收率及巨噬细胞计数比较无显著差异(F值分别为0.987、1.532,均 P>0.05);3组大鼠支气管肺泡灌洗液细胞总数、淋巴细胞、中性粒细胞、嗜酸粒细胞计数差异显著(F值分别为 3.961、9.437、11.865、20.792,均 P < 0.05),见表1。
表1 3组大鼠支气管肺泡灌洗液中细胞总数及分类结果Table 1.Effect of NaHS on cell differential counts in BALF(.n=8)
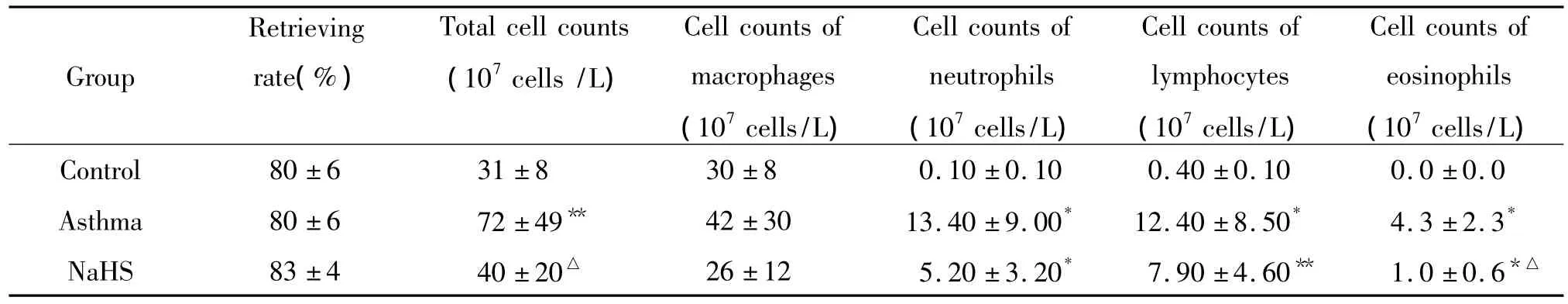
表1 3组大鼠支气管肺泡灌洗液中细胞总数及分类结果Table 1.Effect of NaHS on cell differential counts in BALF(.n=8)
*P <0.05,**P <0.01 vs control group;△P <0.05 vs OVA -treated group.
Group Retrieving rate(%)Total cell counts(107cells/L)Cell counts of macrophages(107cells/L)Cell counts of neutrophils(107cells/L)Cell counts of lymphocytes(107cells/L)Cell counts of eosinophils(107cells/L)0 ±0.0 Asthma 80 ±6 72 ±49** 42 ±30 13.40 ±9.00* 12.40 ±8.50* 4.3 ±2.3*NaHS 83±4 40±20△ 26±12 5.20 ±3.20* 7.90 ±4.60** 1.0±0.6 Control 80 ±6 31 ±8 30 ±8 0.10 ±0.10 0.40 ±0.10 0.*△
5 大鼠血浆、肺组织及肺泡灌洗液U-Ⅱ含量
3组大鼠血浆U-Ⅱ含量比较无显著差异(F=1.546,P>0.05)。与对照组相比,哮喘组肺组织及肺泡灌洗液U-Ⅱ含量明显升高,分别为对照组的2.6倍和2.2倍;而NaHS干预组肺组织及肺泡灌洗液U-Ⅱ含量无显著差异(t值分别为 -1.866、-1.656,均 P >0.05)。与哮喘组比较,NaHS干预组肺组织及肺泡灌洗液U-Ⅱ含量均降低,分别是哮喘组的32.0%和34.8%,见表2。
表2 3组大鼠血浆、肺组织及肺泡灌洗液UⅡ含量比较Table 2.Serum and lung tissue and BALF UⅡlevels in an OVA-induced asthma model(.n=8)

表2 3组大鼠血浆、肺组织及肺泡灌洗液UⅡ含量比较Table 2.Serum and lung tissue and BALF UⅡlevels in an OVA-induced asthma model(.n=8)
**P <0.01 vs control;△△P <0.01 vs OVA -treated group.
Control 45.3 ±18.1 16.6 ±3.4 26.3 ±7.8 Asthma 61.5 ±27.2 43.8 ±2.0** 58.0 ±12.3**NaHS 47.3 ±11.8 14.0 ±1.9△△ 20.2 ±6.7△△
6 相关性分析
经Spearman相关分析表明,大鼠肺组织及肺泡灌洗液U-Ⅱ含量与光镜下支气管周围炎症细胞浸润程度评分呈显著正相关(r值分别为0.746、0.714,P<0.01)。经Pearson直线相关分析表明,大鼠肺组织及肺泡灌洗液U-Ⅱ含量与PEF呈显著负相关(r值分别为 -0.911、-0.767,均 P <0.01)。
讨 论
哮喘是由多种细胞和细胞组分参与的气道慢性炎症性疾病,主要包括气道炎症、免疫与变态反应、气道神经调节以及遗传机制等,至今尚未完全阐明。
H2S一直被认为是毒性气体。最近研究发现其具有重要的生理功能,是继NO、CO之后第3个内源性气体信号分子。内源性H2S是半胱氨酸在5'-磷酸吡哆醛依赖的酶催化作用下生成的[10]。肺组织和肺血管具有胱硫醚-γ-裂解酶(CSE)的高表达,是体内H2S生成的重要来源之一。H2S同NO、CO一样具有扩张血管和消化道平滑肌、抑制血管平滑肌细胞增殖的作用[11-13];另外还具有直接清除氧自由基和硝基自由基等多种生物学效应[14]。Marcello等[15]研究发现于豚鼠气道内滴入NaHS可以增加胞浆蛋白外渗,且增加气道阻力,此反应可被气道感觉神经末梢辣椒素受体(TRPV1)拮抗剂所减弱,提示内源性H2S在呼吸系统方面可能具有一定病理生理意义。我们以往的研究发现在OVA诱导的大鼠急性支气管哮喘模型中,血浆H2S的含量明显下降,肺组织中H2S的生成量也明显降低,肺组织中CSE蛋白也明显下调,同时肺组织中CSE活性也明显下降,提示哮喘急性发作时H2S/CSE体系下调。而外源性给予NaHS后,可明显改善哮喘大鼠的气道炎症,结果提示H2S/CSE体系参与哮喘的发病过程,内源性H2S/CSE体系的下调是哮喘发生的重要机制之一[2]。
最近证实,最早从鱼的脊髓尾部下垂体中分离出的生长抑素样环肽尾加压素Ⅱ(U-Ⅱ)与其受体GPR14结合使细胞内钙离子浓度增加,血管收缩。U-Ⅱ作为促分裂的强丝裂原,具有促肺动脉平滑肌细胞和内皮细胞增殖作用,参与了哮喘的发病[3,4]。研究还发现U-Ⅱ在血浆含量并不高,而其在组织中广泛分布和表达,提示U-Ⅱ可能类似于内皮素,不是一种循环激素,而可能作为旁/自分泌因子而发挥效应[16],这一点也已在我们对哮喘患者临床研究中得以应证[3]。支气管平滑肌增殖、肥厚是哮喘的主要病理表现,H2S是否通过对U-Ⅱ的调节而参与了哮喘的病理生理过程呢,尚不清楚。
本文研究结果发现,对照组、哮喘组和NaHS干预组血浆U-Ⅱ含量无显著差异。而哮喘组与对照组比较,大鼠PEF降低,光镜下支气管周围炎症细胞浸润程度评分升高,血浆、肺组织及肺泡灌洗液U-Ⅱ含量明显升高;大鼠肺组织及肺泡灌洗液U-Ⅱ含量与光镜下支气管周围炎症细胞浸润程度评分呈正相关,与PEF呈负相关,这与我们以往的哮喘临床研究结果一致[3],提示U-Ⅱ可能以旁/自分泌的方式加重了哮喘气道炎症,从而参与了哮喘的发病。
另外,研究结果还发现与哮喘组比较,NaHS干预组大鼠PEF明显升高;支气管肺泡灌洗液中嗜酸粒细胞减少;光镜下支气管周围炎症细胞浸润程度评分明显降低,支气管黏膜中杯状细胞明显减少,黏膜的基底膜厚度变薄,管壁平滑肌无明显肥大;血浆、肺组织和肺泡灌洗液U-Ⅱ含量明显降低,均提示外源性H2S供给可通过抑制U-Ⅱ促分裂作用,而减轻哮喘急性发作期气道炎症,对哮喘急性发病起到保护作用。以往的研究也证实外源性H2S供给可以显著抑制低氧性肺动脉高压大鼠肺动脉U-II的表达,该效应可能参与H2S对低氧性肺血管结构重建的调节作用。H2S对U-Ⅱ促分裂抑制作用的产生机制又是什么,还不十分清楚,我们推测可能与H2S抑制蛋白激酶C、抑制丝裂素活化蛋白激酶等信号途径有关,这还有待进一步研究。
总而言之,本文就硫化氢供体对急性支气管哮喘大鼠尾加压素Ⅱ表达影响的研究显示哮喘急性发作时气道U-Ⅱ分泌增加,U-Ⅱ可能以旁/自分泌方式参与哮喘的发病;而H2S外源性供给可通过抑制U-Ⅱ合成/分泌,减轻哮喘急性发作时的气道炎症,对哮喘急性发病起到保护作用。这一发现对我们进一步认识气道信号分子参与哮喘气道炎症的发生机制有很大帮助,进而为研发哮喘新的治疗用药提供了理论依据。
[1]伍 蕊,姚婉贞,陈亚红,等.硫化氢在大鼠急性支气管哮喘模型中的变化及意义[J].中华结核和呼吸杂志,2007,30(7):522 -526.
[2]伍 蕊,姚婉贞,陈亚红,等.支气管哮喘患者血浆中硫化氢的变化及其意义[J].北京大学学报(医学版),2008,40(5):505 -508.
[3]伍 蕊,陈亚红,姚婉贞,等.支气管哮喘患者诱导痰中尾加压素Ⅱ的变化及其意义[J].中国呼吸与危重监护杂志,2008,7(2):128 -131.
[4]张勇刚,齐永芬,夏春芳,等.尾加压素II对血管平滑肌细胞增殖的影响[J].中国药理学通报,2001,17(2):155-157.
[5]Rabb HA,olivenstein R,Issekutz TB,et al.The role of the leukocyte adhesion molecules VLA -4,LFA -1 and Mac -1 in allergic airway responses in the rat[J].Am J Respir Crit Care Med,1994,149(5):1186-1191.
[6]Lertratanangkoon K,Scimeca JM,Wei JN.Inhibition of glutathione synthesis with propargylglycine enhances N-acetylmethionine protection and methylation in bromobenzene - treated Syrian hamsters[J].J Nutr,1999,129(3):649-656.
[7]Takehana Y,Hamano S,Kikuchi S,et al.Inhibitory action of OKY -046·HCl,a specific TXA2 synthetase inhibitor,on platelet activating factor(PAF)-induced airway hyperresponsiveness of guinea pigs:role of TXA2 in development of PAF-induced nonspecific airway hyperresponsiveness[J].Jpn J Pharmacol,1990,52(4):621 -630.
[8]Henderson WR Jr,Tang LO,Chu SJ,et al.A Role for cysteinyl leukotrienes in airway remodeling in a mouse asthma model[J].Am J Respir Crit Care Med,2002,165(1):108-116.
[9]沈华浩,王绍斌.布地奈德干预对卵白蛋白致敏小鼠抗原激发后气道炎症及气道重塑的影响[J].中华结核和呼吸杂志,2005,28(3):154 -159.
[10]Searcy DG,Les SH.Sulfur reduction by human erythrocytes[J].J Exp Zool,1998,282(2):310 - 322.
[11]Zhao W,Zhang J,Lu Y,et al.The vasorelaxant effect of H2S as a novel endogenous gaseous KATPchannel opener[J].EMBO J,2001,20(21):6008 -6016.
[12]Hosoki R,Matsuki N,Kimura H.The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide[J].Biochem Biophys Res Commun,1997,237(3):527-531.
[13]杜军保,陈晓波,耿 斌,等.硫化氢作为心血管信号分子的研究[J].北京大学学报(医学版),2002,34(2):187.
[14]Geng B,Chang L,Pan C,et al.Endogenous hydrogen sulfide regulation of myocardial injury induced by isoproterenol[J].Biochem Biophys Res Commun,2004,318(3):756-763.
[15]Marcello TR,Riccardo PA,Paola NI,et al.Hydrogen sulfide causes vanilloid receptor 1-mediated neurogenic inflammation in the airways[J].Br J Pharmacol,2005,145(8):1123-1131.
[16]Yoshimoto T,Matsushita M,Hirata Y,et al.Role of urotensin II in peripheral tissue as an autocrine/paracrine growth factor[J].Peptides,2004,25(10):1775-1781.
