异补骨脂素对人晶状体上皮细胞雌激素受体表达的上调作用*
2010-08-02黄秀榕祁明信张可丽
黄秀榕, 祁明信, 张可丽, 郭 娜
(福建中医药大学1病理生理研究中心,2附属第二人民医院眼科,福建 福州 350003)
近年来的流行病学调查研究和实验研究结果[1,2]从不同角度表明老年性白内障与雌激素间存在一定的相关性。在核性、后囊下和皮质性白内障3种类型之中,女性白内障的患病率都高于男性,而当服用雌激素后,女性核性白内障患病率有所下降;单独应用雌激素或雌激素-孕激素联合应用的激素替代疗法与降低白内障的风险有联系,绝经后使用雌激素可减少白内障的发生,对晶状体透光性有保护作用;典型闭经的激素水平与白内障的发生也有显著的依从性;在对SD大鼠应用甲基亚硝脲诱导的年龄相关性白内障模型中研究发现,去卵巢后未予雌激素组晶状体混浊眼数较给予雌二醇或雌酮组高,未用雌激素组晶状体透光率较使用雌激素组低;抗雌激素药他莫昔芬使用5年以上可增加发生白内障的危险,这可能与阻断晶体氯离子通道而导致晶状体混浊有关。而近年的实验研究表明,很多富含植物雌激素的中药,如补骨脂、牛膝、葛根、淫羊藿、黑升麻、虎杖等具有类雌激素活性[3],异补骨脂素(isopsoralen,ISR)为中药补骨脂的有效单体,归肾、脾经,温肾助阳,肾属水,肝属木,水可生木,即肾可生肝,而肝开窍于目。本实验选取ISR作用于H2O2处理的人晶状体上皮细胞(human lens epithelial cells,HLECs),探讨其对老年性白内障的防治作用。
材料和方法
1 材料
1.1 仪器 流式细胞仪(Flow Cytometer,FCM)(BD FACScan)、CO2培养箱(FORMA 2111)、倒置相差显微镜(Olympus IMT-413)、超净工作台(江苏SW-CJ-IF)、微量移液器(Gilson)、冰箱(青岛BCD-268)、超低温冰箱(MDF-V5410)、电热式压力消毒器(上海 YXQ.SG41)、数字酸度计(上海 PHS-25)、微量电子天平(上海FA200X)、低速水平离心机(北京LD4-2)、恒温水浴锅(深圳HH-4)、干燥箱(上海101A-2)、自动三重纯水蒸馏器(上海SZ-97)、真空泵(EF006)。
1.2 试剂 雌二醇(β -estradiol,E2)粉末,纯度97%,Sigma;ISR粉末,购自中国药品生物制品检定所;胰蛋白酶(trypsin)为美国Gibco产品,乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)为 Augus产品,购自华美生物工程公司;DMEM培养基(Dulbecco's modified Eagle's medium)干粉为Gibco产品,牛血清白蛋白(bovine serum albumin,BSA)为Amresco产品,新生牛血清(newborn calf serum,NCS)为奥地利PAA产品,购自厦门泰京生物技术有限公司;HEPES为 Amresco产品,Triton X-100、NP-40为Sigma产品,购自厦门鹭隆生物技术有限公司;兔抗人ERα、β多克隆抗体为Santa Cruz产品,异硫氰酸荧光素(FITC)标记的羊抗兔抗体,购自北京中山生物技术有限公司;青霉素系福建汇天生物药业有限公司产品,链霉素为大连美罗大药厂产品;其余试剂均为国产分析纯。
2 方法
2.1 HLECs培养 取出保存冻存细胞的冻存管立即放入37℃水中,将溶解的细胞悬液用10倍体积以上的培养液进行稀释,离心,除上清,反复洗涤3次。以5×108cells/L接种于培养瓶中,37℃、5%CO2培养箱培养。待细胞生长融合后进行传代培养。
2.2 E2溶液配制 取 E2粉末0.0136 g,溶于0.5 mL无水乙醇,待完全溶解后,加无水乙醇至5 mL,配制成10-2mol/L的储存液,分装,-20℃冻存备用,临用前用灭菌后的三蒸水稀释成10-4mol/L的工作液。
2.3 ISR溶液配制 取ISR粉末0.0091 g,溶于0.5 mL无水乙醇,待完全溶解后,加无水乙醇至5 mL,配制成10-2mol/L的储存液,分装,-20℃冻存备用,临用前用灭菌后的三蒸水稀释成10-4mol/L的工作液。
2.4 核分离液配制 分别称取BSA 0.5 g,HEPES 0.59575 g,依次将其溶解于80 mL PBS(溶解时必须待一种试剂完全溶解后,再加入下一种试剂,直至所有试剂溶解后混匀),加入0.6 mL NP-40,补加PBS至100 mL混匀,4℃保存备用。
2.5 反应缓冲液配制 称取BSA 2.5 g,将其溶解于180 mL PBS,加入 0.125 mL Triton X -100,补加PBS至200 mL混匀,4℃保存备用。
2.6 分组与给药 对照组:HLECs+含10%NCS的DMEM培养液;H2O2组:对照组 +3×10-4mol/L H2O2;E2组:H2O2组 +10-8mol/L E2;ISR 组(高浓度):H2O2组 +10-5mol/L ISR;ISR组(中浓度):H2O2组+10-6mol/L ISR;ISR组(低浓度):H2O2组+10-7mol/L ISR。
各ISR组提前加药孵育1 h后,再加入H2O2,培养24 h后进行检测。
2.7 FCM检测经H2O2处理的HLECs上雌激素受体 α(estrogen receptor α,ERα)和 β(ERβ)的表达取对数期生长的细胞,常规消化,收集,细胞密度为(1-2)×109cells/L,PBS洗涤1次,每组设7个平行样本(其中一个为阴性对照);用-20℃预冷的100% 甲醇-20℃固定20 min;PBS洗涤2次,用4℃预冷的核分离液室温处理10 min,用反应缓冲液洗涤2遍;加入含有1%BSA及1%NCS的 PBS 50 μL,混匀后室温中放置30 min;反应缓冲液洗涤2遍,分别加入1∶100稀释(稀释液为0.01 mol/L的磷酸钠缓冲液,pH7.6)的Ⅰ抗(ERα抗体、ERβ抗体),4℃反应过夜(阴性对照组以PBS代替Ⅰ抗,其它步骤同前,以便试机、调零),然后用反应缓冲液洗涤2遍;加入1∶50稀释(稀释液为0.01 mol/L的磷酸钠缓冲液,pH 7.6)的FITC标记的Ⅱ抗,置冰上避光放置30 min;反应缓冲液洗涤2遍,加入1 mL PBS悬浮细胞,上机做流式细胞分析,检测ERα、ERβ蛋白阳性率。
3 统计学处理
结 果
1 FCM检测ISR对经H2O2处理的HLECs ERα表达的影响
FCM检测结果显示(表1、图1):正常HLECs存在ERα的表达;H2O2组HLECs内ERα表达明显下降,与对照组比较有显著差异(P<0.01);E2、ISR高、中、低浓度组的HLECs内ERα表达明显升高,与H2O2组比较有显著差异(P<0.01);且随ISR浓度的增高HLECs内ERα表达逐渐升高,呈明显的浓度依赖关系。
表1 FCM检测不同浓度ISR对经H2O2处理的HLECs ERα表达的影响Table 1.The effect of different concentrations of ISR on expression of ERα in HLECs incubated with H2O2(.n=6)
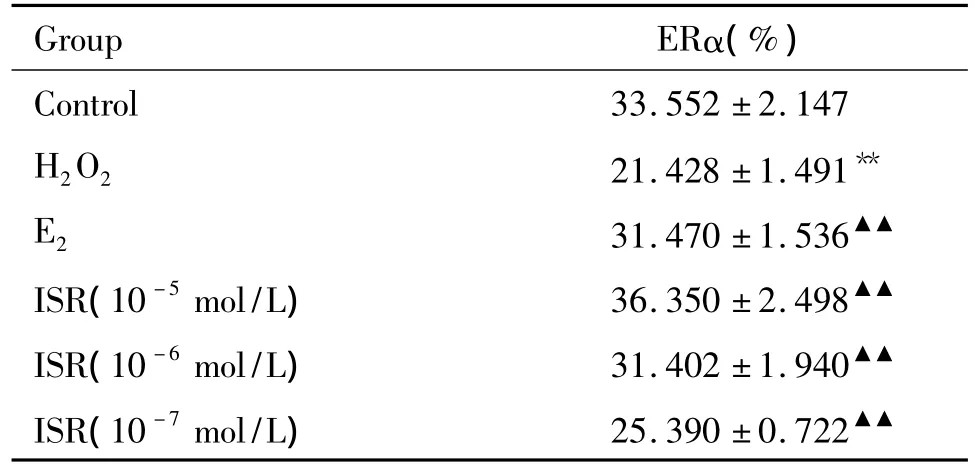
表1 FCM检测不同浓度ISR对经H2O2处理的HLECs ERα表达的影响Table 1.The effect of different concentrations of ISR on expression of ERα in HLECs incubated with H2O2(.n=6)
**P <0.01 vs control group;▲▲P < 0.01 vs H2O2group.
Group ERα(%)Control 33.552 ±2.147 H2O2 21.428 ±1.491**E2 31.470 ±1.536▲▲ISR(10 -5mol/L) 36.350 ±2.498▲▲ISR(10 -6mol/L) 31.402 ±1.940▲▲ISR(10 -7mol/L) 25.390 ±0.722▲▲
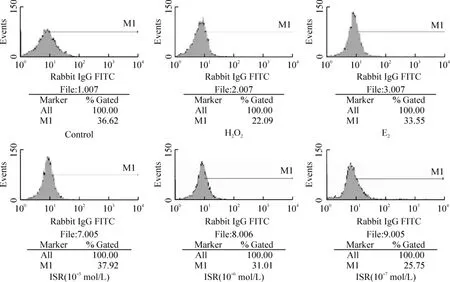
Figure 1.The effect of different concentrations of ISR on expression of ERα in H2O2-treated HLECs examined by flow cytometry.图1 FCM检测不同浓度ISR对经H2O2处理的HLECs ERα表达的影响
2 FCM检测ISR对经H2O2处理的HLECs ERβ表达的影响
FCM检测结果显示(表2、图2):正常HLECs存在ERβ的表达;H2O2组HLECs内ERβ表达明显下降,与对照组比较有显著差异(P<0.01);E2、ISR高中低浓度组的 HLECs内 ERβ表达明显升高,与H2O2组比较有显著差异(P<0.01);且随ISR浓度的增高HLECs内ERβ表达逐渐升高,呈明显的浓度依赖关系。
表2 FCM检测不同浓度ISR对经H2O2处理的HLECs ERβ表达的影响Table 2.The effect of different concentrations of ISR on expression of ERβ of HLECs incubated with H2O2(.n=6)
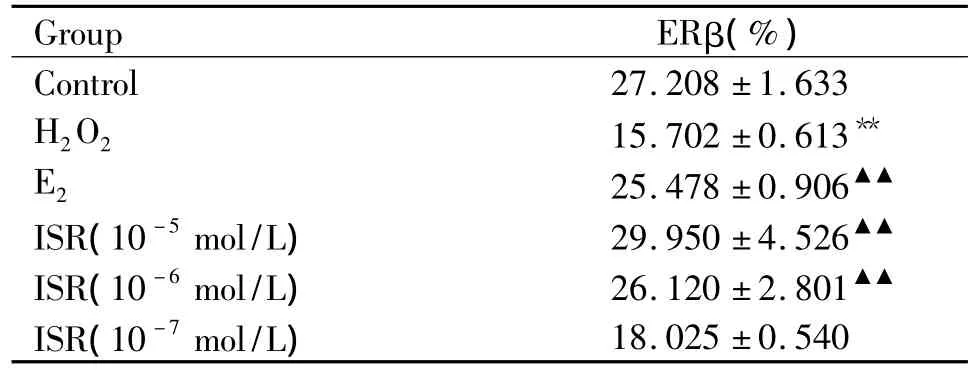
表2 FCM检测不同浓度ISR对经H2O2处理的HLECs ERβ表达的影响Table 2.The effect of different concentrations of ISR on expression of ERβ of HLECs incubated with H2O2(.n=6)
**P < 0.01 vs control group;▲▲P <0.01 vs H2O2group.
Group ERβ(%)Control 27.208 ±1.633 H2O2 15.702 ±0.613**E2 25.478 ±0.906▲▲ISR(10 -5mol/L) 29.950 ±4.526▲▲ISR(10 -6mol/L) 26.120 ±2.801▲▲ISR(10-7mol/L)18.025 ±0.540
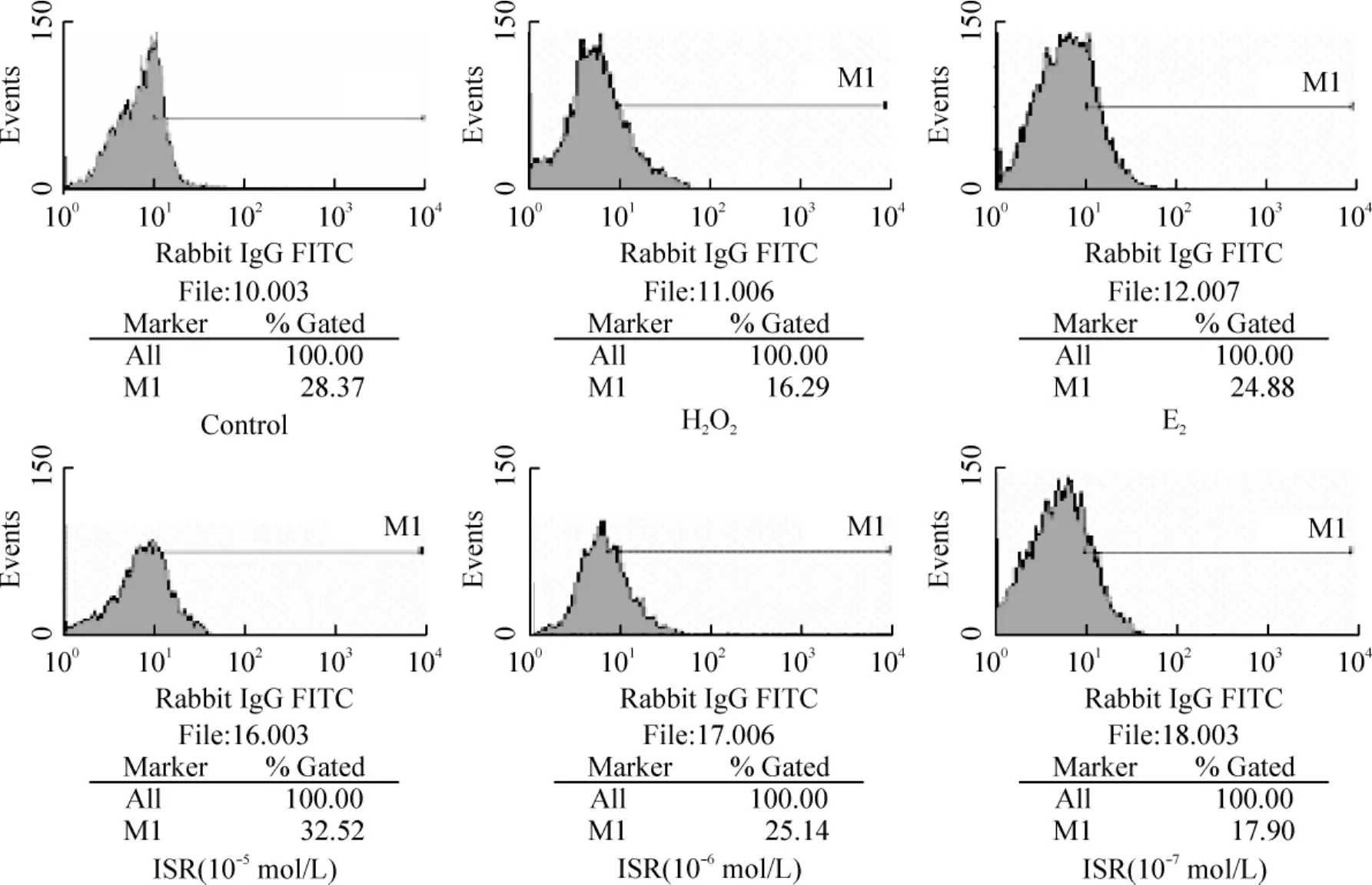
Figure 2.The effect of different concentrations of ISR on expression of ERβ in H2O2-treated HLECs examined by flow cytometry图2 FCM检测不同浓度ISR对经H2O2处理的HLECs ERβ表达的影响
讨 论
氧化损伤是诱发老年性白内障形成的一个重要因素,如各种原因和途径导致的晶状体氧自由基产生过多或清除过少,均可引起HLECs和纤维组织的损伤而导致老年性白内障的发生。
ER是类固醇激素受体超大家族中的一员,人体内有2种雌激素受体,即ERα和ERβ。雌激素的生物效应主要是通过与ER结合而发挥作用[4]。已有相关研究结果证实了HLECs上有ER的表达,并在亚细胞器上的定位进行了研究[5-7]。本研究结果表明:正常HLECs上存在ERα、β表达,与国内外学者的报道结果一致。国外学者报道了氧化损伤能影响ERα、β的表达[8]。本研究表明:H2O2能下调HLECs的ERα、β表达,提示由H2O2诱导的氧化损伤参与的老年性白内障可能与HLECs的ERα、β下调有关。
近年来有相关文献报道了E2对氧化损伤的HLECs的保护作用:Wang等[9]的研究结果表明了E2对体外培养的HLECs氧化应激的保护效应:将HLECs暴露于H2O2可引起细胞生存力、胞内ATP水平和线粒体膜电位三者呈剂量依赖性下降;而用E2预处理的HLECs,前两者均呈剂量依赖性提高,此研究首次在HLECs中证实雌激素具有抗氧化作用。Moor等[10,11]研究发现 E2在保护 HLECs免受氧化损伤中,稳定线粒体膜电位起了关键作用;在H2O2处理的HLECs中,E2诱导ERK1/2磷酸化与稳定线粒体膜电位呈正相关,故可能在E2活化MAPK信号通路与稳定线粒体膜电位来发挥17β-E2的抗氧化、细胞保护作用的能力之间存在联系,这可能是E2抗氧化的机制之一。Flynn等[12]进一步研究发现:在高糖条件下培养的牛HLECs持续产生多羟化合物,多羟化合物的聚集促进线粒体膜去极化,预先用E2处理HLECs可阻止线粒体膜电位的增加,对抗线粒体膜去极化。Gottipati等[13]的研究表明,E2可快速活化HLECs线粒体相关的锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)而不影响其 mRNA和蛋白的表达,推测MnSOD可能在对抗线粒体氧化损伤过程中发挥了重要作用。
E2通过受体发挥其生物学效用,在各种不同细胞上对ER的上调或下调作用[14,15]。ISR是中药植物雌激素,已有报道ISR可使人乳腺癌T47D细胞的ERα mRNA表达显著增加,同时也可使ERβ mRNA表达增加[14]。本研究表明:E2、ISR能上调经 H2O2处理的HLECs的ER表达,并呈明显的浓度依赖关系,提示E2、ISR可能通过上调经H2O2处理HLECs的ER表达来发挥抗氧化损伤作用,从而起到防治老年性白内障的作用。该结果将为开发防治老年性白内障的有效药物提供科学的实验依据。
[1]Aina FO,Smeeth L,Hubbard R,et al.Hormone replacement therapy and cataract:a population-based casecontrol study[J].Eye,2006,20(2):417 -422.
[2]Dolatowska E.The evaluation of estradiol and FSH serum levels in menopausal women with primary cataract[J].Klin Oczna,2002,104(5 -6):357 -361.
[3]赵丕文,王大伟,牛建昭,等.红花等10种中药的植物雌激素活性研究[J].中国中药杂志,2007,32(5):436-439.
[4]朱顺叶,余振华,陈红珊,等.司坦唑醇激活ERα调节雌激素受抑的青春期大鼠生长板软骨细胞的增殖和分化[J].中国病理生理杂志,2009,25(6):1186 -1191.
[5]Ogueta SB,Schwartz SD,Yamashita CK,et al.Estrogen receptor in the human eye:influence of gender and age on gene expression[J].Invest Ophthalmol Vis Sci,1999,40(9):1906-1911.
[6]Cammarata PR,Chu S,Moor A,et al.Subcellular distribution of native estrogen receptor alpha and beta subtypes in cultured human lens epithelial cells[J].Exp Eye Res,2004,78(4):861-871.
[7]Cammarata PR,Flynn J,Gottipati S,et al.Differential expression and comparative subcellular localization of estrogen receptor beta isoforms in virally transformed and normal cultured human lens epithelial cells[J].Exp Eye Res,2005,81(2):165 -175.
[8]Tamir S,Izrael S,Vaya J.The effect of oxidative stress on ERα and ERβ expression[J].J Steroid Biochem MolBiol,2002,81(4 -5):327 -332.
[9]Wang X,Simpkins JW,Dykens JA,et al.Oxidative damage to human lens epithelial cells in culture:estrogen protection of mitochondrial potential,ATP,and cell viability[J].Invest Ophthalmol Vis Sci,2003,44(5):2067 -2075.
[10]Moor AN,Flynn JM,Gottipati S.17β -estradiol stimulates MAPK signaling pathway in human lens epithelial cell cultures preventing collapse of mitochondrial membrane potential during acute oxidative stress[J].Mitochondrion,2005,5(4):235-247.
[11]Moor AN,Gottipati S,Mallet RT,et al.A putative mitochondrial mechanism for antioxidative cytoprotection by 17 beta - estradiol[J].Exp Eye Res,2004,78(5):933 -944.
[12]Flynn JM,Cammarata PR.Estradiol attenuates mitochondrial depolarization in polyol-stressed lens epithelial cells[J].Mol Vis,2006,12(4):271 -282.
[13]Gottipati S,Cammarata PR.Mitochondrial superoxide dismutase activation with 17 beta-estradiol-treated human lens epithetlial cells[J].Mol Vis,2008,14(5):898 -905.
[14]赵丕文,牛建昭,王继峰,等.异补骨脂素和蜕皮甾酮对人乳腺癌T47D细胞增殖及ER亚型表达的影响[J].北京中医药大学学报,2007,30(4):242 -245.
[15]Nagira K,Sasaoka T,Wada T,et al.Altered subcellular distribution of estrogen receptor is implicated in estradiol-induced dual regulation of insulin signaling in 3T3-L1 adipocytes[J].Endocrinology,2006,147(2):1020 -1028.
