碘酸钠诱导大鼠视网膜损伤的病理改变和SOD、CAT的变化*
2010-08-02朱颖婷邓新国何梅凤
朱颖婷, 邓新国, 高 杨, 何梅凤, 李 娜
(中山大学中山眼科中心,中山大学眼科学国家重点实验室,广东 广州 510060)
遗传性视网膜色素变性(retinitis pigmentosa,RP)是一组常见的遗传性、致盲性视网膜疾病,以视网膜光感受器和色素上皮功能进行性受损为主要特征[1]。目前实验证明该病的发病机制与视杆细胞和视锥细胞相继死亡有关[2,3]。一般情况下,视杆细胞先死亡,继发引起视锥细胞死亡,可能的原因如下:视杆细胞死亡后释放毒性物质;激活小胶质细胞释放毒性物质的直接作用;视杆细胞死亡后,无法提供视锥细胞生存必须的营养物质;视杆细胞死亡后,脉络膜血管氧供给量不变,导致视网膜氧超载。
常用于研究视网膜色素变性的动物模型有如下几种,包括rd小鼠、rds小鼠和RCS大鼠等遗传性动物模型;RPE-65基因敲除、视紫红质(rhodopson)基因敲除和P23H基因突变等转基因鼠模型;光照损伤所致的大、小鼠视网膜变性动物模型;以及致突变剂N-甲基-N-亚硝脲(N-methyl-N-nitrosourea,MNU)[4]和碘酸钠所致视网膜变性动物模型。以上动物模型主要涉及视网膜外核层的光感受器细胞损伤或视网膜色素上皮细胞(retinal pigment epithelium,RPE)损伤。
碘酸钠诱导视网膜色素变性模型的特点是,选择性地引起RPE损伤,继而导致视网膜光感受器细胞等组织的损伤[5]。目前国内外的研究多集中于其造成的形态学改变及功能学改变[6],但对其造成的氧化损伤机制未见报道。氧化应激是视网膜损伤过程中的重要机制之一,本实验意在通过检测碘酸钠造模后视网膜超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)的活性,探讨碘酸钠诱导视网膜色素变性的氧化损伤机制。
材料和方法
1 材料
1.1 主要仪器和试剂 冰冻切片机(Leica,CM1850)、倒置显微镜(Carl Zeiss)、UV-1700分光光度计(日本岛津)、数显恒温水浴锅(荣华仪器制造有限公司)、组织粉碎机(广州展晨生物科技公司),台式低速自动平衡离心机(长沙湘智离心机仪器有限公司)。SOD、CAT试剂盒购自南京建成生物工程研究所。
2 方法
2.1 实验动物及分组 SPF级SD大鼠80只,5周龄,体重80-100 g,雄性,由广州中医药大学实验动物中心提供。随机分为4组,分别为40 mg/kg、50 mg/kg、60 mg/kg碘酸钠造模组和正常对照组。造模组经尾静脉注射不同剂量的碘酸钠(20 g/L),正常对照组经尾静脉注射等量生理盐水。本研究中所用的实验方法均严格按照ARVO关于实验动物使用规定进行。
2.2 病理学检查及损伤程度分级 采用氯胺酮过量麻醉法处死大鼠,完整摘除右眼球,每组3只眼球采用4%甲醛固定,常规脱水、透明、浸蜡包埋,切片染色观察;另外2只眼球采用4%多聚甲醛固定2 h、12.5%蔗糖脱水1 h、30%蔗糖脱水1 h,进行冰冻切片后,HE染色观察。
2.3 病理学评分 根据碘酸钠所致视网膜色素上皮和外核层细胞损伤的程度制定以下评级标准,并转化为数字,进行统计学计算:0级(0分):视网膜结构正常;1级(1分):色素上皮层损伤,外核层排列轻度紊乱或外核层波浪状改变占视网膜全长≤1/5,外核层厚度减少不明显;2级(2分):色素上皮层损伤,外核层排列紊乱,外核层波浪状改变占视网膜全长≤2/5,外核层厚度减少不明显;3级(3分):色素上皮层损伤,外核层排列紊乱,外核层波浪状改变占视网膜全长≤4/5,外核层厚度减少≤1/2;4级(4分):色素上皮层增厚,外核层排列紊乱,外核层波浪状改变占视网膜全长≤4/5,外核层厚度减少>1/2。
2.4 SOD、CAT水平的测定 完整摘除左眼球,全层钝性分离视网膜组织,称重后用生理盐水配成5%组织悬液,冰浴匀浆10000 r/min离心3 min后3000 r/min离心15 min,取出上清液。根据南京建成生物工程研究所试剂说明书提供的方法,应用黄嘌呤氧化酶法对SOD活性进行测定,于波长550 nm处检测;应用钼酸铵终止法对CAT活性进行测定,于波长405 nm处检测。
3 统计学处理
应用SPSS统计软件对实验数据进行统计分析。数据以均数±标准差()表示。病理学评分采用秩和检验(Kruskal-Wallis test),SOD和CAT活性采用方差分析(one-way ANOVA)比较组间差异。
结 果
1 不同剂量碘酸钠诱导大鼠视网膜色素变性的病理损伤程度变化
统计结果显示,与正常对照组相比,60 mg/kg碘酸钠造模组第1 d,40 mg/kg和50 mg/kg碘酸钠造模组第4 d,大鼠视网膜色素上皮细胞或外核层细胞出现明显的病理损伤(P<0.05或P<0.01);各剂量组4 d、7 d、14 d的病理损伤均比1 d时要重,差异显著(P<0.05或P<0.01),见表1、图1。
2 不同剂量碘酸钠诱导视网膜色素变性的视网膜组织SOD、CAT测定结果
与对照组相比,造模1 d和4 d,60 mg/kg碘酸钠造模组SOD活性明显下降(P<0.01);造模7 d和14 d,各剂量组SOD活性均明显下降(P<0.05或P<0.01)。结果表明,40 mg/kg、50 mg/kg和60 mg/kg碘酸钠在7 d后均可诱导大鼠视网膜SOD活性降低,见表2。
表1 不同剂量碘酸钠在不同时点诱导大鼠视网膜病理损伤程度的比较Table 1.The comparison of the levels of retinal pathological damage of the model rats indcued by different doses of sodium iodate at different times(.n=5)

表1 不同剂量碘酸钠在不同时点诱导大鼠视网膜病理损伤程度的比较Table 1.The comparison of the levels of retinal pathological damage of the model rats indcued by different doses of sodium iodate at different times(.n=5)
*P <0.05,**P <0.01 vs control group;△P <0.05,△△P <0.01 vs 1 d group.
Group 1 d 4 d 7 d 14 d Control 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 NaIO340 mg/kg 0.00±0.00 1.80±0.49*△ 1.67±0.61*△ 1.60±0.60*△NaIO350 mg/kg 0.40±0.24 2.00±0.44** 2.33±0.33**△△ 3.00±0.32**△△NaIO360 mg/kg0.80±0.20* 2.60±0.40**△ 2.50±0.34**△ 3.20±0.34**△△
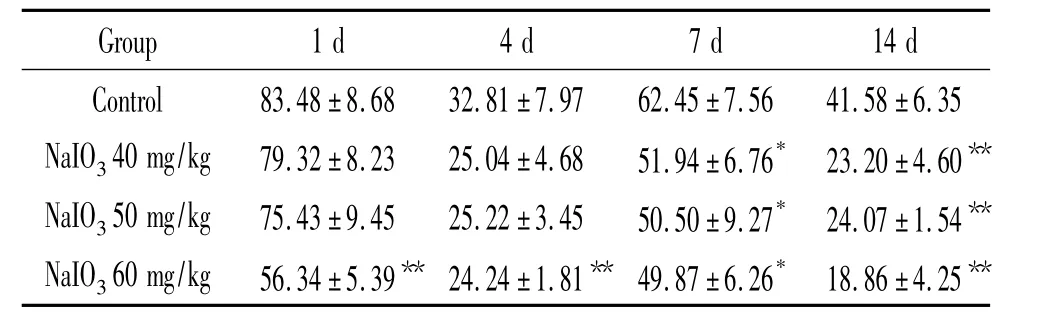
表2 不同剂量碘酸钠在不同时点诱导大鼠视网膜色素变性的视网膜组织SOD的比较Table 2.The comparison of SOD activity in the retina tissues of model rats induced by different doses of sodium iodate at different time
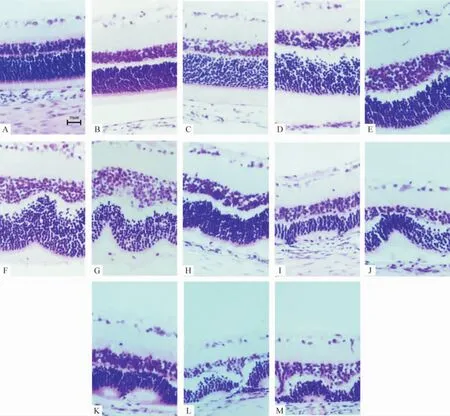
Figure 1.Retinal pathological damage induced by different doses of sodium iodate at different time in rats.A:retinal pathological damage in control group;B,E,H,K:retinal pathological damage at the dosage of 40 mg/kg sodium iodate on day 1,4,7 and 14 respectively;C,F,I,L:retinal pathological damage at the dosage of 50 mg/kg sodium iodate on day 1,4,7 and 14;D,G,J,M:retinal pathological damage at the dosage of 60 mg/kg sodium iodate on day 1,4,7 and 14;D:the reduction of retinal pigment epithelial cells and the disorder of retinal photoreceptor arrangement;E-M:damage of retinal pigment epithelial cells,waveform appearance in retinal out nuclear layer and decrease of photoreceptor nuclear.The damage in retina was more severe following the increasing doses and time of sodium iodate.图1 不同剂量碘酸钠在不同时点诱导大鼠视网膜病理损伤
与对照组相比,造模1 d和4 d,60 mg/kg碘酸钠造模组CAT活性明显下降(P<0.05);造模7 d和14 d,各剂量组CAT活性均明显下降(P<0.05或P<0.01)。结果表明,40 mg/kg、50 mg/kg和60 mg/kg碘酸钠在7 d后均可诱导大鼠视网膜CAT活性降低,见表3。
讨 论
碘酸钠是一种无机氧化剂,超大剂量碘酸钠(100 mg/kg)能在6 h后造成视网膜色素上皮细胞坏死和24 h后外核层细胞排列紊乱和凋亡[5]。多数学者常用40-60 mg/kg碘酸钠进行实验,均可诱导大鼠视网膜色素上皮和光感受器细胞损伤。我们选用40 mg/kg、50 mg/kg和60 mg/kg碘酸钠进行实验,在第1、4、7和14 d观察视网膜的变化,结果显示,60 mg/kg碘酸钠造模组第1 d,40 mg/kg和50 mg/kg碘酸钠造模组第4 d,大鼠视网膜色素上皮细胞或外核层细胞出现明显的病理损伤,视网膜色素上皮细胞在最初的损伤中,细胞数减少,继而完全丢失;视网膜外核层在最初的损伤中出现细胞排列紊乱和轻度的波浪状改变,随时间的增加,这种改变加重,且外核层细胞减少明显,外核层变薄。碘酸钠的用量越大,成模越早,损伤越重。我们的结果与其它文献报导的结果相似[5-8]。

表3 不同剂量碘酸钠在不同时点诱导大鼠视网膜色素变性的视网膜组织CAT的比较Table 3.The comparison of CAT activity in the retina tissues of model rats induced by different doses of sodium iodate at different time
本实验根据病理检查结果,为碘酸钠诱导视网膜色素变性的病理结构改变制订了一种分级评分标准。从研究结果可见,该评分标准能反映碘酸钠诱导视网膜病理改变的病程综合变化,而不是散在地观察各个结构的损伤,这样更有利于判断视网膜结构损伤的程度,可为今后造模剂量和时间的选择以及治疗效果的评价提供有效参考。
氧化应激是指机体内氧自由基的产生与清除失衡,导致活性氧在体内堆积产生毒性,引起多不饱和脂肪酸的脂质过氧化(lipid peroxidation,LPO)反应,从而导致组织损伤的过程。视细胞外节是体内含长链不饱和脂肪酸最高的组织,这些不饱和脂肪酸具有易受自由基攻击的亚甲基结构,易与·OH发生LPO反应。在视网膜色素变性中,缺乏自调机制的脉络膜血管供氧过多[9]、NO引起的过氧化亚硝酸盐增多[10,11]等都能导致视网膜细胞的氧化应激损伤,直接损伤细胞中的蛋白和DNA等大分子物质。
而SOD对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能通过歧化反应清除超氧阴离子自由基(O-·2)保护细胞免受损伤。CAT则通过另外一种途径清除氧化自由基,它使过氧化氢(H2O2)还原为H2O,阻止羟自由基(·OH)的生成,并可终止自由基链反应。外源性SOD和CAT作为抗氧化酶已被证明对视网膜的保护作用[12],而内源性共同表达SOD2和CAT也能显著减缓视网膜色素变性中视锥细胞的死亡[13]。碘酸钠的氧化作用与IO-3有关[14],抗氧化系统的损伤加速脂质过氧化物的产生,从而可导致细胞重要的蛋白和DNA受到破坏[15],细胞的形态、结构和功能发生改变,甚至损伤和死亡。
从本实验生化检测结果可知,在短时间内,只有较大剂量的碘酸钠对视网膜组织的抗氧化系统造成了损伤,而较小剂量碘酸钠对视网膜组织SOD和CAT的影响只在较长时间后显现出来。在各时点,造模组视网膜组织SOD与CAT水平的下降存在剂量依赖性,这与其结构损伤的趋势是类似的。说明碘酸钠对视网膜的损伤存在剂量依赖性,氧化应激损伤是碘酸钠诱导的视网膜色素变性的机制之一,而SOD和CAT在视网膜抗氧化系统中起着重要的作用。
[1]Kalloniatis M,Fletcher EL.Retinitis pigmentosa:understanding the clinical presentation,mechanism and treatment options[J].Clin Exp Optom,2004,87(2):65-80.
[2]Ripps H.Cell death in retinitis pigmentosa:Gap junction and the‘bystander’effect[J].Exp Eye Res,2002,74(3):327-336.
[3]Leverillard T,Mohand -Said S,Lorentz O,et al.Identification and characterization of rod-derived viability factor[J].Nat Genet,2004,36(7):755 -759.
[4]邓新国,葛 坚,何梅风,等.不同MNU剂量诱导大鼠视网膜光感受器细胞损伤的视网膜电图和病理形态的改变[J].中国病理生理杂志,2008,24(4):828-832.
[5]Kiuchi K,Yoshizawa K,Shikata N,et al.Morphologic characteristics of retinal degeneration induced by sodium iodate in mice[J].Curr Eye Res,2002,25(6):373 -379.
[6]Enzmann V,Row BW,Yamauchi Y,et al.Behavioral and anatomical abnormalities in a sodium iodate-induced model of retinal pigment epithelium degeneration[J].Exp Eye Res,2006,82(3):441 -448.
[7]Gong LH,Wu Q,Song B,et al.Differentiation of rat mesenchymal stem cells transplanted into the subretinal space of sodium iodate - injected rats[J].Clin Exp Ophthalmol,2008,36(7):666 -671.
[8]Ohtaka K,Machida S,Ohzeki T,et al.Protective effect of hepatocyte growth factor against degeneration of the retinal pigment epithelium and photoreceptor in sodium iodate- injected rats[J].Curr Eye Res,2006,31(4):347 -355.
[9]Komeima K,Rogers BS,Campochiaro PA.Antioxidants slow photoreceptor cell death in mouse models of metinitis pigmentosa[J].J Cell Physiol,2007,213(3):809 -815.
[10]Komeima K,Usui S,Shen J,et al.Blockade of neuronal nitric oxide synthase reduces cone cell death in a model of retinitis pigmentosa[J].Free Radic Biol Med,2008,45(6):905-912.
[11]Sanz MM,Johnson LE,Ahuja S,et al.Significant photoreceptor rescue by treatment with a combination of antioxidants in an animal model for retinal degeneration[J].Neuroscience,2007,145(3):1120 -1129.
[12]王雨生,严 密,彭文珍.可见光对培养的人RPE细胞生长的影响以及SOD和CAT的防护作用[J].中华眼底病杂志,1996,12(4):230-232.
[13]Usui S,Komeima K,Lee SY,et al.Increased expression of catalase and superoxide dismutase 2 reduces cone cell death in retinitis pigmentosa[J].Mol Ther,2009,17(5):778-786.
[14]黄文金,陈志辉.碘酸盐的毒理学研究进展[J].海峡预防医学杂志,2002,8(1):79-80.
[15]Shen J,Yang X,Dong A,et al.Oxidative damage is a pothential cause of cone cell death in retinitis pigmentosa[J].J Cell Physiol,2005,203(3):457 -464.
