p38MAPK介导高糖下调肾小管上皮细胞表达BMP-7*
2010-08-02方开云石明隽刘瑞霞桂华珍张国忠
肖 瑛, 方开云, 石明隽, 刘瑞霞, 桂华珍, 郭 兵, 张国忠
(贵阳医学院病理生理学教研室,贵州 贵阳 550004)
有研究表明[1,2],高糖状态和糖尿病肾病时肾小管上皮细胞表达骨形态发生蛋白-7(bone morphogenetic protein-7,BMP-7)减少,给予外源性 BMP-7或转基因过表达BMP-7可改善肾小管间质纤维化,逆转肾小管上皮细胞向间充质细胞转化,减少肾小管上皮细胞的丢失,促进肾小管上皮细胞功能的恢复。但高糖通过何种途径下调肾小管上皮细胞表达BMP-7尚未见明确的报道。本课题组动物实验研究提示[3],高糖环境可激活p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38MAPK)并且p38MAPK可能介导了糖尿病时BMP-7表达的下调,促进肌成纤维细胞活化,引起细胞外基质的大量沉积。为进一步证实p38MAPK是否确实参与高糖下调BMP-7的机制,我们进行了以下研究。
材料和方法
1 材料
1.1 动物 雄性SD大鼠,重30-40 g,由贵阳医学院实验动物中心提供。
1.2 主要试剂 链脲佐菌素(STZ,Sigma),山羊抗大鼠BMP-7多克隆抗体、羊抗大鼠p38MAPK、pp38MAPK多克隆抗体、驴抗山羊 -HRP(Santa Cruz),兔抗大鼠纤维连接蛋白(fibronectin,FN)多克隆抗体、抗CK18抗体、抗α-SMA抗体(武汉博士德公司),UltraSensitiveTMSP超敏试剂盒(羊)(福州迈新生物技术开发有限公司,KIT-9709/9719),培养细胞 RNA提取试剂盒、Taq PCR MasterMix、DNA MarkerⅠ(北京TIANGEN生物技术有限公司),RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas);p38MAPK特异性阻断剂SB202190(Calbiochem);低糖DMEM(HyClone);胎牛血清、胰蛋白酶(Gibco Introvagen),D -glucose、D -mannitol(BBI)。
2 方法
2.1 大鼠原代肾小管上皮细胞的培养和鉴定 SD大鼠乙醚麻醉后无菌操作取出肾脏,去掉包膜和髓质,留下皮质剪碎后于80目筛网研磨,100目收集沉淀入离心管内,0.25%胰蛋白酶37℃消化30 min,1500 r/min离心10 min,含10%胎牛血清的DMEM终止消化,经台盼蓝计数后以2×105细胞接种于培养瓶,置37℃、5%CO2培养箱中培养。贴壁生长的肾小管上皮细胞采用0.25%胰蛋白酶+0.02%EDTA·Na2消化传代,取3代细胞经鉴定为肾小管上皮细胞后进行下列分组实验,重复4次。
鉴定依据参照方开云等[4]报道:(1)细胞生长周期和形态;(2)免疫细胞化学方法检测角蛋白18(CK18)阳性和α-SMA阴性为肾小管上皮细胞。
2.2 原代肾小管上皮细胞实验分组 待细胞生长融合至约80%时,换无血清含5.5 mmol/L葡萄糖的DMEM培养基培养24 h,使细胞生长同步于静止期。将细胞分为(1)正常对照组,用DMEM+10%FCS培养;(2)高糖组,用20 mmol/L D-glucose+DMEM+10%FCS培养;(3)SB202190处理组,用 SB20219020 μmol/L预处理细胞40 min,然后加入20 mmol/L D-glucose+DMEM+10%FCS培养;(4)高渗组,用20 mmol/L D-mannitol+DMEM+10%FCS培养,72 h后收集细胞。
2.3 免疫细胞化学检测BMP-7和FN的表达 于6孔板培养各组细胞72 h后,爬片经PBS洗涤3次后用4%多聚甲醛固定,0.1%TritonX-100打孔,采用SP法,分别加入BMP-7和FNⅠ抗(工作浓度均为1∶50),4℃孵育过夜,PBS缓冲液替代Ⅰ抗作为阴性对照。第2 dⅡ抗孵育,DAB显色。
2.4 Western blotting检测p38MAPK和p-p38MAPK蛋白水平 取培养瓶中每106个细胞加裂解液200 μL,4℃裂解30 min,离心取上清测定蛋白含量,经SDS-PAGE垂直凝胶电泳后,300 mA电转移至PVDF膜。5%脱脂奶粉室温封闭2 h,TBS洗膜后分别加抗 p38MAPK(1∶200)和 p-p38MAPK(1∶200)抗体4℃孵育过夜;加Ⅱ抗室温孵育2h,ECL试剂曝光。用抗体剥脱液剥脱抗体后,按同样的方法与抗β-actin抗体(1∶300)孵育。凝胶成像系统进行图像分析。以β-actin蛋白条带作内参照,结果用靶蛋白/β-actin比值表示。
2.5 RT-PCR检测BMP-7和FN mRNA水平 用Trizol试剂提取肾小管上皮细胞总RNA,核酸蛋白分析仪检测含量。0.5 μg总RNA以Oligo(dT)18primer为反转录引物,合成cDNA。以cDNA为模板按逆转录试剂盒方法进行RT-PCR。引物自行设计,由上海捷瑞生物工程有限公司合成。BMP-7引物序列为:上游 5'-GCACCTCCAGGGAAAAC -3',下游 5'-AAGCCCAGATGGTACGG-3',扩增产物长度为451 bp;β-actin引物序列为:上游5'-TGGCATTGTGATGGACTC -3',下游5'-CCGATAGTGATGACCTGAC-3',扩增产物长度为306 bp;PCR反应条件:94℃预变性5 min,94℃ 45 s,56.3℃ 30 s,72℃45 s,40个循环后充分延伸10 min。FN引物序列为:上游5'-GGACACTATGCGGGTCACTT-3',下游 5'-TCAAAACCAGTTGGGGAGTC -3',扩增产物长度为 291bp;β-actin引物序列为:上游 5'-GAAATCGTGCGTGACATTAAG -3',下游 5'-CTAGAAGCATTTGCGGTGGA-3',扩增产物长度为490 bp;PCR反应条件:94℃预变性2 min,94℃30 s,54.2℃ 30 s,72℃ 30 s,40个循环后充分延伸10 min。最后将扩增产物于1.5%琼脂糖凝胶电泳,应用凝胶成像系统进行扫描并用ChmioDox软件分析图像,PCR产物量以吸光度值×面积表示,与β-actin比值表示BMP-7和FN的相对含量。
3 统计学处理
结 果
1 肾小管上皮细胞的生长状况及鉴定
细胞的生长从培养48 h开始,肾小管节段周围可见卵圆形上皮样细胞长出,围绕肾小管呈岛屿状向四周逐渐增大,见图1。第5-6 d基本铺满培养瓶底部,细胞形态为多边鹅卵石样,体积较大、镜下透明度及折光性强,各细胞互相紧密相靠,可见融合成片及复层生长。经胰酶消化传代后,肾小管上皮细胞以单个细胞贴壁并呈对数生长,符合上皮细胞生长特性。
细胞爬片行免疫细胞化学染色显示,CK18均呈棕黄色、α-SMA未见阳性染色表示其为肾小管上皮细胞,见图2。
2 免疫细胞化学显示BMP-7和FN蛋白的表达
免疫细胞化学显示,BMP-7主要表达于对照组肾小管上皮细胞胞浆,高糖组BMP-7的表达显著减少,SB202190处理组表达则较高糖组明显增多,与高渗组比较无显著差异。对照组有少量FN蛋白表达,高糖组较对照组显著升高,SB202190处理组与高糖组比较显著减少,高渗组与对照组相比无显著差异,见图3。
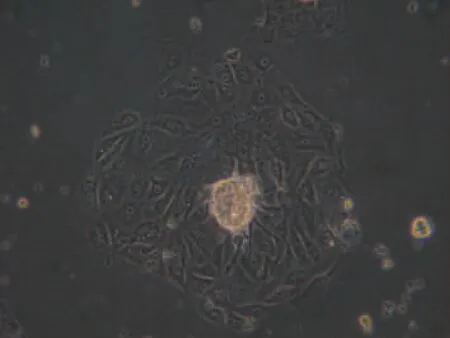
Figure 1.Morphology of primary renal tubular epithelial cells(3 rd day of incubation,×200).图1 原代培养肾小管上皮细胞活体观察

Figure 2.The expression of CK18 and α - SMA proteins in primary renal tubular epithelial cells(SABC,×400).A:CK18;B:α -SMA.图2 免疫细胞化学显示CK18和α-SMA在肾小管上皮细胞的表达
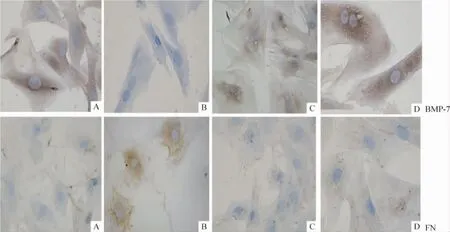
Figure 3.Immunocytochemistry shows the expression of BMP-7 and FN protein in primary renal tubular epithelial cells from control(A),high glucose(B),SB202190-treated(C)and D-mannitol(D)groups(SABC,×400).图3 免疫细胞化学显示BMP-7和FN在肾小管上皮细胞中的表达
3 Western blotting显示p38MAPK和p-p38MAPK蛋白表达
Western blotting结果显示在培养的肾小管上皮细胞,对照组有少量 p38MAPK表达,p-p38MAPK基本没有表达。高糖刺激72 h后,总p38MAPK和p-p38MAPK蛋白表达明显增加(P<0.05),SB202190处理组总p38MAPK的变化不大,而pp38MAPK的表达却显著降低,较高糖组减少约80%(P<0.05),表明 SB202190能有效抑制 p38MAPK磷酸化,见图4。
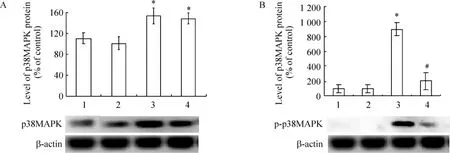
Figure 4.The levels of p38MAPK(A)and p-p38MAPK(B)proteins in primary renal tubular epithelial cells by Western blotting.1:control;2:mannitol;3:high glucose;4:SB202190+high glucose..n=3.*P<0.05 vs control group;#P<0.05 vs high glucose group.图4 Western blotting检测p38MAPK(A)和p-p38MAPK(B)蛋白在肾小管上皮细胞中的表达
4 RT-PCR显示BMP-7和FN的mRNA水平
在正常糖浓度培养的肾小管上皮细胞中BMP-7 mRNA水平较高,与在高渗环境中无差异,高糖组其转录水平下降约100%,而SB202190处理组BMP-7 mRNA水平显著提高,甚至超过正常对照组。而FN在正常糖浓度与高渗环境中转录水平很低,高糖组转录水平明显提高,而SB202190处理组FN mRNA明显减少,见图5。

Figure 5.The levels of BMP -7 and FN mRNAs in primary renal tubular epithelial cells.1:control;2:mannitol;3:high glucose;4:SB202190+high glucose..n=4.**P<0.01 vs control group;##P<0.01 vs high glucose group.图5 BMP-7和FN mRNA在肾小管上皮细胞中的表达
讨 论
有研究发现在肾脏发育过程中,BMP-7能促使输尿管芽形成和肾脏上皮细胞从间充质细胞分化从而形成正常肾组织。而肾脏疾病时,BMP-7可以上调上皮细胞表型的标志物E-钙黏素的表达,从而抑制EMT以维持正常肾脏细胞表型;减少上皮细胞凋亡,促进细胞增殖,从而减轻纤维化;抑制促炎症因子的释放,减少炎症细胞的浸润,减轻间质纤维化;能够拮抗TGF-β1的致肾纤维化作用而发挥其抑制肾纤维化的作用;促进ECM的降解;因此BMP-7已被证实在调节和控制肾小管间质纤维化和肾小球硬化中扮演重要角色[5]。DN时肾组织 BMP-7表达减少,外源性给予或促进内源性BMP-7恢复可保护甚至逆转DN肾功能和病理改变,且BMP-7作为一种内源性分子,作为药物治疗DN其毒性几乎为零[6]。我们前期的研究发现[3,7],STZ 诱导的 DM大鼠模型随病程延长肾皮质BMP-7的表达较正常对照组显著减少,与肾小管间质损害程度呈显著负相关,使用胰岛素或中药丹芪合剂在促进内源性BMP-7表达恢复的同时ECM沉积和肾小管间质损害程度被显著减轻。由于目前研究BMP-7多在细胞株培养,而在原代肾小管上皮细胞加入高糖培养的研究较少,故本实验观察了从大鼠肾皮质提取肾小管节段进行原代肾小管上皮细胞培养,传至3代后静止24 h加入20 mmol/L D-glucose孵育,发现随着培养时间的延长,BMP-7的表达也是逐渐减少的,至72 h后其mRNA表达几乎缺失,与体内实验变化是一致的。
p38MAPK属于丝裂原活化蛋白激酶信号分子家族,该信号分子可被磷酸化为p-p38MAPK而激活,完成由胞浆移位至胞核的核转位过程,进而调节相关基因转录[8,9]。我们体内实验观察到从DM 2周开始p-p38MAPK胞核阳性染色,8周组达高峰,此后一直维持在高水平。BMP-7mRNA的减少与pp38MAPK增多平行,并且 BMP-7蛋白与 pp38MAPK表达呈负相关,提示了DM肾小管上皮细胞p38MAPK与BMP-7之间可能存在相互调节关系[3]。这与 Motazed等[10]在人近曲小管上皮细胞中发现相一致。但是这并不能确切表明p38MAPK可作为BMP-7的上游信号分子来调节其表达。为了进一步观察p38MAPK是否参与高糖下调BMP-7的表达,我们在原代培养的肾小管上皮细胞中加入高糖共同孵育的研究来进行观察。研究发现在正常糖培养环境下,肾小管上皮细胞BMP-7蛋白表达和转录水平均较高,有少量总p38MAPK表达,但未见活化的p38MAPK;高糖刺激72 h后,总p38MAPK和p-p38MAPK蛋白表达明显增加,p-p38MAPK增加尤为明显,而BMP-7蛋白和mRNA的表达却显著减少,FN蛋白和mRNA的表达也显著增多;在高糖环境中应用p38MAPK特异性阻断剂SB202190处理 72 h后,总 p38MAPK的变化不大,而 pp38MAPK的表达却显著降低,较高糖组减少约80%,同时BMP-7蛋白和mRNA的表达却由此明显增多,说明该抑制剂减少了活化的p38MAPK,这可能解除了对BMP-7的抑制作用而使内源性BMP-7的表达恢复且伴随FN的沉积减少,提示p38MAPK信号通路参与介导高糖刺激下肾小管上皮细胞BMP-7表达下调,阻断此信号通路可引起内源性BMP-7表达上调,从而使细胞外基质FN减少。这与在软骨细胞的研究[11]一致。
通过体内体外实验,虽然发现p38MAPK信号通路可能参与介导HG刺激肾小管上皮细胞BMP-7表达的下调,得到p38MAPK可作为BMP-7的上游信号,参与调节BMP-7的作用。但是p-p38MAPK是如何调节BMP-7的还不清楚,其作用环节有待进一步研究。
[1]Hu MC,Wasserman D,Hartwig S,et al.p38MAPK acts in the BMP7-dependent stimulatory pathway during epithelial cell morphogenesis and is regulated by Smad1[J]J Biol Chem,2004,279(13):12051 -12059.
[2]Turk T,Leeuwis JW,Gray J,et al.BMP signaling and podocyte markers are decreased in human diabetic nephropathy in association with CTGF overexpression[J].J Histochem Cytochem,2009,57(7):623-631.
[3]肖 瑛,方开云,石明隽,等.糖尿病大鼠肾小管BMP-7和p38MAPK表达关系的研究[J].中国现代医学杂志,2009,19(16):2417 -2421.
[4]方开云,石明隽,肖 瑛,等.Snail1 siRNA对高糖诱导肾小管上皮细胞表型转变的影响[J].中国病理生理杂志,2009,25(12):2424 -2429.
[5]Motazed R,Colville-Nash P,Jonathan T,et al.BMP -7 and proximal tubule epithelial cells:activation of multiple signaling pathways reveals a novel anti-fibrotic mechanism[J].Pharm Res,2008,25(10):2440 -2446.
[6]Zeisberg M,Muller GA,Kalluri R,et al.Are there endogenous molecules that protect kidneys from injury?The case for bone morphogenetic protein-7(BMP-7)[J].Nephrol Dial Transplant,2004,19(4):759 - 761.
[7]肖 瑛,石明隽,桂华珍,等.丹芪合剂对DM大鼠肾小管BMP-7及其受体表达的影响[J].时珍国医国药,2009,20(10):2495 -2497.
[8]方开云,石明隽,肖 瑛,等.p38MAPK介导高糖诱导的肾小管上皮细胞向间充质细胞转变[J].生理学报,2008,60(6):759 -766.
[9]王 岚,李 英,程万里,等.氯沙坦对糖尿病大鼠肾小管间质p38MAPK和TGF-β1表达的影响[J].中国病理生理杂志,2008,24(3):607-609.
[10]Motazed R,Colville - Nash P,Kwan JT,et a1.BMP - 7 and proximal tubule epithelial cell:activation of multiple signaling pathways reveals a novel antifibrotic mechanism[J].Pharm Ras,2008,25(10):2440 -2446.
[11]Nishihara A,Fujii M,Sampath TK,et al.Bone morphogenetic protein signaling in articular chondrocyte differentiation[J].Biochem Biophys Res Commun,2003,301(2):617-622.
