普罗布考和辛伐他汀对高级糖基化终末产物诱导的大鼠肾脏微血管内皮细胞的ROS含量和HO-1表达影响
2010-08-02杨向红
王 哲, 马 铁, 杨向红△
(中国医科大学附属盛京医院1输血科,2病理科,辽宁 沈阳 110004)
糖尿病肾病(diabetic nephropathy,DN)是当前终末期肾病最常见原因之一。在糖尿病的发病机制中氧化应激被认为是中心环节,因为它不仅能促进高级糖基化终末产物(advanced glycation end products,AGEs)的形成,还能导致DNA损伤、一氧化氮(nitric oxide,NO)合成减少和失活,以及促进蛋白激酶C丝裂原活化蛋白激酶(protein kinases C-mitogen-activated protein kinases,PKC - MAPK)激活[1]。因此,应用抗氧化剂治疗糖尿病肾病成为临床研究热点[3]。血红素氧合酶1(heme oxygenase-1,HO -1)又称为热休克蛋白 32(heat shock protein-32,HSP32),广泛存在于哺乳动物的微粒体中。近年研究发现,HO-1在各种应激过程中均有适应性表达[2]。由于糖尿病本身的特殊性以及微血管与大血管相比无论是组织来源还是形态结构、功能作用方面都存在差异,有关AGEs对肾脏微血管内皮细胞中ROS含量以及HO-1表达影响相关的体外研究甚少。因此,我们在体外建立糖尿病肾脏微血管病变的体外模型的基础上,观察AGEs对大鼠肾脏微血管内皮细胞(rat renat microvascular endotheliat cells,RMECs)活性氧(reactive oxygen species,ROS)生成以及HO-1表达的影响,探讨抗氧化剂丙丁酚(又名普罗布考,probucol)和辛伐他汀的作用机制,以寻求防治糖尿病肾病的有效方法。
材料和方法
1 动物与试剂
3-8 d龄SD胎大鼠(中国医科大学实验动物部);普罗布考原料药、辛伐他汀原料药(齐鲁药业);胰蛋白酶(Biosharp);高糖DMEM培养基(Gibco);胎牛血清(Costar);兔抗鼠Ⅷ因子相关抗原(Santa Cruz);Matrigel胶(BD);活性氧检测试剂盒(南京建成);总RNA提取试剂Trizol(Bio Basic Inc.);TaKa-Ra RNA PCR Kit(AMV)Ver.3.0(宝生物工程);兔抗鼠HO-1单克隆抗体(Santa Cruz)。辣根过氧化物酶标记的羊抗兔IgG及DAB显色试剂盒(北京中杉)。
2 原代RMECs分离培养与鉴定
参照Green等[4]的三步梯度筛网法收集200目网上肾血管球,然后应用0.125%胰蛋白酶37℃消化分离肾小球后接种于RMECs培养液中(20%胎牛血清,DMEM,青、链霉素各1×105U/L,20 mg/L内皮细胞生长因子,肝素钠100 mg/L)。根据细胞贴壁速度不同的特点,应用反复贴壁法逐步将微血管内皮细胞分离。综合形态学、免疫细胞化学和管腔样结构实验对培养的细胞进行鉴定。
3 糖基化修饰的牛血清白蛋白(advanced glycation end products-bovine serum albumin,AGE -BSA)的制备与检测
将小牛血清白蛋白50 g/L与0.5 mmol/L葡萄糖溶于磷酸盐缓冲液中,室温放置过夜,对照组中不含葡萄糖,其余条件一致。过滤除菌后置37℃避光孵育3个月。实验前置于透析膜中,去除未结合的葡萄糖。荧光光谱扫描检测AGE-BSA。
4 实验分组
取培养第3-6代RMECs进行实验,先用无血清培养基同步化48 h后,再进行随机分组。对照组,含RMECs完全培养基培养48 h;AGE-BSA损伤组,先以对照组培养基培养45 h,再更换为含100 mg/L AGE-BSA的培养基处理3 h;,probucol+AGE-BSA组,先加入含50 μmol/L probucol培养基处理 12 h,再更换为对照培养基培养33h,最后用含100 mg/L AGE-BSA的培养基处理3 h;simvastatin+AGEBSA处理组,先加入含50 μmol/L simvastatin培养基处理12 h,再更换为对照培养基培养33 h,最后用含100 mg/L AGE-BSA的培养基处理3 h。
5 RMECs中ROS含量的测定
采用2',7'二氯荧光黄双乙酸盐(DCFH-DA)荧光染色检测各组细胞中ROS,流式细胞仪测定其荧光强度。
6 HO-1 mRNA水平的检测
应用逆转录聚合酶链反应法测定经上述处理后的各组细胞HO-1 mRNA含量。提取细胞总RNA。将PCR产物在2%琼脂糖凝胶上电泳,紫外灯下凝胶成像分析系统记录结果,待测基因mRNA相对表达量以扩增带吸光度与相应内参照扩增带吸光度的比值表示。
7 HO-1蛋白的测定
Western blotting检测HO-1蛋白表达,裂解液提取细胞蛋白水平,最后于DAB中显色,30 min内观察结果。图像采用凝胶成像分析系统获得目的条带和GAPDH的平均灰度值,以目的条带与GAPDH的比值变化来衡量各基因表达的相对变化。
8 统计学处理
结 果
1 RMECs的鉴定
光镜下观察细胞的形态,原代培养的RMECs呈多角形或短梭形,培养6-8 d后细胞融合成单层。荧光显微镜下观测细胞阳性表达Ⅷ因子相关抗原。将传代的内皮细胞接种到matrigel上12 h后,光镜下观察细胞成血管样结构,见图1。

Figure 1.Identification of rat renal microvascular endothelial cells(RMECs).A:primarily-cultured RMECs at 4 d exhibited short spindle-shaped cells(×100);B:morphology of RMECs after 8 d of culture(×100);C:cells positively expressed factorⅧ related antigen(immunofluorescence staining,×400);D:morphology of rat microvascular endothelial at passage 2 in the matrigel after 12 h of culture(×100).图1 RMECs的鉴定
2 普罗布考和辛伐他汀对 AGE-BSA诱导的RMECs中ROS含量的影响
与对照组相比,AGE-BSA处理组大鼠肾脏微血管内皮细胞ROS含量明显升高,是对照组的2.3倍,50μmol/L probucol和 simvastatin均可以抑制AGE-BSA升高活性氧的作用,见图2。
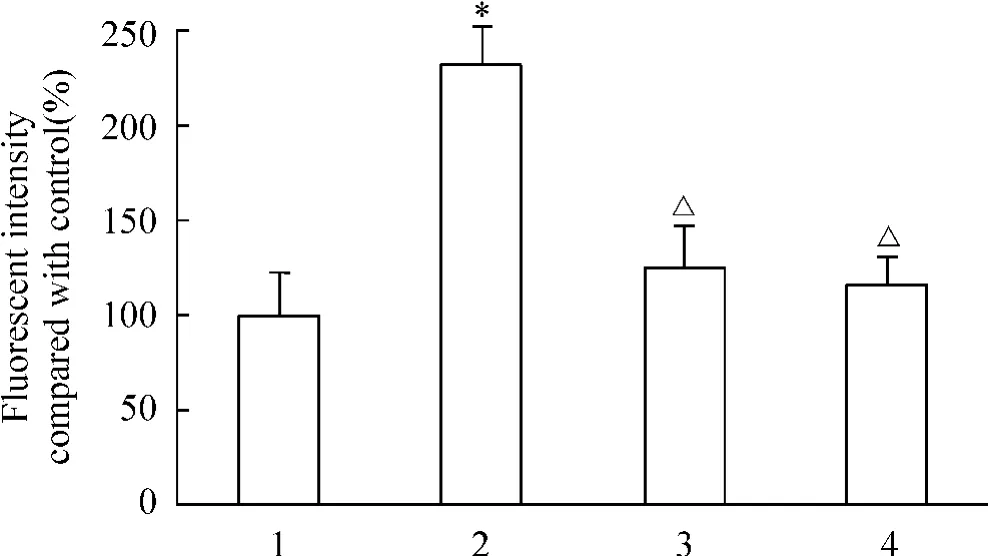
Figure 2.Effect of probucol and simvastatin on ROS production induced by AGEs in RMECs..n=8.*P<0.05 vs control;△P<0.05 vs AGE-BSA.Lane 1:control;Lane 2:treatment with AGE-BSA;Lane 3:treatment with probucol+AGE-BSA;Lane 4:treatment with simvastatin+AGE-BSA.图2 Probucol和simvastatin对AGE-BSA诱导的RMECs ROS含量的影响
3 RMECs中HO-1表达在各组间的比较
HO-1 mRNA表达在AGE-BSA损伤组(0.29±0.05)显著高于对照组 (0.15±0.04),P<0.05,probucol+AGE-BSA组(0.17±0.07)与对照组比较无显著差异(P>0.05),simvastatin+AGE-BSA组(0.24±0.06)与AGE-BSA组无显著差异(P>0.05),见图 3、表 1。
HO-1蛋白表达在AGE-BSA损伤组(0.48±0.04)显著高于对照组 (0.25±0.05),P<0.05,probucol+AGE-BSA组(0.27±0.06)与对照组比较无显著差异(P>0.05),simvastatin+AGE-BSA组(0.44±0.08)与AGE-BSA损伤组无显著差异(P >0.05),见图4、表1。
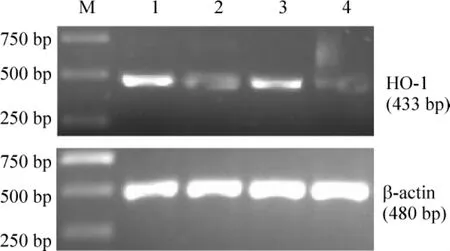
Figure 3.The electrophoregram of RT-PCR of HO -1.M:DNA marker;1:treatment with AGE-BSA;2:treatment with probucol+AGE-BSA;3:treatment with simvastatin+AGE-BSA;4:control.图3 RT-PCR扩增HO-1片段
表1 RMECs中HO-1表达在各组间的比较Table 1.The expression of HO-1 mRNA and protein in different groups(.n=8)

表1 RMECs中HO-1表达在各组间的比较Table 1.The expression of HO-1 mRNA and protein in different groups(.n=8)
*P<0.05 vs control;△P<0.05 vs AGE-BSA.
Control 0.15 ±0.04 0.25 ±0.05 AGE - BSA 0.29 ±0.05* 0.48 ±0.04*Probucol+AGE - BSA 0.17 ±0.07△ 0.27 ±0.06△Simvastatin+AGE -BSA 0.24 ±0.06 0.44 ±0.08
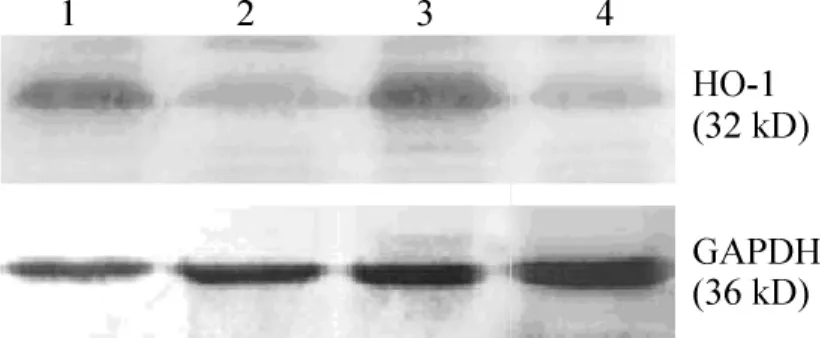
Figure 4.Western blotting of HO -1 protein.1:treatment with AGE-BSA;2:treatment with probucol+AGE-BSA;3:treatment with simvastatin+AGE - BSA;4:control.图4 HO-1蛋白质印迹
讨 论
原代培养的肾小球细胞主要是内皮细胞,此外还有上皮细胞和系膜细胞。本实验在培养液中添加了内皮细胞生长因子和肝素钠等,对选择性促进内皮细胞生长起到了重要作用。此外,根据细胞贴壁速度不同的特点进一步纯化了微血管内皮细胞。根据培养细胞呈多角形或短梭形的形态,Ⅷ因子相关抗原阳性,在matrigel胶上形成管腔样结构,鉴定其为内皮细胞来源。
研究表明,糖尿病大鼠内皮细胞中氧化应激与血浆中AGEs浓度有关,氧化应激在糖尿病微血管并发症中具有重要作用[5]。然而,目前为止,糖尿病肾病中氧化应激的存在,特别是微血管内皮细胞中氧化应激存在还缺少直接证据。本文中采用DCFHDA荧光染色,流式细胞仪测定其荧光强度的方法清楚地观察到AGEs导致肾脏微血管内皮细胞内ROS的存在。此外,实验中观察到抗氧化剂普罗布考和辛伐他汀均能显著降低细胞内ROS含量。
在多种疾病中细胞为了对抗氧化应激,多种抗氧化物酶被诱导生成。HO-1就是其中一种重要的抗氧化物酶。HO-1是血红素氧合酶的诱导型,能催化血红素分解生成一氧化氮、胆红素和铁[6]。近年研究发现,HO-1在各种氧化应激过程中均有适应性表达[7]。本实验中观察到对照组内皮细胞HO-1的表达微弱,AGEs作用下RMECs中HO-1 mRNA和蛋白水平均显著增加;普罗布考能够纠正AGEs导致的HO-1表达异常。由此,推断出抗氧化剂普罗布考可能通过降低细胞内ROS的生成来影响HO-1的表达。辛伐他汀是由土曲霉菌酵解产物合成的三羟基三甲基戊二酰辅酶A还原酶抑制剂类降脂药物,除降脂外目前已在临床上广泛用于预防和治疗冠心病,改善心肌缺血,降低冠心病死亡率。研究发现辛伐他汀还参与对细胞增殖、凋亡、细胞内信号转导等多种功能的调控,其有类似于VEGF的作用[8,9]。此外,研究还发现辛伐他汀对于保护肾功能,延缓糖尿病肾病发展具有积极地治疗作用。本实验中观察到辛伐他汀能够明显抑制AGE-BSA导致的ROS含量增加,证实了辛伐他汀保护肾脏的功能可能与其具有抗氧化作用有关。然而,辛伐他汀并没有改变AGE-BSA诱导的HO-1表达异常,说明它的抗氧化作用机制可能通过其它的细胞内信号通路。
研究表明,HO-1及其代谢产物广泛参与了抗氧化应激、抗炎症损伤、抗细胞增殖、抗凋亡、抑制血小板聚集、调节血管张力及细胞内信号转导等过程[10-12]。HO-1及其酶解产物一起组成强大的内源性保护系统,在防治多种心血管疾病中均发挥着积极的作用。然而,本实验所建立的大鼠体外模型中,普罗布考和AGE-BSA均能诱导HO-1表达增加。AGEs诱发的HO-1表达在抑制糖尿病肾病的发展中可能同样具有积极作用。有关HO-1在糖尿病肾病中的确切功能仍然需要进一步探讨。
[1]Da Ros R,Assaloni R,Ceriello A.Molecular targets of diabetic vascular complications and potential new drugs[J].Curr Drug Targets,2005,6(4):503 -509.
[2]Koya D,Hayashi K,Kitada M,et al.Effects of antioxidants in diabetes-induced oxidative stress in the glomeruli of diabetic rats[J].J Am Soc Nephrol,2003,14(8):250-253.
[3]Endo K,Miyashita Y,Sasaki H,et al.Probucol delays progression of diabetic nephropathy[J].Diabetes Res Clin Pract,2006,71(2):156 -163.
[4]Green DF,Hwang KH,Ryan US,et al.Culture of endothelial cells from baboon and human glomeruli[J].Kidney Int,1992,41(6):1506 -1516.
[5]Peyroux J,Sternberg M.Advanced glycation end products(AGEs):Pharmacological inhibition in diabetes[J].Pathol Biol(Paris),2006,54(7):405 -419.
[6]Chen YS,Zhu XX,Zhao XY,et al.Hemin,a heme oxygenase-1 inducer,improves aortic endothelial dysfunction in insulin resistant rats[J].Chin Med J(Engl),2008,121(3):241 -247.
[7]Andoh Y,Suzuki H,Araki M,et al.Low-and highlevel expressions of heme oxygenase-1 in cultured cells under uninduced conditions[J].Biochem Biophys Res Commun,2004,320(3):722 -729.
[8]Loboda A,Jazwa A,Jozkowicz A,et al.Atorvastatin prevents hypoxia-induced inhibition of endothelial nitric oxide synthase expression but does not affect heme oxygenase- 1 in human microvascular endothelial cells[J].Atherosclerosis,2006,187(1):26 -30.
[9]周 娟,朱健华,潘 闽.辛伐他汀对大鼠心肌组织中低氧诱导因子1α表达的影响[J].中国病理生理杂志,2007,23(4):813-817.
[10]Agarwal A,Nick HS.Renal response to tissue injury:Lessons from heme oxygenase-1 gene ablation and expression[J].J Am Soc Nephrol,2000,11(5):965 -973.
[11]汪红霞,黄维义,魏宗德.血红素氧合酶-1与心血管疾病研究[J].国际内科学杂志,2007,34(1):6 -7.
[12]庞东卫,韩 莉,刘 洁,等.HO通过减少ROS生或抑制AngⅡ的致血管平滑肌细胞增殖肥大[J].中国病理生理杂志,2009,25(3):476 -479.
