糖尿病大鼠肾组织Smurf 2表达及其与SnoN蛋白降解的关系*
2010-08-02刘瑞霞石明隽王圆圆桂华珍张国忠
刘瑞霞, 郭 兵, 肖 瑛, 石明隽, 王圆圆, 桂华珍, 张国忠
(贵阳医学院病理生理学教研室,贵州 贵阳 550004)
近年来,转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad信号在组织纤维化调控机制中的重要作用逐渐被认识[1]。在肿瘤研究中发现,核转录共抑制因子SnoN(Ski-related novel protein N)是该信号通路的重要负性调控因子,可严格调控TGF-β1/Smad信号的活性。我们前期的研究发现在糖尿病肾病(diabetic nephropathy,DN)发病的前8周SnoN蛋白表达减少[2],但有关SnoN蛋白和mRNA随DN病程延长的动态表达情况及SnoN蛋白表达的调控机制目前尚不清楚。Smad泛素化调节因子2(Smad ubiquitin regulatory factor 2,Smurf 2)是一种E3泛素连接酶,它通过介导Smad信号通路的负调节因子SnoN和Smad7蛋白的降解,在TGF-β1/Smad信号的调节中起着重要作用。已有研究发现,在梗阻性(unilateral ureteral obstruction,UUO)肾纤维化模型中Smurf 2的表达与SnoN蛋白降解之间存在着密切的相关性[3]。但有关DN肾纤维化发生发展中Smurf 2的表达情况及其是否参与了SnoN蛋白的泛素化降解过程,尚未见报道。因此,本研究动态观察了DN发生发展过程中Smurf 2蛋白和mRNA的表达情况,并初步探讨其与SnoN蛋白降解的关系。
材料和方法
1 材料
链脲佐菌素(streptozotocin,STZ)(Sigma);SnoN和Smurf 2兔多克隆抗体(Santa Cruz Biotechnology);磷酸化Smad2(p-Smad2)Ⅰ抗(Cell Signaling Technology);TGF-β1兔多克隆抗体和β-actin小鼠单克隆抗体,SABC-FITC试剂盒及生物素标记的鼠抗IgG、兔抗IgG(博士德公司);胰岛素兔多克隆抗体(博奥森生物技术有限公司);ECL显色剂(Pierce Biotechnology);总RNA提取试剂盒(Trizol法)、2×Taq PCR MasterMix及DNA MarkerⅠ(天根生化科技有限公司);RevertAidTMFirst Strand cDNA Synthesis Kit(MBI Fermentas);Smurf 2、SnoN及 β-actin引物(上海生工合成)。
2 方法
2.1 动物模型及分组 健康清洁级雄性Sprague-Dawley(SD)大鼠[上海西普尔-比凯实验动物有限公司提供,许可证号为 SCXY(沪)2003-0002],体重(180±20)g。按55 mg/kg STZ尾静脉注射复制DM大鼠模型,48 h后测空腹血糖,血糖值≥16.7 mmol/L且尿糖阳性者作为糖尿病(diabetes mellitus,DM)大鼠,随机分成 DM 2、4、8、12、16 和 24 周组,每一时点均设鼠龄匹配的正常对照组(n=6)。各组大鼠均予自来水、标准饲料喂养,并在每个时点处死动物。于处死前1 d称体重,代谢笼收集24 h尿液,记录尿量。股动脉取血收集血清,-20℃保存;处死大鼠,取胰腺和肾组织,称肾重,于4%多聚甲醛固定和-80℃保存。以肾重(mg)与体重(g)比值作为肾脏指数。
2.2 生化指标测定 考马斯亮蓝法测尿蛋白,氧化酶(glucose oxidase-peroxidase,GOD -PAP)法测血清葡萄糖,苦味酸法测血清肌酐,均按试剂说明书操作。
2.3 组织病理观察 将多聚甲醛固定的胰腺和肾组织制成3 μL厚石蜡切片,行HE染色和免疫荧光SABC法观察各组胰腺组织胰岛素(Ⅰ抗浓度为1∶200)的表达,光镜下观察胰腺和肾组织形态结构变化。
2.4 免疫荧光检测SnoN和Smurf 2蛋白的表达部位 石蜡切片行免疫荧光SABC法检测,SnoN和Smurf 2蛋白Ⅰ抗浓度均为1∶100,阴性对照用PBS代替Ⅰ抗。用LEICA DMLS型荧光显微镜观察并采集图像。
2.5 免疫印迹检测 SnoN、Smurf 2、TGF-β1及 p-Smad2蛋白表达量 以组织裂解液提取肾皮质总蛋白,考马斯亮蓝法测提取蛋白浓度。每泳道40 μg蛋白上样,行SDS-PAGE垂直电泳,电转移至PVDF膜。TBST冲洗,脱脂奶粉封闭。然后将膜放入稀释的Ⅰ抗(SnoN、Smurf 2、TGF -β1、p-Smad2、β -actin稀释倍数分别为 1∶400、1∶200、1∶100、1∶800、1∶400),4℃过夜。第2 d,TBST冲洗后,将膜放入相应的辣根过氧化物酶标记的Ⅱ抗(稀释倍数均为1∶9000),室温孵育2 h,TBST冲洗后 ECL显影曝光。Bio-Rad凝胶成像系统扫描,Quantity One软件分析各阳性条带的积分灰度值,设内参照β-actin,计算各目标蛋白的相对含量。
2.6 RT-PCR检测Smurf 2和SnoN mRNA的表达取约50 mg肾皮质,Trizol法提取总RNA,核酸蛋白仪测RNA浓度和纯度(260 nm/280 nm比值均在1.8-2.0之间)。引物序列如下:Smurf 2正义链5'-GGGAACGCCCAACAAGAC-3',反义链 5'-ATT-GCGGATCTCCCACCC -3',产物306 bp,相应 β -actin正义链 5'-GAAATCGTGCGTGACATTAAG-3',反义链5'-CTAGAAGCATTTGCGGTGGA -3',产物490 bp;SnoN正义链5'-GAAAACCTCCAGTCTAAGTTCTCCTTAGTT-3',反义链 5'-ATGAAGCTGGTCTGAAGTACACCTTGAACA - 3',产物 500 bp;相应β-actin正义链5'-TGGCATTGTGATGGACTC-3',反义链 5'- CCGATAGTGATGACCTGAC -3',产物306 bp。取5 μg肾组织总RNA配制逆转录反应体系,逆转录条件70℃ 5 min、37℃ 5 min,置冰上加入M -MULV 1 μL,42 ℃ 60 min,合成 cDNA,放 -20 ℃冰箱保存备用。PCR扩增条件:94℃预变性5 min,94℃变性45 s,Smurf 2和490 bp β-actin引物54.5℃退 火 45 s,SnoN 和 306 bp β -actin引 物58.3℃退火45s,72℃延伸1min,40个循环,最后72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳,Bio-Rad凝胶成像系统扫描,Quantity One软件分析各条带积分吸光度值,Smurf 2和SnoN mRNA的相对量分别用 Smurf 2/β -actin、SnoN/β -actin的积分吸光度值表示。
3 统计学处理
实验结果采用SPSS 11.5统计软件分析,数据以均数±标准差()表示。单因素方差分析对多组均数做显著性检验,组间比较用q检验。Bivariate Correlations进行相关性分析。
结 果
1 血糖、血肌酐、24 h尿蛋白和肾脏指数
DM组各时点的血糖、血肌酐(Scr)、24 h尿蛋白、肾脏指数均显著高于对照组,见表1。
表1 正常和糖尿病各组血糖、血肌酐、24 h尿蛋白量及肾脏指数的变化Table 1.Changes of blood glucose,Scr,24 h urine protein and kidney index in normal control(C)and diabetes(DM)groups(.n=6)

表1 正常和糖尿病各组血糖、血肌酐、24 h尿蛋白量及肾脏指数的变化Table 1.Changes of blood glucose,Scr,24 h urine protein and kidney index in normal control(C)and diabetes(DM)groups(.n=6)
*P <0.05,**P <0.01 vs Control group.
Group Blood glucose(mmol/L) Scr(μmol/L) 24 h urine protein(mg) Kidney index(mg/g)2 weeks C 6.72 ±2.42 58.86 ±7.40 2.01 ±1.21 7.11±0.48 DM 20.42 ±5.11** 71.37 ±7.62* 22.36 ±8.91** 11.27 ±0.58*4 weeks C 7.61 ±0.55 53.21 ±3.21 5.28 ±2.31 7.23 ±0.58 DM 24.07 ±3.52** 72.55 ±5.36* 32.30 ±8.35** 12.02 ±0.83**8 weeks C 7.89 ±1.34 54.93 ±7.59 7.73 ±1.22 5.91 ±0.41 DM 26.36 ±2.02** 99.23 ±12.11** 27.26 ±8.51** 13.21 ±1.59**12 weeks C 7.00 ±0.71 51.14 ±10.43 3.41 ±1.71 5.69 ±0.52 DM 23.43 ±2.56** 97.80 ±21.87** 22.10 ±7.31** 12.59 ±2.46**16 weeks C 8.04 ±0.32 73.46 ±12.68 6.65 ±1.24 5.64 ±0.26 DM 27.15 ±1.20** 118.07 ±11.88** 26.38 ±18.34** 10.39 ±0.79**24 weeks C 7.95 ±1.09 89.72 ±8.13 3.76 ±1.19 5.63 ±0.38 DM 23.33 ±2.63** 116.37 ±38.28** 49.35 ±31.86** 10.27 ±0.93**
2 胰腺形态学观察
HE染色显微镜下观察正常大鼠胰岛呈圆形或椭圆形的细胞团,各DM组胰岛数量明显减少,残存的胰岛成萎缩状,胰岛细胞数量减少,见图1。免疫荧光染色可见正常大鼠胰腺组织胰岛素表达较强,DM组胰岛素表达明显减弱,见图2。
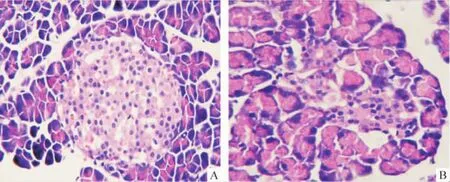
Figure 1.Histological changes of pancreas in control and diabetic rats(hematoxylin and eosin staining(×400).A:control group;B:diabetic group.图1 正常对照组和糖尿病组大鼠胰腺组织形态学
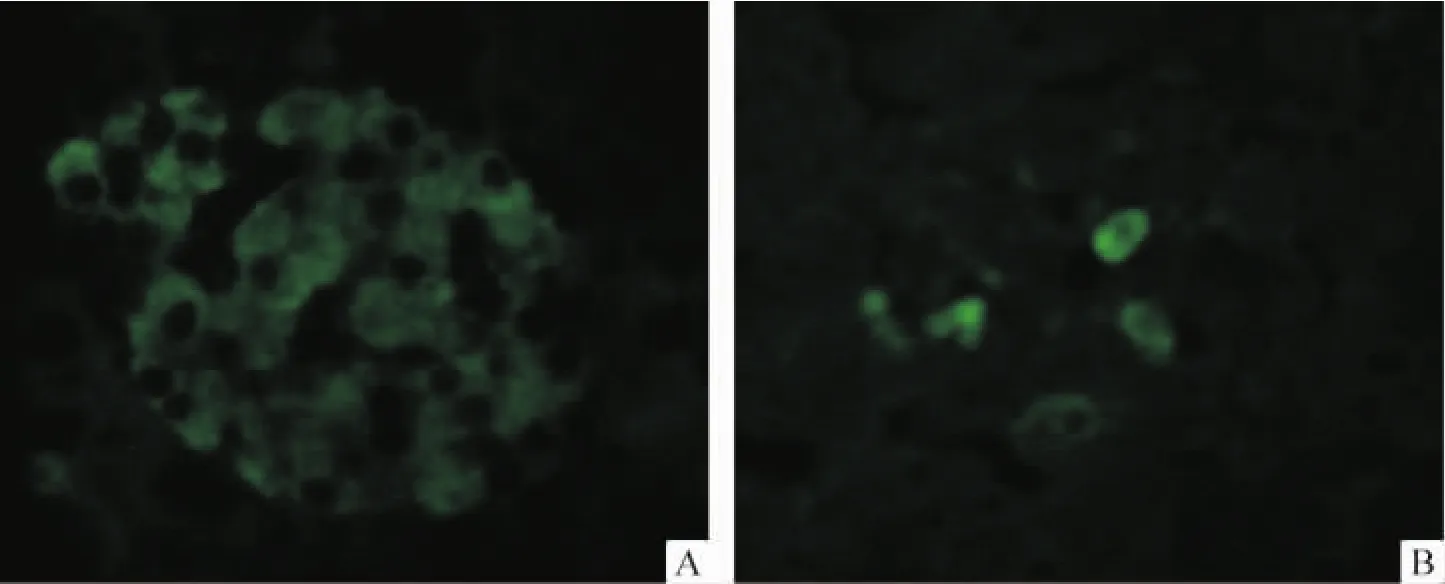
Figure 2.Expression of insulin in the pancreas in control and diabetic rats(SABC -FITC,×400).A:control group;B:diabetic group.图2 正常对照组和糖尿病组大鼠胰腺胰岛素的表达
3 肾组织病理变化
HE染色可见正常大鼠肾小管结构清晰,肾小管上皮细胞排列整齐,基底膜完整,间质中未见炎细胞浸润。DM 4周组即可见肾小管上皮细胞变性,部分肾小管管腔扩张,间质有炎细胞浸润,且随病程进展病变逐渐加重,见图3。
4 免疫荧光
图4可见,SnoN和Smurf 2蛋白在大鼠肾组织中主要表达于肾小管上皮细胞和肾间质细胞。
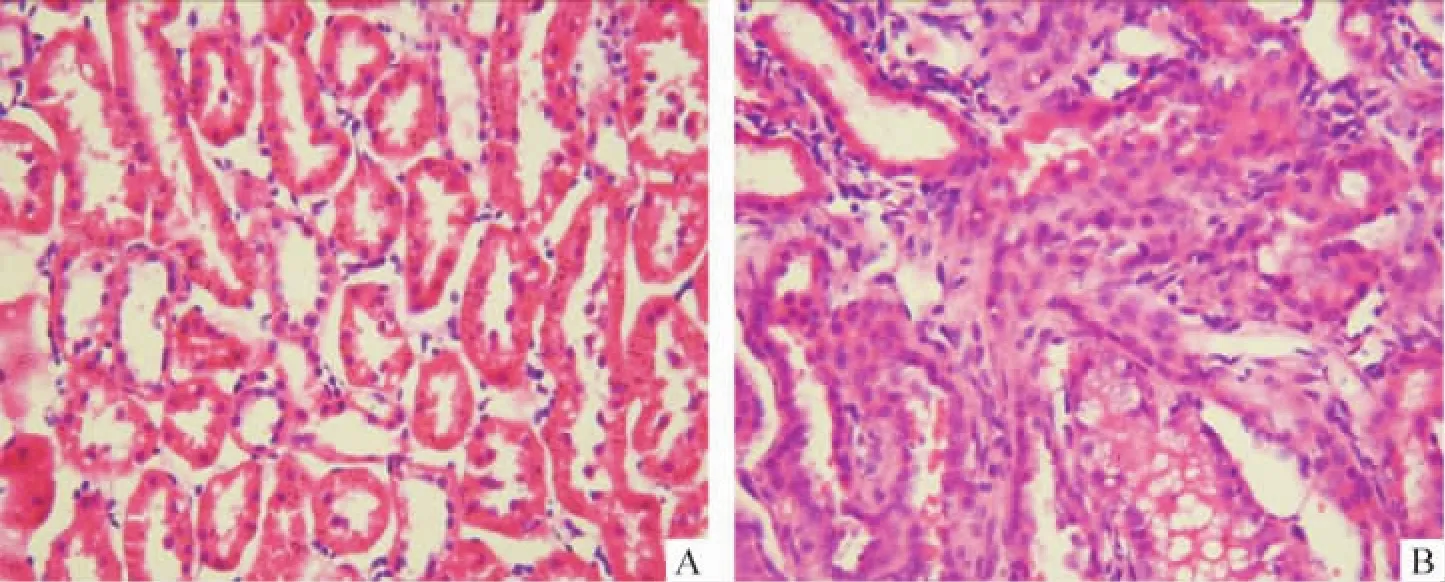
Figure 3.Histological changes of kidney in control and diabetic rats(hematoxylin and eosin staining,×400).A:control group;B:diabetic group.图3 正常对照组和糖尿病组大鼠肾组织形态学
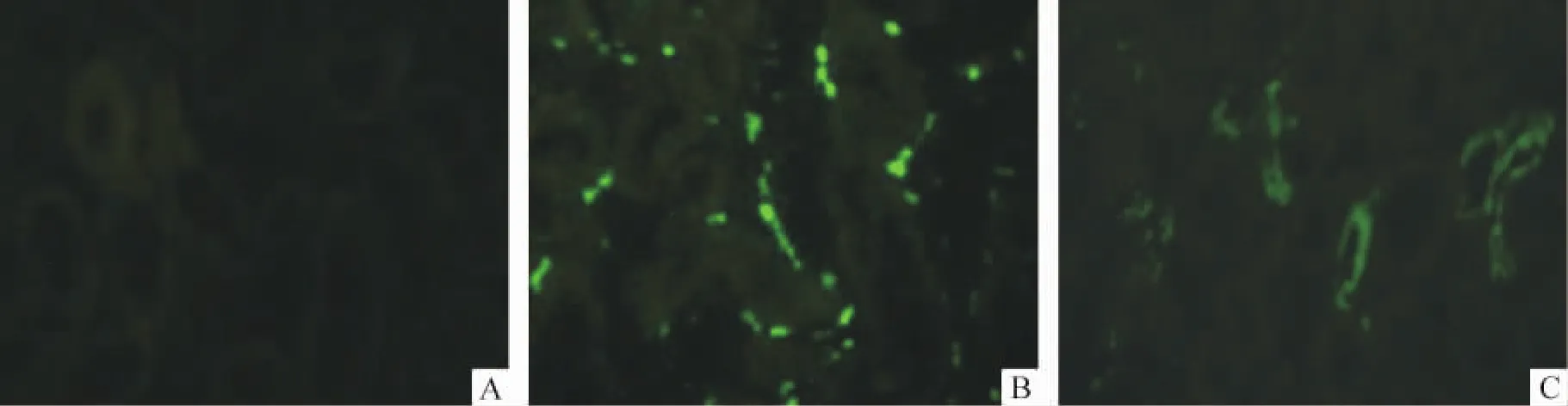
Figure 4.Expression of SnoN and Smurf 2 protein in the kidney of rats(SABC-FITC,×400).A:negative control;B:SnoN;C:Smurf 2.图4 SnoN和Smurf 2蛋白在大鼠肾组织的表达
5 免疫印迹结果
正常组及DM组每个时点各取6只大鼠的Western blotting结果进行统计学分析,以内参β-actin校正后,DM 2周SnoN蛋白的表达与正常组相比无差异,DM 4周起表达明显减少,DM 12周组表达最少,为正常组的50.70%,之后持续在较低水平,见图5。
Smurf 2和p-Smad2蛋白在正常组有少量表达,DM 2周组表达即明显增多,并随病程进展逐渐增多,DM 12周表达最多,之后持续在较高水平,见图5。
对42只大鼠肾皮质中SnoN和Smurf 2蛋白的表达量进行相关性分析,结果显示:r=-0.88,P<0.01,可见,SnoN和Smurf 2蛋白的表达量高度负相关。
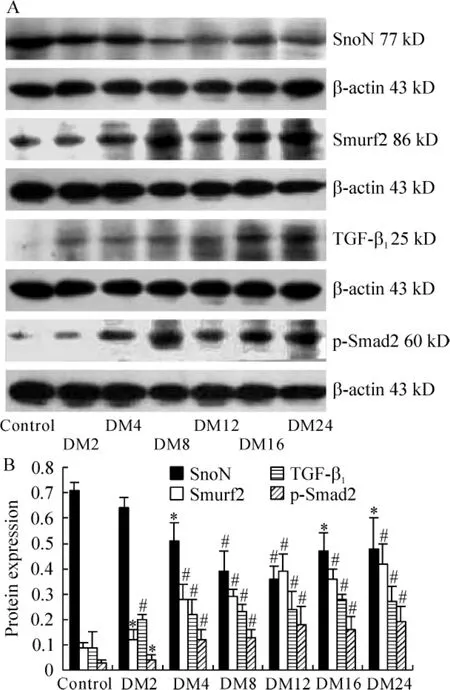
Figure 5.The levels of SnoN,Smurf 2,TGF-β1and p-Smad2 protein in kidney of control and DM rats.A:Western blotting analysis of renal SnoN,Smurf 2,TGF - β1and p-Smad2.Representative Western blotting show one animal per time point.B:graphical presentations show the relative abundance of SnoN,Smurf 2,TGF - β1and p-Smad2 at different time points after normalization with β-actin..n=6.*P<0.05,#P<0.01 vs control group.图5 蛋白印迹显示正常组及糖尿病各组SnoN、TGF-β1及Smad2/3的表达
与正常组相比,DM 2周组TGF-β1蛋白表达即明显增多,并随病程进展表达逐渐增多,见图5。
6 RT-PCR结果
图6所示,对照组大鼠肾皮质可检测到Smurf 2 mRNA表达,DM 4周组起表达较对照组显著增多(P<0.01),且随病程延长而递增。各DM组与正常对照组相比,SnoN mRNA的表达量无显著差异(P>0.05)。
讨 论
本研究用STZ成功复制了大鼠DM模型。胰岛病理观察可见DM大鼠胰岛缩小,β细胞数量减少,胰岛素分泌减少,整个实验期间大鼠血糖持续在高水平。从DM 2周起大鼠血肌酐和24 h尿蛋白增高并出现了肾脏病理改变,表明并发了DN。
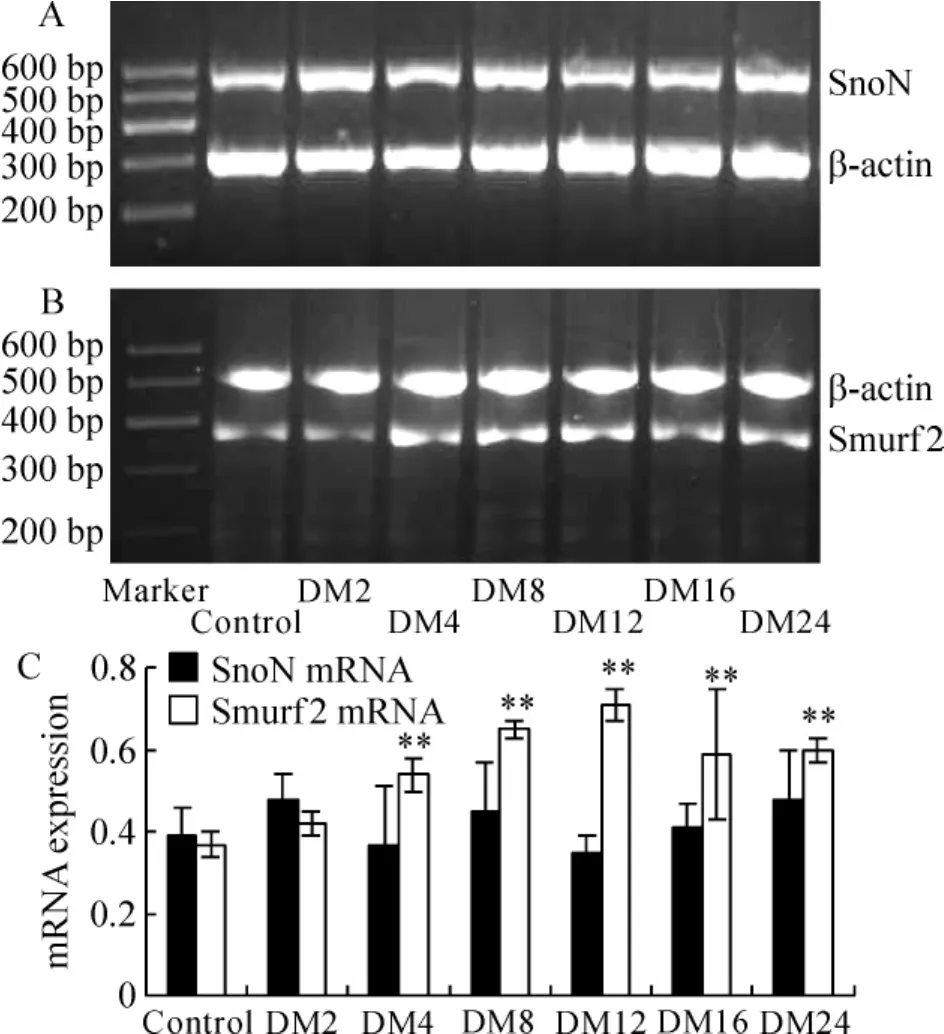
Figure 6.SnoN and Smurf 2 mRNA levels in kidney from rats in different groups.A:RT-PCR analysis displays little change in SnoN mRNA levels in the DM kidneys after streptozotocin injectin.B:RT - PCR analysis shows the induction of Smurf 2 mRNA expression in the DM kidneys after streptozotocin injectin in a time-dependent manner.Representative RT - PCR bands show one animal per time point.C:graphical presentations show the relative abundance of SnoN and Smurf 2 mRNA abundance after normalization with β - actin..n=6.*P<0.05,**P<0.01 vs control group.图6 各组大鼠肾组织中SnoN和Smurf 2 mRNA的水平
TGF-β1作为DN多种致病因素的交汇点,可通过其下游Smads信号蛋白调控肾小管-间质纤维化发病过程,在DN进行性发展中发挥重要作用。核转录共抑制因子SnoN是TGF-β1/Smad信号通路中重要的负性调节因子,在细胞核和细胞浆中它可以通过不同的机制阻断TGF-β1/Smad信号通路的信息传递[4-6]。我们之前的研究发现,DM发病的前8周,随病程进展肾组织SnoN蛋白表达减少[2]。本研究持续观察至DM 24周,发现DM 8周后,DM各组SnoN蛋白的表达仍明显少于正常对照组;而DM各组SnoN mRNA的表达量与正常对照组相比均无差异;提示SnoN蛋白的表达减少可能参与了DN的发病过程,但它的表达减少并不是由其基因转录改变引起的。近期有研究发现SnoN蛋白的表达减少在UUO所致肾纤维化的发病机制中起着重要作用,且Smurf 2介导的泛素化降解与SnoN蛋白的表达减少密切相关,提示泛素化降解SnoN增加可能是导致肾纤维化的重要原因[7]。
泛素-蛋白酶体依赖性途径介导的蛋白水解系统是由一系列高度组织的酶级联反应组成,主要包括泛素活化酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)三类酶[8,9]。其中,由于 E3 连接酶决定了降解底物蛋白的特异性和选择性,因此在泛素-蛋白酶体途径中起着决定性作用[9]。Smurf 2是一种HECT(与E6-AP羧基端同源)型E3连接酶,由1个氨基末端可与磷脂/钙结合的C2结构域、3个WW结构域和1个羧基末端的HECT连接酶结构域组成,它与 TGF-β1/Smad信号通路中的 SnoN、Smad7和Smad2等蛋白的降解均有关[10]。目前有关泛素-蛋白酶体在DM并发症发病中的研究尚少,偶有报道其与DM神经病变和视网膜病变的发病有关[11]。
本研究显示,在正常大鼠肾组织中有少量Smurf 2蛋白的表达,DM 2周时表达已明显增多,并随病程进展逐渐增加,DM 12周达最高,之后持续在较高水平。Tan等[6]研究亦发现,在糖尿病伴局灶节段性肾小球硬化病人肾组织中Smurf 2蛋白表达增加,但其作用及原因未明,提示Smurf 2蛋白的表达变化可能参与了DN的发病过程。研究发现,磷酸化的Smad2通过其氨基端和连接区的PPXY结构与Smurf 2的WW结构域相互作用,可介导SnoN蛋白的泛素化降解[12]。本研究还观察到,DN发病过程中TGF-β1表达增多,被它磷酸化的Smad2也相应增加,且磷酸化Smad2和Smurf 2蛋白的增多均早于SnoN蛋白的减少,并且Smurf 2和SnoN蛋白的表达量呈高度负相关,且二者表达部位一致,主要表达于肾小管上皮及肾小管间质细胞。以上结果提示,在DN发病过程中SnoN蛋白表达减少可能与Smurf 2介导其泛素化降解有关,表达增多的Smurf 2可能通过降解TGF-β1/Smad信号通路的重要负调控因子SnoN,在DN肾纤维化的发生和发展中起着重要的作用。
虽然泛素-蛋白酶体依赖型降解途径在许多生理学功能中均发挥作用,E3连接酶Smurf 2的生物学功能除了可降解TGF-β1/Smad信号通路中的SnoN蛋白,还与Smad 7、Smad 2和β-catenin等蛋白的降解有关。但近期的研究表明,在UUO所致肾纤维化疾病的发生发展中,Smurf 2的最终作用是增强TGF-β1/Smad信号通路的活性,且TGF-β1可通过PI3K/AKT信号通路刺激 Smurf 2的表达[13]。我们的研究发现,随着DN病程进展Smurf 2 mRNA表达增多,这是否与PI3K/AKT通路激活有关,有待进一步研究。
[1]戴 晴,李 欣,郑 磊,等.丹参素对肝星状细胞TGF-β信号转导的影响[J].中国病理生理杂志,2009,25(10):1988-1994.
[2]刘瑞霞,郭 兵,崔 龙,等.SnoN蛋白在糖尿病大鼠肾组织中的表达及其意义[J].中国病理生理杂志,2008,24(6):1188-1192.
[3]Tan RL,Zhang JL,Tan XY,et al.Downregulation of SnoN expression in obstructive nephropathy is mediated by an enhanced ubiquitin - dependent degradation[J].Am Soc Nephrol,2006,17(10):2781 -2791.
[4]Liu X,Sun Y,Weinberg RA,et al.Ski/Sno and TGF -beta signaling[J].Cytokine Growth Factor Rev,2001,12(1):1-8.
[5]Reed JA,Lin Q,Chen D,et al.SKI pathways inducing progression of human melanoma[J].Cancer Metastasis Rev,2005,24(2):265-272.
[6]Tan RY,He WC,Lin X,et al.Smad ubiquitination regulatory factor-2 in the fibrotic kidney:regulation,target specificity,and functional implication[J].Am J Physiol Renal Physiol,2008,294(5):F1076 - F1083.
[7]Debigaré R,Price SR.Proteolysis,the ubiquitin-proteasome system,and renal diseases[J].Am J Physiol Renal Physiol,2003,285(1):F1 - F8.
[8]Mani A,Gelmann EP.The ubiquitin-proteasome pathway and its role in cancer[J].J Clin Oncol,2005,23(21):4776-4789.
[9]Inoue Y,Imamura T.Regulation of TGF-beta family signaling by E3 ubiquitin ligases[J].Cancer Sci,2008,99(11):2107-2112.
[10]Akarsu E,Pifim I,Capogh I,et a1.Relationship between electroneurographic changes and serum ubiquitin levels in patients with type 2 diabetes[J].Diabetes Care,2001,24(1):1-3.
[11]Adachi-Uehara N,Kato M,Nimura Y,et a1.Up-regulation of genes for oxidative phosphorylation and protein turnover in diabetic mouse retina[J].Exp Eye Res,2006,83(4):849-857.
[12]Bonni S,Wang HR,Causing CG,et al.TGF-beta induces assembly of a Smad2-Smurf 2 ubiquitin ligase complex that targets SnoN for degradation[J].Nat Cell Biol,2001,3(6):587-595.
[13]Ohashi N,Yamamoto T,Uchida C,et al.Transcriptional induction of Smurf 2 ubiquitin ligase by TGF - beta[J].FEBS Lett,2005,579(12):2557 -2563.
