CD4+T淋巴细胞Kv1.3通道在大鼠动脉粥样硬化中的作用*
2010-08-02李枚娟肖国胜李桂阳王焱
李枚娟, 巩 燕, 肖国胜, 李桂阳, 王焱△
(1厦门大学医学院,2厦门大学附属中山医院心脏中心,福建 厦门 361000;3福建医科大学,福建 福州 350108)
众多的临床和实验研究表明,T细胞介导的自身免疫性疾病中动脉粥样硬化(atherosclerosis,AS)相关的心血管并发症和死亡率明显增加,支持T细胞介导的免疫调节显著促进了此类疾病AS的发生和进展[1,2]。电压依赖性钾通道(votage dependent K+channel,Kv)在维持T细胞膜静息电位和细胞状态方面有重要作用[3,4],其中Kvl.3通道在调节 T细胞活化的过程中起重要作用[5,6],针对特定的T淋巴细胞及其表面分子Kvl.3的功能调节可能成为AS发病机制和免疫治疗的新靶点。因此,我们应用大鼠的AS模型,研究脾组织CD4+T淋巴细胞膜Kv1.3通道表达、胞内钙离子浓度、细胞因子分泌变化三者之间的关系及Kv1.3通道在AS中的作用。
材料和方法
1 材料
1.1 动物 采用4-8周健康雄性Wistar大鼠40只,体重(200±12)g,购自中科院上海斯莱克实验动物有限公司。随机分为2组,对照组(10只)采用普通饮食+生理盐水,动脉粥样硬化组(30只)采用高脂饮食配方(3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油、81.3%基础饲料、蛋黄、牛奶)+维生素D3负荷(喂食开始时一次性腹腔注射维生素D36×105U/kg),饲养16周,建立AS大鼠模型。
1.2 主要试剂 总胆固醇试剂盒、甘油三酯试剂盒、低密度脂蛋白胆固醇试剂盒、高密度脂蛋白胆固醇试剂盒(北化康泰公司,北京),淋巴细胞分离液(EZ-SepTMmouse 1×Dakewe公司,深圳),anti-CD3单克隆抗体及mouse IgG3同型对照抗体(eBioscience),anti-CD4及 mouse IgG1同型对照抗体、anti-CD8单克隆抗体及mouse IgG1同型对照抗体(Invitrogen),CD4+T淋巴细胞分选试剂盒MagCellect Rat CD4+T-cell isolation kit(R&D),染料 fluo-3,AM(分子探针)、逆转录试剂盒RevertAidTMfirst strand cDNA synthesis kit(Fermentas)。
2 方法
2.1 AS模型鉴定 大鼠处死后心脏采血,进行血脂测定。并取主动脉弓至髂总动脉全长血管,分别取主动脉起始部、胸主动脉、腹主动脉,用10%甲醛溶液固定,做石蜡切片(5 μm)后进行HE染色,光镜下观察组织改变。
2.2 流式细胞仪测定淋巴细胞比例 大鼠处死后取脾脏,进行淋巴细胞分离:采用EZ-SepTMmouse 1×淋巴细胞分离液,运用密度梯度离心法获得脾淋巴细胞,并进行流式抗体双标记,按1×109cells/L细胞计算所需抗体加入量:anti-CD42.5 μL(100 mg/L),anti- CD810 μL(100 mg/L),anti- CD31.25 μL(200 mg/L),mouse IgG310 μL(10 μL/test),mouse IgG110 μL(10 μL/test),通过流式细胞术测定不同淋巴细胞群的数量及比例。
2.3 CD4+T淋巴细胞磁珠分选(magcellect rat CD4+T-cell isolation kit,MACS)及纯度检测 采用Mag-Cellect rat CD4+T-cell isolation kit,分选出CD4+T淋巴细胞,并取出1×109cells/L再次进行anti-CD4、anti-CD8、anti- CD3,及其同型抗体 mouse IgG3、mouse IgG1标记,检测CD4+T淋巴细胞纯度。
2.4 脾CD4+T淋巴细胞增殖程度检测 分别取正常对照组和AS组经磁珠分选出的CD4+T淋巴细胞,加入10%进口胎牛RPMI-1640培养基,用96孔板进行细胞培养,分为不加非特异性刺激剂刀豆蛋白A组[concanavalinA,ConA(-)组],及加入 ConA组[ConA(+)组](终浓度为 5 g/L),于 37℃、5%CO2培养箱中培养48h后,加入MTT(终浓度5 g/L)进行显色反应,4 h后经DMSO终止反应,对其增殖程度进行测定。
2.5 激光共聚焦(confocal)检测脾CD4+T淋巴细胞胞内钙离子(Ca2+)浓度 分别取对照组和实验组经磁珠分选出的CD4+T淋巴细胞1×109cells/L,用Flou-3/AM(5 μmol/L)进行细胞内钙离子染色,避光孵育30 min,经共聚焦显微镜分别检测2组脾CD4+T淋巴细胞胞内钙离子浓度,同时取等量的细胞加入10%进口胎牛RPMI-1640培养基,并加入ConA(终浓度为5 mg/L)及 CaCl2(2.0 mmol/L),于37℃、5%CO2培养箱中进行培养,48 h后分别将对照组和实验组经ConA和CaCl2共培养的细胞1×106采用同样的方法检测细胞内钙离子浓度,并进行刺激前后胞内钙离子浓度的比较。
2.6 实时定量RT-PCR检测正常对照组和AS组脾CD4+T淋巴细胞Kv1.3 mRNA的表达量变化分别提取2组大鼠的脾CD4+T淋巴细胞总RNA,采用逆转录试剂盒RevertAidTMfirst strand cDNA synthesis kit,合成cDNA模板。采用ABI7500进行实时定量RT-PCR(qRT-PCR)检测,引物序列如下,Kv 1.3引物:5’-TCGTGTCAGTGCTGGTCATTCTC,3’-TTGGCAGCCTCAAACACGTC;GAPDH 引物:5’-GGCACAGTCAAGGCTGAGAATG,3’- ATGGTGGTGAAGACGCCAGTA。分别检测2组大鼠脾CD4+T淋巴细胞Kv1.3 mRNA的表达量并对其CT值及溶解曲线进行分析比较。
3 统计学处理
结 果
1 正常组和AS组大鼠的主动脉血管病理改变
HE染色可见,对照组内皮细胞连续完整而光滑,中膜平滑肌走行清晰,中膜血管平滑肌细胞(vascular smooth muscle cells,VSMCs)排列整齐无增生,弹力纤维未见异常;AS组部分内皮细胞脱落,中层明显增厚,弹力纤维走形异常,VSMCs细胞核排列紊乱。主动脉血管内超声检测,可见内膜下脂质沉积,动脉管壁钙化,符合AS病变特点,见图1。

Figure 1.Pathologic change in rat aorta after being feeding with fat diet(HE staining,×100).A:rat aorta in control group;B:rat aorta in AS group.图1 对照组与实验组大鼠主动脉血管病理变化
2 正常组和AS组大鼠的总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low - density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)水平比较
AS组大鼠TC和LDL水平显著高于对照组,差异显著(P<0.05)。AS组TG、HDL水平与对照组比,差异无显著,见图2。
3 正常对照组和AS组大鼠脾组织CD4+T淋巴细胞比例比较
AS组脾组织CD4+T淋巴细胞比例较对照组升高,见图3。正常对照组和AS组大鼠脾组织T淋巴细胞经磁珠分选后CD4+T淋巴细胞比例均可达到85%以上,见图4。
4 ConA刺激对照组和AS组大鼠脾CD4+T淋巴细胞48 h后淋巴细胞增殖情况比较
对照组和AS组大鼠脾CD4+T淋巴细胞在未加ConA的情况下,即存在基础增殖程度的差异,AS组细胞增殖程度较对照组升高,差异显著(P<0.05)。在加入ConA刺激48 h后2组细胞均有明显增殖,但AS组的升高更显著,差异显著(P<0.05),见表1。
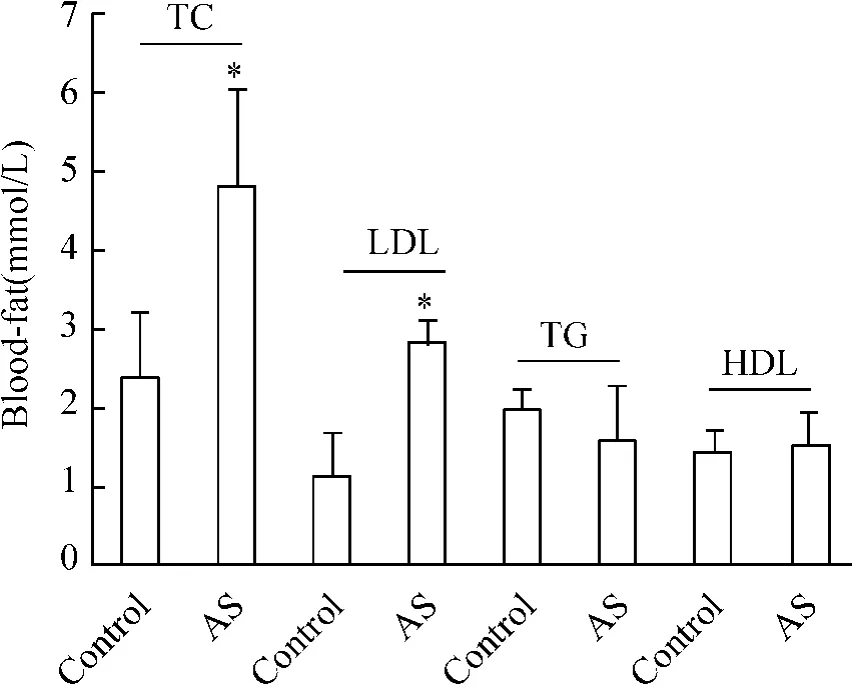
Figure 2.Comparison of serum TC and LDL(total cholesterol and low-density lipoprotein)between AS and control group..n=30.*P<0.05 vs control group.图2 正常组和AS组大鼠血清中血脂水平比较
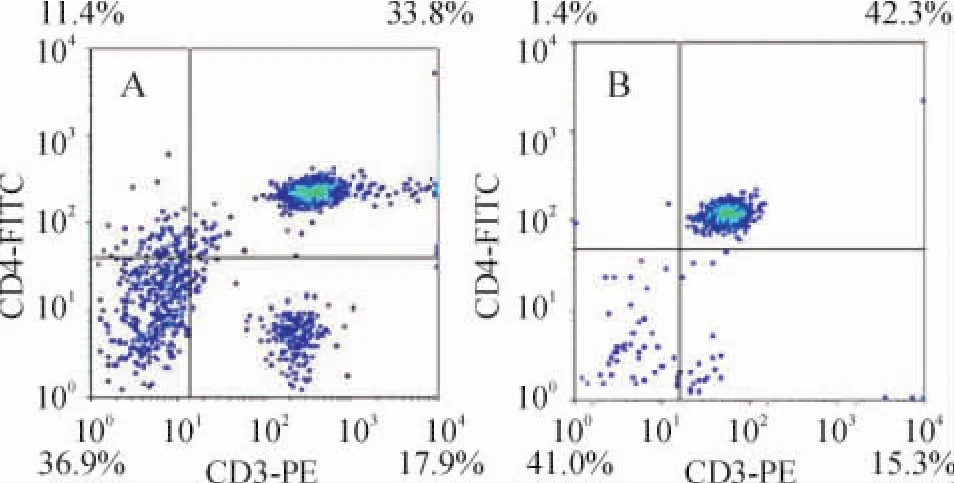
Figure 3.Comparison of CD4+T lymphocyte proportion in rat spleen between AS and control group.A:proportion of CD4+T cell in control rat spleen;B:proportion of AS- CD4+T cell in AS rat spleen.Proportion of CD4+T lymphocyte in AS group was significantly higher than that in control group.图3 对照组与实验组大鼠脾CD4+T淋巴细胞比例比较
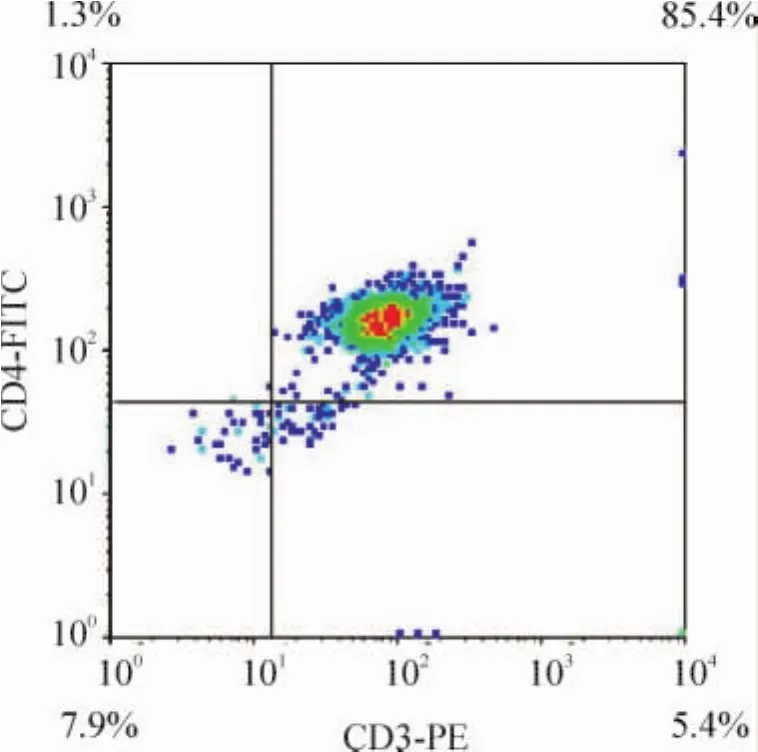
Figure 4.Proportion of CD4+T lymphocyte in AS rat spleen after being separated by immunomagnetic bead.图4 磁珠分选后脾CD4+T淋巴细胞比例
表1 正常组和AS组大鼠脾CD4+T淋巴细胞增殖程度比较Table 1.After being stimulated by concanavalin A(ConA),the proliferation of CD4+T lymphocyte in AS group and control group(A.)

表1 正常组和AS组大鼠脾CD4+T淋巴细胞增殖程度比较Table 1.After being stimulated by concanavalin A(ConA),the proliferation of CD4+T lymphocyte in AS group and control group(A.)
*P <0.05 vs control.
Group ConA(-) ConA(+)Control(n=6)0.2013 ±0.0164 0.7971 ±0.0955 AS(n=9) 0.2965 ±0.0233* 1.1321 ±0.1750*
5 ConA刺激对照组和AS组大鼠CD4+T淋巴细胞后淋巴细胞内钙离子浓度比较
未加入ConA刺激前AS组CD4+T淋巴细胞就存在细胞内钙离子浓度高于正常对照组,两者比较存在显著差异(H=61.5,P<0.05),经ConA刺激后两者CD4+T淋巴细胞胞内钙离子浓度均有增加,实验组增加更明显,两者相比差异显著(H=82,P<0.05),见图 5。

Figure 5.Comparison of intracellular calcium concentration between AS and control group.After being stimulated by ConA,the intracellular calcium concentration in AS group was significantly higher than that in the control group.图5 正常对照组和AS组大鼠CD4+T淋巴细胞胞内钙离子浓度比较
6 ConA刺激大鼠CD4+T淋巴细胞不同时间细胞因子的分泌比较
ConA刺激分选出的CD4+T淋巴细胞,0 h时细胞因子分泌量低,作为空白对照,在刺激24 h及48 h后,IL-10的分泌水平未见明显变化,而IL-2及TNF-α的分泌随时间延长分泌增多,ConA刺激48 h后其分泌水平较24 h增多,差异显著(P<0.05),见图6。

Figure 6.Cytokine secretion in supernatant of CD4+T lymphocyte in different time after being stimulated by ConA..n=18.*P<0.05 vs 24 h group.图6 ConA刺激AS大鼠不同时间的细胞因子的分泌
7 对照组与AS组Kv1.3的qPCR结果比较
AS组脾CD4+T淋巴细胞Kv1.3 mRNA的表达高于正常对照组,差异显著(P<0.05),见表2。
表2 对照组与AS组Kv1.3 mRNA表达量比较Table 2.Comparison of Kv1.3 mRNA expression in CD4+T lymphocytesof rat spleen between AS and control group()
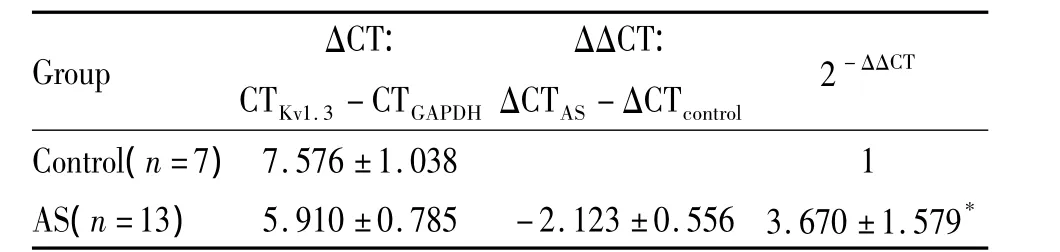
表2 对照组与AS组Kv1.3 mRNA表达量比较Table 2.Comparison of Kv1.3 mRNA expression in CD4+T lymphocytesof rat spleen between AS and control group()
*P <0.05 vs control.
Group ΔCT:CTKv1.3 - CTGAPDH ΔΔCT:ΔCTAS-ΔCTcontrol 2 - ΔΔCT Control(n=7)7.576 ±1.038 1 AS(n=13) 5.910 ±0.785 -2.123 ±0.556 3.670 ±1.579*
讨 论
AS是一种自身免疫性疾病,目前报道与AS关系密切的抗原有氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)、热休克蛋白 60、β2糖蛋白 I、脂蛋白a、肺炎衣原体、幽门螺杆菌、病毒等[7],其中ox-LDL发挥主要作用。研究表明在ox-LDL刺激下可出现AS疾病的自身免疫应答,使局部斑块及脾脏中TGF-β1(+)CD4(+)Th3 表达增多[8]。我们通过高脂饮食建立动脉粥样硬化大鼠模型,测定血脂提示存在高低密度脂蛋白血症。且在未加ConA的情况下,AS组CD4+T淋巴细胞增殖程度较正常对照组升高,说明AS组在长期的高脂血症的刺激下存在免疫机制,使CD4+T淋巴细胞处于增殖活化状态。因此,我们的结果与上述报道是一致的。
T淋巴细胞功能活化有赖于其细胞膜表面的离子通道。研究表明,T淋巴细胞膜上主要存在3种离子通道蛋白:电压门控钾通道Kv1.3、钙离子激活的钾通道和钙释放激活的钙通道。其中,Kv1.3通道是效应性T淋巴细胞持续活化的关键[9,10]。Kv1.3通道的表达和功能改变主要影响膜电位水平和胞内钙信号,并调节 IL-2、IL-10、TNF-α、TFG -β1等细胞因子的表达和细胞增殖[9,11,12]。
我们的研究表明,活化状态的CD4+T淋巴细胞胞内钙离子浓度升高,致AS的细胞因子(IL-2,TNF-α)增多,并随时间延长而增多,而减少局部炎症反应的细胞因子(IL-10)分泌水平较低。说明在持续的抗原刺激下,随着AS疾病的进展,致AS的细胞因子(IL-2,TNF-α)分泌增加,加速疾病的进展;而IL-10作为抗炎因子,可抑制致炎因子的释放,减少黏附分子的表达,减少单核细胞向内皮细胞黏附,起到保护作用,有临床研究证实,IL-10在AS斑块进展、破裂、血栓方面有重要作用[13],我们的AS组中IL-10水平在48 h内未见变化趋势,考虑与疾病发展时期及严重程度有一定关系,有待进一步研究。
已有的基础及临床研究均有力证实了Kv1.3通道在效应性T细胞活化中的决定性作用,以及高表达Kv1.3通道的T淋巴细胞亚群在T细胞介导的自身免疫性疾病中的关键性致病作用[10,14]。最近研究报道:急性冠脉综合征患者外周血T淋巴细胞Kv1.3通道电流幅度及Kv1.3蛋白的表达明显高于正常人,该研究首次提出了 AS与 Kv1.3之间的相关性[15]。新近也直接在冠心病患者AS斑块病变组织中发现了克隆性的T淋巴细胞增殖[16],这些均提示Kv1.3在AS中存在一定作用。我们的研究也证明了在AS中,CD4+T淋巴细胞亚群增多,AS组CD4+T淋巴细胞表面Kv1.3离子通道在mRNA水平的表达增多,并且伴随着CD4+T淋巴细胞胞内钙离子增多,炎症细胞因子(IL-2,TNF-α)分泌增加,提示CD4+T淋巴细胞表面Kv1.3表达与胞内钙离子浓度、细胞因子分泌三者之间存在一定的相关性,Kv1.3离子通道在AS的疾病过程中发挥一定的作用。
[1]Sherer Y,Shoenfeld Y.Mechanisms of disease:atherosclerosis in autoimmune disease[J].Nat Clin Pract Rheumatol,2006,2(2):99 -106.
[2]Roman MJ,Salmon JE.Cardiovascular manifestations of rheumatologic diseases[J].Circulation,2007,116(20):2346-2355.
[3]Ko EA,Han J,Jung ID,et al,Physiological roles of K+channels in vascular smooth muscle cells[J].Smooth Muscle Res,2008,44(2):65 -81.
[4]周 萍,富 路,潘振伟,等.长期睾铜缺失对雄性大鼠胸主动脉平滑肌细胞电压依从性钾通道的影响[J].中国病理生理杂志,2009,25(3):467-471.
[5]Beeton C,Wulff H,Singh S,et al.A novel fluoreseent toxin to detect and investigate Kvl.3 channel up - regulation in chronieally activated T lymphocytes[J].J Biol Chem,2003,278(11):9928-9937.
[6]Jackson WF.Potassium channels in the peripheral microcirculation[J].Microcirculation,2005,12(1):113 -127.
[7]Milioti N,Bermudez-Fajardo A,Penichet ML,et al.Antigen-induced immunomodulation in the pathogenesis of atherosclerosis[J].Clin Dev Immunol,2008,2008:723539.
[8]Zhou XH,Johnston TP,Johansson D,et al.Hypercholesterolemia leads to elevated TGF-beta 1 activity and T helper 3-dependent autoimmune responses in atherosclerotic mice[J].Atherosclerosis,2009,204(2):381 -387.
[9]Panyi G,Varga Z,Gaspar R.Ion channels and lymphocyte activation[J].Immunol Lett,2004,92(1 - 2):55-56.
[10]Wulff H,Calabresi PA,Allie R,et al.The voltage-gated Kv1.3 K(+)channel in effector memory T cells as new target for MS[J].J Clin Invest,2003,111(11):1703-1713.
[11]Krasznai Z.Ion channels in T cells:from molecular pharmacology to therapy[J]. Arch Immunol Ther Exp(Warsz),2005,53(2):127-135.
[12]Panyi G,Vamosi G,Bodnar A,et al.Looking through ion channels:recharged concepts in T-cell signaling[J].Trends Immunol,2004,25(11):565 -569.
[13]Fernandez RP,Kaski JC.Interleukin-10 and coronary disease[J].Rev Esp Cardiol,2002,55(7):738 -750.
[14]Beeton C,Wulff H,Standifer NE,et al.Kv1.3 channels are a therapeutic target for T cell-mediated autoimmune diseases[J].Proc Natl Acad Sci USA,2006,103(46):17414-17419.
[15]Guo LF,Zhang CT,Wu J,et al.T-lymphocyte voltage depedent K(+)channel is upregulated in patients with acute coronary syndrome[J].Zhonghua Xin Xue Guan Bing Za Zhi,2007,35(9):821.
[16]De Palma R,Del Galdo F,Abbate G,et al.Patients with acute coronary syndrome show oligoclonal T-cell recruitment within unstable plaque:evidence for a local,intracoronary immunologic mechanism[J].Circulation,2006,113(5):640-646.
