烟草PVY Real-Time PCR定量检测体系的建立及应用
2010-07-31刘晓霞杨金广王凤龙钱玉梅申莉莉王长栓
刘晓霞,杨金广,王凤龙*,钱玉梅,申莉莉,张 帅,王长栓,黄 瑾
(1.国家烟草专卖局烟草病虫害监测与综合治理重点开放实验室,中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京100081;3.广西壮族自治区烟草公司百色市分公司,广西 百色 533000)
马铃薯Y病毒(PVY)是近年严重危害烟草生产的病毒之一,影响烟叶的产量和品质[1]。当前,检测 PVY的方法主要集中于生物学鉴定、光镜和电镜观察、免疫学方法、RT-PCR检测技术、核酸杂交检测技术等[2-3],应用Real-time PCR技术对烟草PVY进行定量检测报道较少。笔者应用 SYBR Green Real-time PCR技术,以烟草肌动蛋白基因为内参,建立了烟草中 PVY的定量检测方法,旨在为快速、灵敏、高效检测 PVY含量提供有力的技术支持,同时也为烟草中其它病毒检测技术的改进提供借鉴。
1 材料与方法
1.1 材料与试剂
PVY毒源:纯化的 PVY用接种缓冲液(0.01 mol/L PBS,PH7.0)研磨后,摩擦接种于枯斑三生烟(Nicotiana tabacumvar.samsun NN),在防虫温室中培养,每月扩繁1次,以保持病毒侵染活性。
SYBR Premix Ex TaqTMⅡ(Perfect Real Time)、RNAiso Plus 、Reverse Transcriptase M-ML(RNase H-)、Ribonuclease Inhibitor、dNTP Mixture、DL500 DNA Marker均购自宝生物工程(大连)有限公司(TaKaRa)。PVY DAS-ELISA检测试剂盒购自ADGEN公司。其它试剂均为国产分析纯。
1.2 引物设计
根据PVY strain NTN isolate HR1全基因组序列(FJ204166)和actin基因(U60495),按照标准荧光定量PCR引物设计原则,用Primer 5.0进行设计,然后通过Oligo 6.0软件对所设计的引物进行评价,并通过在线BLSAT程序( http://www.ncbi.nlm.nih.gov/blast/)进行验证,以避免引物序列与烟草基因组任何序列同源。引物由宝生物工程(大连)有限公司(TaKaRa)合成。PVY 基因的上游引物为5’-TTCATCTCCATCCATCATAACC-3’,下游引物为5’-TACAACTTGCATACGACATAGG-3’,产物长度为 127 bp。Actin基因上游引物为5’-AAGGGATGCGAGGATGGA-3’,下游引物为5’-CAAGGAAATCACCGCTTTGG-3’,产物长度为105 bp。
1.3 方法
1.3.1 烟草总RNA的提取 利用RNAiso Plus进行烟草总RNA的提取,详细方法参照试剂盒说明书。
1.3.2 反转录体系及条件 反转录体系和条件参照Reverse Transcriptase M-ML(RNase H-)的说明书,反应在东胜基因扩增仪上进行。
1.3.3 Real-time PCR反应体系及条件 参照SYBR Premix Ex TaqTMⅡ(Perfect Real Time)的说明书,反应体系为25 µL:SYBR Premix Ex TaqTMⅡ(2×) 12.5 µL,上下游引物(10 µM)各 0.5 µL ,cDNA 1 µL ,ROX Reference DyeⅡ(50×) 0.5 µL,ddH2O 10 µL。
反应采用两步法PCR反应的标准程序,并且制作融解曲线。反应程序设置为3个阶段。预变性阶段:95℃ 10 s;PCR 反应阶段:95 ℃ 6 s,62 ℃ 35 s 重复35个循环;融解阶段:95 ℃ 15 s,62 ℃ 60 s,95 ℃ 15 s,62 ℃ 15 s。在 PCR 反应阶段每个循环的延伸结束时收集荧光信号。
1.3.4 Real-time PCR标准曲线的制定和结果计算将PVY基因和actin基因的cDNA,采用5倍稀释法稀释成6个梯度,每个梯度设计3个重复,分别进行Real-time PCR反应,同时设立空白对照。利用 AB7500 Real-Time PCR system 自带的SDS 软件对数据进行分析,生成标准曲线。根据标准曲线得到的线性公式,将样品的 Ct值代入计算,经过归一化处理后得到PVY基因和actin基因的起始模板量,二者比值即为烟草中PVY基因的相对含量。
1.3.5 PVY Real-Time PCR定量检测体系的应用2008年和2009年采自广西百色呈典型烟草病毒病的样品30个,分别用PVY DAS-ELISA检测试剂盒(按照试剂盒操作说明进行,Thermo Multiskan spectrum测定)和Real-time PCR定量检测体系检测PVY,比较二者检测结果。
取PVY病样0.1 g,液氮研磨后平均分为两份,用提取缓冲液(DAS-ELASA试剂盒中提供)和RNAiso Plus 以10倍稀释法各稀释成10个梯度,分别进行DAS-ELISA检测和Real-time PCR检测,比较二者的检测稀释极限。
2 结 果
2.1 PVY基因和actin基因的标准曲线
经稀释的系列 cDNA起始模板量和循环阈值Ct的线性关系曲线见图1。PVY基因的标准曲线斜率和线性相关系数分别为-2.4447和 0.9960,actin基因的标准曲线斜率和线性相关系数分别为-2.4106和 0.9961,两者的线性相关系数均大于0.99,说明扩增效率高,可用于准确定量。
2.2 Real-time PCR定量检测的准确性分析
PVY基因和actin基因在 AB7500 Real-Time PCR system进行扩增,分析后得到的扩增曲线和熔解曲线如图2和图3所示,两个基因的扩增曲线均呈典型的S型,基线平整,指数区斜率较大且比较平滑,空白对照一直保持水平,扩增曲线比较理想;熔解曲线只有单一峰,说明没有引物二聚体和非特异性扩增的产生。
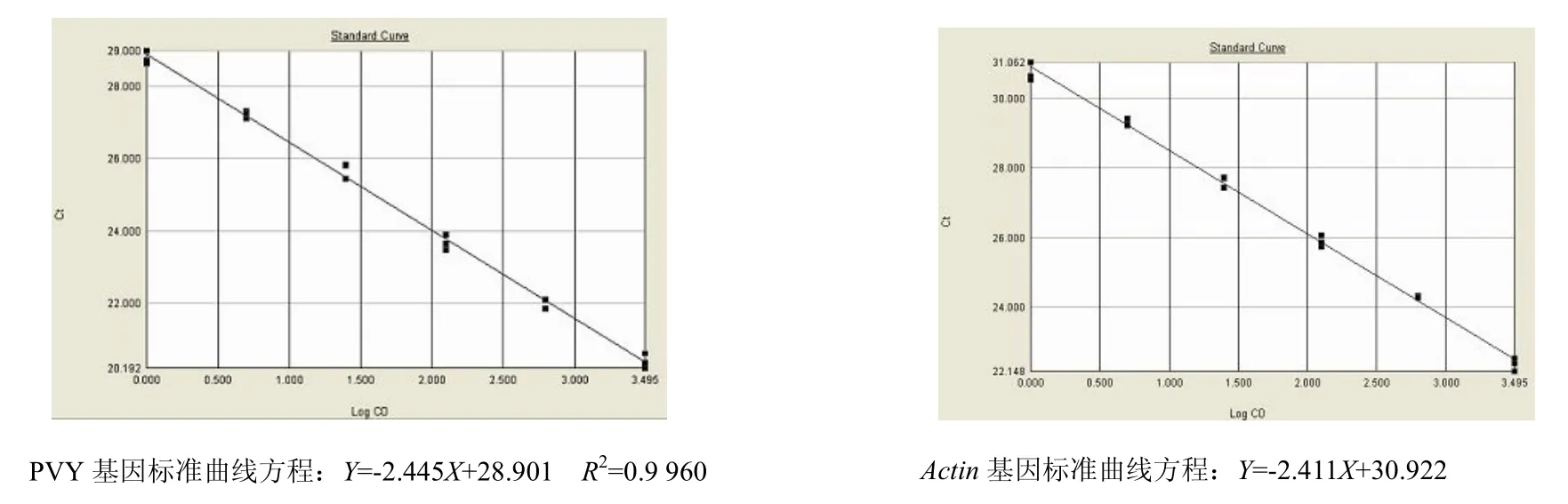
图1 PVY基因和actin基因的标准曲线Fig 1.Standard curve of PVY and actin gene
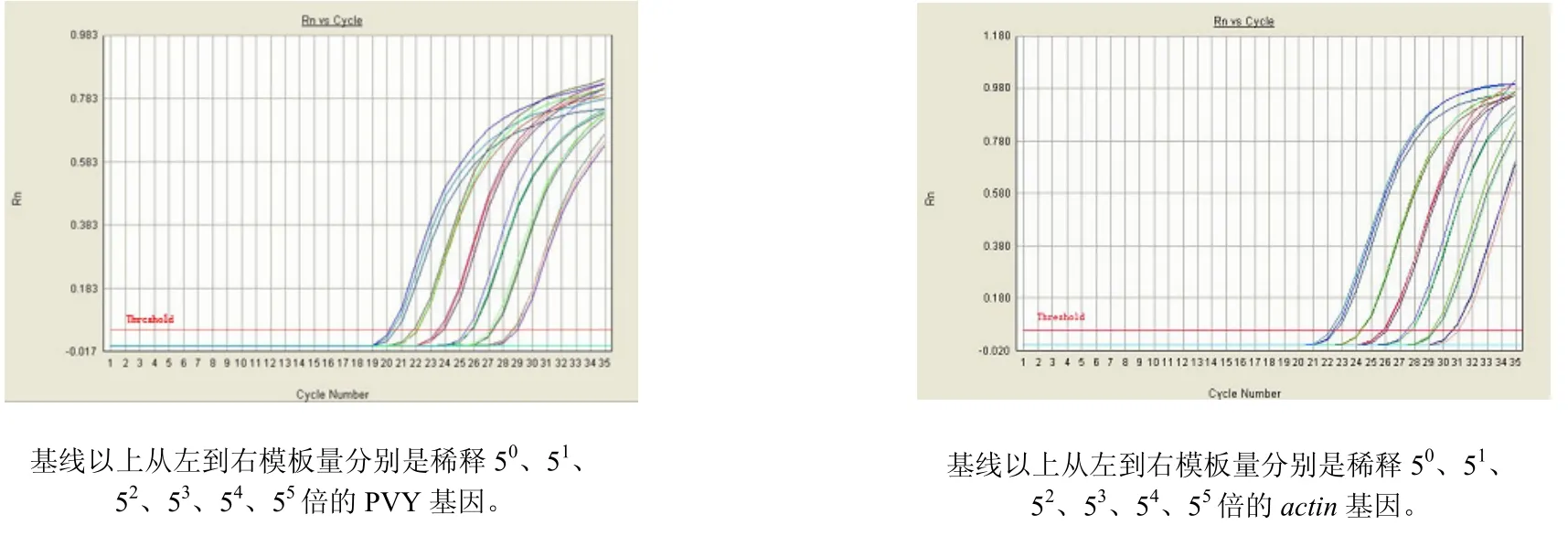
图2 PVY基因和actin基因标准系列扩增曲线Fig.2 Amplification plots of PVY gene and actin gene at different template amounts

图3 PVY基因和actin基因熔解曲线Fig.3 Melting curve of PVY gene and actin gene
1.5%琼脂糖凝胶电泳检测PVY基因和actin基因的Real-time PCR产物,溴化乙锭染色后置于紫外凝胶成像系统(Pharmacia Biotech,Imagemaster VDS)采集图像,结果如图4所示。目的条带单一,条带大小与预期设计相符,进一步说明无引物二聚体和非特异性扩增的产生。
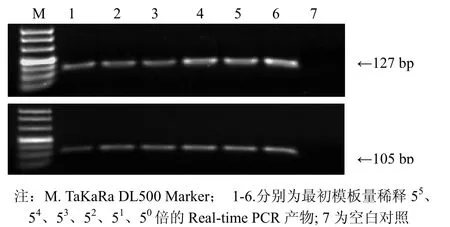
图4 1.5%琼脂糖电泳检测PVY基因和 actin基因 Real-time PCR产物Fig.4 PVY gene and actin gene Real-time PCR products detected by 1.5% agarose gel
2.3 Real-time PCR定量检测的重现性分析
以6个稀释的系列cDNA为模板进行Real-time PCR,3次重复的Ct值误差和变异系数如表1所示,均较小,说明该体系的重现性好。
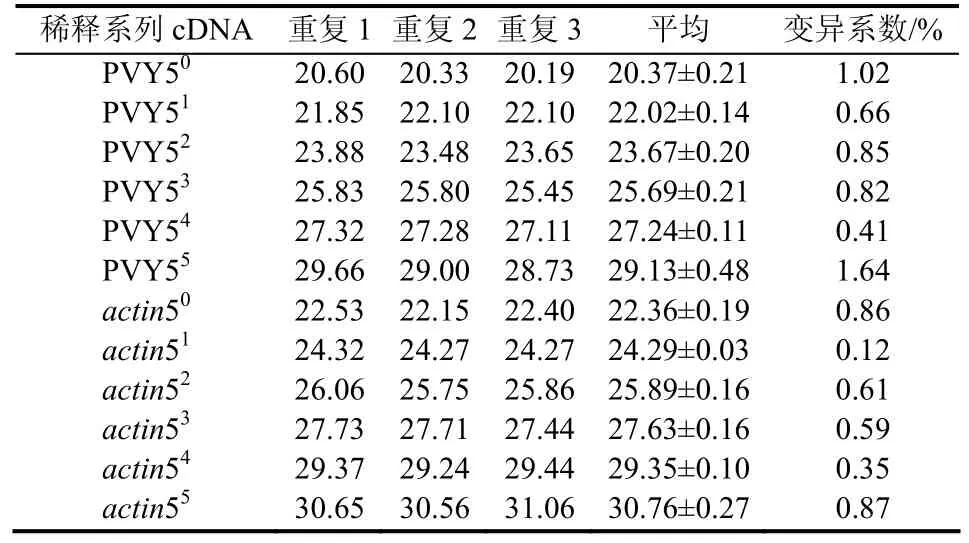
表1 重现性分析(Ct值)Table 1 Repeatability test
2.4 Real-time PCR定量检测体系的应用分析
采自广西百色呈典型烟草病毒病的30个样品,用ELISA试剂盒检测出8个烟草样品被PVY侵染;用Real-time PCR定量检测体系检测出被PVY侵染的样品有12个。DAS-ELISA试剂盒的检测稀释极限为105;而Real-time PCR定量检测体系的检测稀释极限为109。以上结果说明,PVY Real-time PCR定量检测体系与DAS-ELISA相比,具有较高的灵敏性。并且,使用DAS-ELISA检测耗时两个工作日,而利用Real-time PCR检测在1个工作日内可以得到检测结果,具有高效性。
3 讨 论
目前,检测 PVY的方法主要集中于生物学鉴定、光镜和电镜观察、免疫学方法、RT-PCR检测技术、核酸杂交检测技术等。对 PVY的生物学鉴定主要依据寄主植物和传播方式,耗时长,受环境影响较大,检测结果不可靠。光学显微镜观察主要是基于 PVY在寄主细胞内形成风轮状、柱状、片层状的内涵体[1]。电镜负染技术鉴定病毒优点是直接、快速,尤其是免疫吸附电镜,具有较高的灵敏性和特异性,但是不适合于样品过多时使用。并且电镜昂贵,操作电镜需要一定的技术水平,不能达到普遍应用的效果。RT-PCR检测技术,耗时较短,成本低,具有较高的灵敏性和特异性,因此一直受到普遍应用。核酸斑点杂交技术(NASH)检测病毒应用也比较广泛,Singh等[4]利用此技术检测了马铃薯休眠块茎中的PVY病毒,发现NASH比ELISA法更灵敏,更可靠,但是灵敏度和特异性比 RT-PCR差,而且在检测大量样品时,探针分离比较困难[5]。随着分子生物学的发展,各种新技术不断推出,需要建立更为精确的检测PVY的技术体系。
本研究通过与DAS-ELISA检测技术的比较,发现Real-time PCR定量检测技术具有更高的灵敏性,且检测耗时短,效率高。但是real-time PCR定量检测技术需要较昂贵的仪器设备,不适合于规模较小的实验室,这是该技术体系在应用过程中的一个弊端。
孙淑斌等[6]研究指出,real-time PCR可以通过3种主要方法,达到理想的扩增效果:缩短操作时间,尽量在冰上操作;专业设计软件设计适合的实时PCR引物;优化反应条件,改变退火、延伸温度,反应物浓度等。本研究设计按照标准荧光定量PCR引物设计原则,用Primer 5.0进行设计,然后通过Oligo 6.0软件对所设计的引物进行评价,并通过在线BLSAT程序(http://www.ncbi.nlm.nih.gov/blast/)进行验证,设计的引物具有较高的特异性和最小的二级结构。并且通过优化反应条件,最终确立了PVY real-time PCR定量检测体系,为快速、灵敏、高效地定量检测马铃薯Y病毒提供了有力的技术支持。
[1]朱贤朝,王彦亭,王智发.中国烟草病害[M].北京:中国农业出版社,2002:209-216.
[2]路平.马铃薯三种主要病毒的ELISA和RT-PCR检测技术的研究[D].兰州:甘肃农业大学,2005.
[3]杜志游.马铃薯病毒和类病毒的分子诊断方法研究[D].杭州:浙江大学,2006.
[4]Singh M,Singh P R,Moore L.Evaluation of NASH and RT-PCR for the detection of PVY in the Dormant Tubers and its comparison with visual symptoms and ELISA in plants[J].Amer J of Potato Res,1998,76(2):61-66.
[5]Rudra P Singh.Development of the molecular methods for potato virus and viroid detection and prevention[J].Genome,1999,42:592-604.
[6]孙淑斌,李宝珍,胡江,等.水稻低丰度表达基因OsAMT1;3荧光定量PCR方法的建立及其应用[J].中国水稻科学,2006,20(1):8-12.
