淋巴管密度和血管内皮生长因子在膀胱移行细胞癌中的表达及临床意义
2010-07-30刘卫梅
刘卫梅
(河南省焦作市第二人民医院病理科,河南焦作 454100)
移行细胞癌是膀胱最常见的恶性肿瘤,约占90%,好发于50岁以上的男性,与外源性化学性致癌物质(苯胺、联苯胺、萘胺等)、内源性色氨酸等代谢产物及吸烟等致癌因素有关,血尿是常见症状,可发生于膀胱的任何部位。血管形成是肿瘤生长、侵袭和转移的必需因素,最近研究结果提示,某些肿瘤除诱导新生血管形成外,还能诱导新生淋巴管形成,并促进肿瘤细胞通过新生淋巴管向区域淋巴结转移。因此,淋巴管生成系统不仅是许多肿瘤转移的重要途径,更是判断肿瘤预后的重要指标[1]。D2-40是新近发现的一种较特异的淋巴管内皮细胞标志物,被广泛应用于淋巴管形成的研究[2]。本文运用免疫组织化学方法检测膀胱移行细胞癌D2-40标记的淋巴管密度(LVD)和血管内皮生长因子(VEGF)的表达情况,探讨LVD和VEGF表达的相关性及膀胱移行细胞癌临床病理因素的关系和在膀胱移行细胞癌发生、发展中的作用。
1 材料与方法
1.1 材料
收集我院2006年1月~2009年10月手术切除标本,经病理确诊的膀胱移行细胞癌74例,患者年龄29~62岁,平均46岁。发生于肌层浸润或淋巴结转移的54例,黏膜内癌(恶性上皮局限于黏膜与肌层交界处)20例;其中,高分化24例,中分化23例,低分化27例。浸润深度:<1/2肌层25例,≥1/2肌层29例。
1.2 方法
手术标本均经4%中性甲醛溶液固定,常规石蜡包埋,HE染色,光镜下观察。应用免疫酶标组织化学二步法分别进行免疫组织化学标记,DAB显色,乙醇梯度脱水,封固。所用一抗为兔抗人VEGF单克隆抗体,鼠抗人D2-40单克隆抗体、二抗通用型PV-9000均为即用型,由北京中杉金桥生物技术有限公司提供。
1.3 结果判定
VEGF阳性定位于细胞质和细胞膜。按照乔宏等[3]的标准进行判断:①选染色均匀的阳性表达区域,以着色细胞占视野细胞总数的多少分级:无阳性细胞为0级;阳性细胞数≤25%为1级;26%~50%为2级;>50%为3级。②按着色细胞染色强弱计分:无着色为0分;淡黄色为1分;棕黄色为2 分;深棕色为 3 分。 ①+②的判断结果:0~2 为(-);3~6 为(+)。D2-40阳性物质定位于淋巴管内皮细胞胞质和胞膜,淋巴管计数按照Straume等[4]和潘敏鸿等[2]的方法,先后在低倍镜(×100)下扫描切片,选择其中淋巴管高密度区,然后在高倍镜(×400)下计数被D2-40抗体染成棕黄色的淋巴管数目,每个内皮细胞或内皮细胞簇,只要能与邻近脉管、肿瘤细胞或其他结缔组织分开,即视为1个淋巴管。结果以10个高倍视野下的淋巴管数目均值表示测定LVD值。
1.4 统计学分析
2 结果
2.1 LVD和VEGF在不同膀胱组织中的表达
VEGF阳性率和LVD在正常移行上皮、不典型增生移行上皮、移行细胞癌三组中表达逐渐增高,差异有统计学意义(P<0.05);浸润深度≥1/2肌层组VEGF阳性率和LVD高于浸润深度<1/2肌层组和黏膜内癌组,差异有统计学意义(P<0.05);8例淋巴结转移组VEGF阳性率和LVD高于66例无淋巴结转移组,差异有统计学意义(P<0.05)。见表1。
LVD和VEGF阳性率在黏膜内癌组与浸润深度<1/2肌层组间差异无统计学意义(P>0.05);LVD和VEGF在膀胱移行细胞不同分化程度间差异无统计学意义(P>0.05)。见表1。
2.2 VEGF和LVD的相关性
LVD在74例膀胱移行细胞癌VEGF阳性组中高于VEGF阴性组,差异有统计学意义(P<0.05)。见表2。
3 讨论
膀胱移行细胞癌的侵袭与转移往往伴有适宜其生物学行为表达的多种因素的变化,其中肿瘤周围微环境的重建、血管及淋巴管的再生已成为研究的热点。目前,国内外已有不少有关VEGF和LVD在膀胱移行细胞癌中的报道。
表1 VEGF和LVD在不同移行上皮组织中的表达()Tab.1 The expression of VEGF and LVD in different transitional cell cancers()
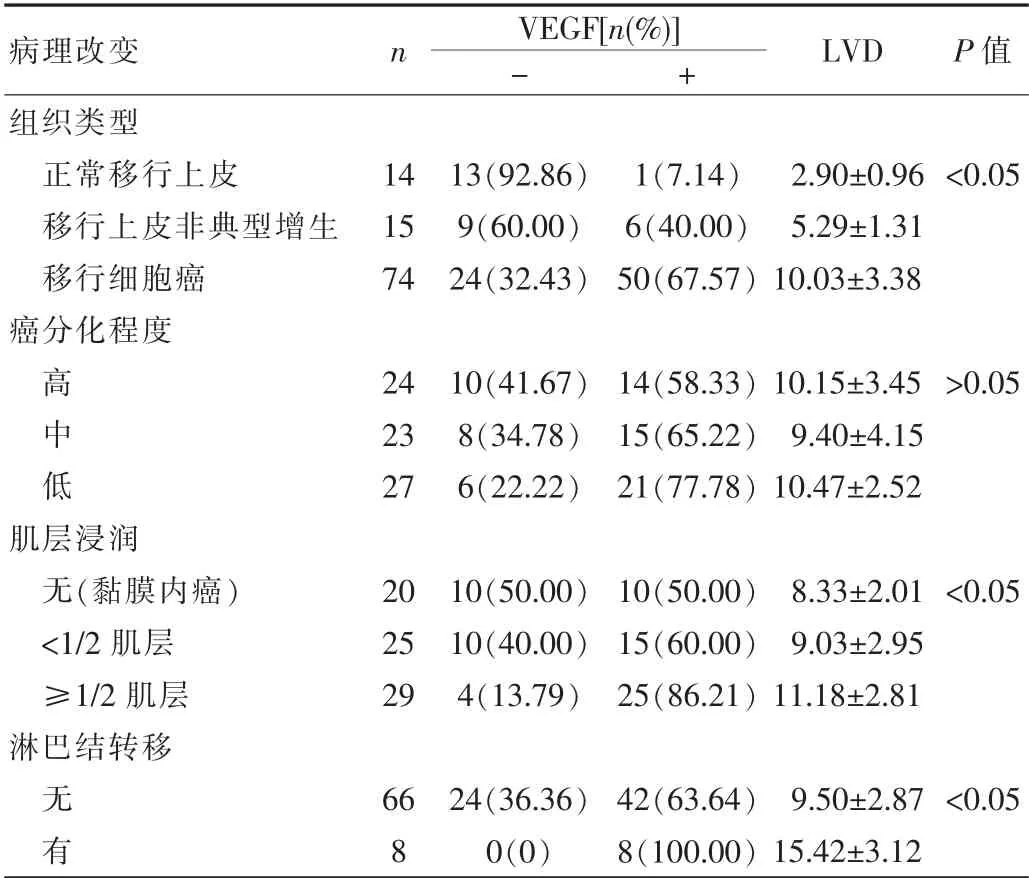
表1 VEGF和LVD在不同移行上皮组织中的表达()Tab.1 The expression of VEGF and LVD in different transitional cell cancers()
病理改变 n VEGF[n(%)]LVD P值-+组织类型正常移行上皮1413(92.86)1(7.14)2.90±0.96<0.05移行上皮非典型增生159(60.00)6(40.00)5.29±1.31移行细胞癌7424(32.43)50(67.57)10.03±3.38癌分化程度高2410(41.67)14(58.33)10.15±3.45>0.05中238(34.78)15(65.22)9.40±4.15低276(22.22)21(77.78)10.47±2.52肌层浸润无(黏膜内癌)2010(50.00)10(50.00)8.33±2.01<0.05<1/2肌层2510(40.00)15(60.00)9.03±2.95≥1/2肌层294(13.79)25(86.21)11.18±2.81淋巴结转移无6624(36.36)42(63.64)9.50±2.87<0.05有80(0)8(100.00)15.42±3.12
表2 膀胱移行细胞癌中VEGF和LVD的关系()Tab.2 The relationship between VEGF and LVD in bladder transitional cell cancers()

表2 膀胱移行细胞癌中VEGF和LVD的关系()Tab.2 The relationship between VEGF and LVD in bladder transitional cell cancers()
VEGF n LVDP值-246.99±1.78<0.05+5011.62±3.00
VEGF是由2条亚基间及其亚基内二硫键连接而成的同源性二聚体糖蛋白化合物,是一种具有高度特异性的内皮细胞有丝分裂原,可以选择性地增强血管和淋巴管内皮细胞的有丝分裂,刺激内皮细胞增殖并促进脉管生成,提高脉管特别是小脉管的通透性,增强其趋化性,促进新生脉管的建立[5]。VEGF家族成员包括VEGF-A、-B、-C、-D和胎盘生长因子(PIGF)。VEGF-A始终被认为只能通过VEGFR-1、VEGFR-2途径作用于血管内皮细胞,促进血管形成过程。然而最近的体外研究结果显示,VEGF-A也可以促进淋巴管内皮细胞增殖、迁移,而且体外和体内原位试验研究也发现淋巴管内皮细胞表面存在VEGFR-2的表达,VEGF-A促进淋巴管内皮细胞增殖和迁移的作用可以通过阻断VEGFR-2被抑制[6-7]。Hirakawa等[8]在转基因小鼠中发现VEGF-A不仅强烈促进肿瘤血管生成,也促进了表达VEGFR-2的肿瘤淋巴管活化与增殖及肿瘤向前哨淋巴结、远端淋巴结的转移。此外,现已发现的VEGF-C是VEGF家族中第一个被发现的淋巴内皮细胞生长因子,目前已在大多数人类恶性肿瘤(如前列腺癌、结直肠癌、胃癌、乳腺癌、肺癌、淋巴瘤、恶性黑色素瘤、纤维肉瘤等)组织中检测到,其表达均明显高于正常组织,并与肿瘤淋巴管形成、淋巴结转移及预后密切相关。Stacker等[9]的研究发现,VEGF-D不但可诱导肿瘤组织内的淋巴管形成,而且可导致肿瘤细胞向区域淋巴结扩散。本研究发现,在正常移行上皮、不典型移行上皮、移行细胞癌组织中VEGF阳性率逐渐增高,并与浸润深度和淋巴结转移有关,提示VEGF在移行细胞癌的发生、发展过程中起重要作用,并可作为移行细胞癌恶性程度及预后判断的指标。同时研究发现,VEGF阳性率与肿瘤细胞的分化程度无明显相关性。移行细胞癌中VEGF阳性组的LVD明显高于VEGF阴性组,也提示VEGF具有促进淋巴管生成的作用。
肿瘤的生长与肿瘤血管的形成密切相关,但在肿瘤生长的早期,尤其是转移瘤生长早期,其营养物质的提供主要靠弥散方式及微淋巴管、新生淋巴管通过扩张形式提供,且随着肿瘤生长淋巴管数量也在增加;管壁结构发生改变,在有肿瘤细胞靠拢的地方会出现明显的间隙或缺口,有利于肿瘤细胞进入淋巴管腔[10]。由于高LVD使肿瘤细胞进入淋巴系统更加容易,因此多数研究发现淋巴管的形成促进了癌的淋巴结转移[11-12],但也有不一致之处。Straume等[13]对皮肤恶性黑色素瘤的研究显示,癌内及癌周LVD与其淋巴转移呈负相关;而Birner等[14]在卵巢癌的研究中发现,LVD与淋巴结转移无关。然而多数研究认为,肿瘤淋巴管生成能促进癌的淋巴结转移[11-12,15-16],造成分歧的可能原因是:①不同肿瘤淋巴管生成的机制可能存在一定的差异;②研究样本量较小;③使用的微淋巴管标志物不同。近年来,一些淋巴管内皮细胞标志物,如VEGFR-3、淋巴内皮透明质酸受体-1(lymphatic vessel endothelial HA receptor-1,LYVE-1)和 podoplanin 等相继出现,使得肿瘤淋巴管形成的研究取得了较大的进展,但随后的研究证实,这些标志物并不是淋巴管内皮细胞特异性标志物。D2-40是新近发现的一种比较特异的淋巴管内皮细胞标志物,使淋巴管计数及测量成为可能。本研究应用鼠抗人D2-40单克隆抗体检测不同不典型移行上皮组织中的LVD发现,在正常移行上皮、不典型移行上皮、不典型移行上皮复杂性增生伴不典型增生、移行细胞癌组织中LVD逐渐增高,并且随着肌层浸润深度和淋巴结转移而升高,提示淋巴管生成在移行细胞癌发展过程中起重要作用,与侵袭转移相关。本研究发现,移行细胞癌的分化程度与LVD无关,LVD与淋巴结转移相关。移行细胞癌的分化程度与淋巴结转移是否相关有待于进一步研究。一般认为肿瘤的分化程度与淋巴结转移有关,造成分歧的可能原因是:①移行细胞癌淋巴结转移的相关因素很多,除肿瘤细胞的分化程度之外,可能其他相关基因及因子在其中发挥了更重要的作用,是多种因素共同作用的结果;②研究的样本量少。
淋巴管的生成受多基因调控、多因素影响,在诸多因素中,VEGF家族已被证实与淋巴管的生成有关,此外还有透明质酸(HA)、细胞外基质(ECM)、碱性成纤维细胞生长因子(bFGF)、整合素 α9β1、NRP-2、Net、Prox-1 和 Ang-2 等,但它们之间的相互关系及作用机制尚不清楚。不同个体及不同组织来源的恶性肿瘤,其恶性生物学行为表达的方式和程度各不相同。本研究初步探讨了子宫内膜样腺癌LVD与VEGF表达的相关性、两者与子宫内膜样腺癌临床病理因素的关系及在其发生、发展中的作用。对于相关因素的探讨可对子宫内膜样腺癌恶性生物学行为的表达提供进一步的认识,为临床治疗及预后提供参考指标。郭子妲等[1]在裸鼠中发现应用针对VEGF的人源VEGF单克隆抗体Bevacizumab(Avastin)能够抑制肿瘤血管和淋巴管的生成,从而切断肿瘤的营养供应,更为有效地抑制肿瘤生长。随着肿瘤淋巴管生成机制研究的不断深入,针对特定肿瘤的抗肿瘤新生淋巴管治疗有望成为继抗肿瘤新生血管治疗之后的又一种肿瘤生物治疗新模式,具有良好的研究和应用前景。
[1]郭子妲,王杰军,于观贞,等.Bevacizumab抑制高转移性人肝癌原位移植瘤的淋巴管形成[J].肿瘤,2006,26(8):713-716.
[2]潘敏鸿,马恒辉,周航波,等.食管鳞状细胞癌组织中淋巴管密度的检测及其临床意义[J].诊断病理学杂志,2008,15(1):23-26.
[3]乔宏,杜进荣,付红,等.子宫内膜样癌微血管密度及血管内皮生长因子表达[J].哈尔滨医科大学学报,2002,36(1):23.
[4]Straume O,Jackson DG,Akslen LA.Independent prognostic impact of lymphatic vessel density and presence of low-grade lymphangiogenesis in cutaneous melanoma[J].Clin Cancer Res,2003,9(1):250-256.
[5]Joukov V,Pajusola K,Kaipainen A,et al.A novel vascularendothleial growth factor VEGF-C,is a ligand for the Flt4(VEGFR-3)and KDR(VEGFR-2)receptor tyrosine kinases[J].EMBO J,1996,15(2):290-298.
[6]Hong YK,Lange-Asschenfeldt B,Velasco P,et al.VEGF-A promotes tissue-repair associated lymphatic vessel formation via VEGFR-2 and the alpha1beta1 and alpha2beta1 integrins[J].FASEB J,2004,18(10):1111-1113.
[7]Bjrndahl MA,Cao R,Burton JB,et al.Vascular endothelial growth factor-α promotes peritumoral lymph angiogenesis and lymphatic metastasis[J].Cancer Res,2005,65(20):9261-9268.
[8]Hirakawa S,Kodama S,Kunstfeld R,et al.VEGF-A induces tumor and sentinel lymph node lymph angiogenesis and promotes lymphatic metastasis[J].J Exp Med,2005,201(7):1089-1099.
[9]Stacker SA,Caesar C,Baldwin ME,et al.VEGF-D promotes themetastasis spread of tumor cells via the lymphatics[J].Nat Med,2001,7(2):186-191.
[10]张梅娟,张丽华.肿瘤淋巴管与肿瘤转移的研究进展[J].临床与实验病理学杂志,2007,23(5):609-611.
[11]He Y,Karpanen T,Alitalo K.Role of lymphangiogenic factors in tumor metastasis[J].Biochiem Biophys Acta,2004,1654(1):3-12.
[12]Franchi A,Gallo O,Massi D,et al.Tumor lymph angiogenesis in head and neck squamous cell carcinoma:a morphometric study with clinical correlations[J].Cancer,2004,101(5):973-978.
[13]Straume O,Jackson DG,Akslen LA.Independent prognostic impact of lymphatic vessel density and presence of low-grade lymph angiogenesis in cutaneous melanoma[J].Clin Cancer Res,2003,9(1):250-256.
[14]Birner P,Schindl M,Obermair A,et al.Lymphatic microvessel density in epithelial ovarian cancer:its impact on prognosis[J].Anticancer Res,2000,20(5A):2981-2985.
[15]李增鹏,牟江洪,向德兵,等.应用免疫组织化学双标技术研究大肠癌淋巴管生成的特点[J].临床与实验病理学杂志,2006,22(3):150-153.
[16]Kim H,Dumont DJ.Molecular mechanisms in lymph angiogenesis:model systems and implications in human disease[J].Clin Genet,2003,64(4):282-292.
