免疫抑制剂作为DNA疫苗佐剂的研究①
2010-07-30米简洁朱庆鸿付红烨康友敏
米简洁 朱庆鸿 付红烨 刘 越 赵 佳 康友敏
(中国农业大学生物学院农业生物技术国家重点实验室,北京100193)
免疫抑制剂是对机体的免疫反应具有抑制作用的药物,临床上主要应用于自身免疫性疾病患者的治疗,但这些免疫抑制剂在临床应用中存在不同程度的毒副作用。新近的研究表明有些免疫抑制剂能够在体外刺激天然T细胞转化为具有抑制功能的Treg细胞[1,2]。
自身免疫性疾病(Autoimmune Disease,AD)是机体对自身抗原产生免疫反应,达到一定强度以致能破坏自身正常组织结构,并引起一定的临床症状,如多发性硬化症(Multiple Sclerosis,MS)、Ⅰ型糖尿病、类风湿关节炎等。研究表明调节性T细胞的数量减少或功能异常均可能导致自身免疫性疾病的发生[3-5]。由于迄今对该类疾病的病因认识不清,对其发病机制研究不透,目前对于自身免疫性疾病的预防和治疗还没有理想的方法和药物。疫苗免疫包括DNA疫苗,已经被证实能够产生长期有效的免疫反应,重要的是疫苗免疫能够产生抗原特异性,并能够形成免疫记忆[6-8]。因此,本研究将免疫抑制剂作为自身免疫性疾病自身抗原的DNA疫苗佐剂共同免疫实验动物,以诱导产生抗原特异性的Treg细胞,并对其预防AD进行初步的研究。
1 材料与方法
1.1 实验动物免疫 雌性C57BL/6小鼠(购于中国医学科学院实验动物研究所),6~8周龄,每组8只。MS的DNA疫苗(p2MOG35)为实验室构建保存。每只小鼠肌肉注射 p2MOG35100μg,FK506(Astellas Ireland Co.,Ltd)、CsA(Novartis Pharma GmbH,Germany)或MMF(Roche Registration Ltd.U.K.)10 μg,免疫两次,间隔 2周 。
1.2 细胞内染色 在第二次免疫后7天,取小鼠脾脏,制备成单细胞悬液,裂解红细胞后,利用细胞胞内染色的方法,1×106细胞加入PMA 50μg/ml和离子霉素100 ng/ml,同时加入莫能霉素(Golgisop产品),于37℃、5%CO2孵箱培育 4小时,利用 4%的多聚甲醛固定,0.1%的皂素破膜后,加入荧光标记的抗小鼠CD4、CD25、Foxp3的单克隆抗体(购于ebioscience)进行染色,流式细胞仪进行检测,CD4+CD25+Foxp3+的T细胞为 Treg细胞,CD4+CD25+Foxp3+T细胞占总CD4+T的比例即Treg细胞比例。同时取样品利用抗小鼠CD11c和IL-10荧光标记单克隆抗体(购于ebioscience)进行染色,CD11c+IL-10+细胞即表达IL-10的DCs细胞,结果以CD11c+IL-10+细胞占CD11c+细胞的比例进行统计分析。
1.3 T细胞增殖 在第二次免疫后7天,取各组小鼠脾脏,制备成单细胞悬液,裂解红细胞后进行细胞计数,利用R&D系统分离纯化CD4+T细胞加入96孔平底细胞板(Costar产品),每孔加入1×105~2×105个细胞,利用德国美天旎CD11c纯化试剂盒分离纯化naive小鼠的CD11c+细胞作为抗原递呈细胞(APC),每孔加入1×104~2×104个细胞,分别加入MOG35~55多肽作为抗原刺激(终浓度5μg/ml),同时加入ConA(阳性对照,终浓度5μg/ml),BSA(非特异性抗原,终浓度5μg/ml)作为阳性和无关抗原对照,刺激 72小时后,每孔加入20μl MTT溶液显色,37℃,5%CO2,培养3~4小时后,用酶标仪测定490 nm的OD值进行读数,结果以刺激指数(SI)计算,公式为:SI=(各刺激孔OD值-培养基OD值)/(未刺激孔OD值-培养基OD值)。
1.4 EAE实验动物模型 将完全弗氏佐剂(CFA,Sigma)与MOG35~55多肽充分乳化后,皮下多点注射雌性C57BL/6小鼠,每只小鼠注射 100μl(200μg MOG35~55多肽与50 μl CFA),同时向腹腔注射百日咳毒素(每只小鼠200 ng,Sigma),24小时候后再次腹腔注射百日咳毒素,以诱导小鼠发病。对诱导后的小鼠每天进行临床打分,评分标准如下:0分,不发病;1分,尾部张力降低;2分,尾部无张力或后肢中度无力;3分,双侧后肢麻痹;4分,后肢麻痹伴前肢力弱或麻痹;5分,濒临死亡或死亡。
1.5 统计学处理 实验结果用t检验进统计学分析,P<0.05差异显著,P<0.01差异极显著。
2 结果
2.1 不同免疫抑制剂对Treg细胞比例的影响 利用CsA、FK506或MMF作为佐剂与p2MOG35共同免疫小鼠两次,间隔2周。第二次免疫后7天,取脾脏单细胞进行细胞内抗体染色,利用流式细胞仪检测Treg细胞的比例,结果如图 1所示,FK506与p2MOG35共同免疫组Treg细胞的比例最高为15%,显著高于p2MOG35单独免疫组(P<0.05),CsA或MMF作为佐剂与p2MOG35共同免疫组与对照组相比,没有显著差异,表明FK506作为p2MOG35的佐剂能够诱导Treg细胞的产生,使Treg细胞的比例显著升高。
2.2 不同免疫抑制剂对T细胞增殖的影响 利用CsA、FK506或MMF作为佐剂与p2MOG35共同免疫小鼠两次,间隔2周。第二次免疫后7天,取脾脏单细胞进行T细胞增殖试验,结果如图2所示。小鼠免疫FK506/p2MOG35组的SI与p2MOG35组相比显著降低(P<0.05)。CsA或MMF作为佐剂与p2MOG35共同免疫组的SI与对照组相比,没有显著差异,表明FK506作为p2MOG35的佐剂免疫小鼠后,能够显著抑制T细胞增殖反应。因此在后续试验中,我们选用FK506作为p2MOG35抑制型的佐剂进行多发性硬化症的预防。

图1 不同免疫抑制剂对Treg细胞的影响Fig.1 The immunosuppressants effect on Treg
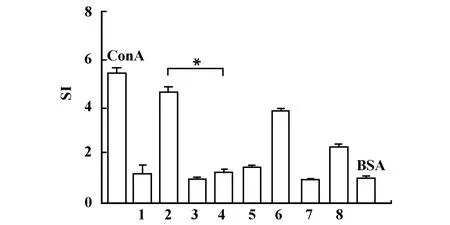
图2 不同免疫抑制剂对T细胞增殖的影响Fig.2 The immunosuppressants effect on T cell proliferation

图3 FK506作为佐剂对DC成熟的影响Fig.3 FK506 effect as adjuvant on DC maturation
2.3 FK506对DCs细胞的影响 DCs细胞接受抗原刺激后的成熟状态,直接影响免疫应答的产生。第二次免疫后7天,取脾脏单细胞进行表面分子抗体染色,检测DCs细胞的成熟状态。结果如图3所示,FK506与 p2MOG35共同免疫组成熟 DCs细胞(CD11c+CD80+)的比例显著低于p2MOG35免疫组,表明FK506作为佐剂能够抑制DCs细胞的成熟。利用流式细胞仪检测DCs细胞表达IL-10的变化,结果如图4所示,FK506与p2MOG35共同免疫组DCs细胞表达IL-10的比例最高为9.8%,显著高于其他对照组,表明FK506作为佐剂能够增强DCs细胞表达IL-10的能力。
2.4 FK506作为佐剂预防EAE的效果 利用FK506作为佐剂与p2MOG35共同免疫小鼠两次,间隔2周。第二次免疫后7天诱导小鼠EAE模型,进行临床打分,观察小鼠EAE发病的变化。在发病高峰比较临床打分结果如图5所示。与p2MOG35免疫组相比,FK506与p2MOG35共同免疫组临床打分显著降低(P<0.01),表明FK506作为佐剂能够预防EAE的发病。
3 讨论

图4 FK506作为佐剂对DC细胞分泌IL-10的影响Fig.4 FK 506 effect as adjuvant on IL-10 expression in DC

图5 FK506作为佐剂对EAE发病的影响Fig.5 FK506 effect as adjuvant on EAE
免疫抑制剂是能够抑制机体免疫反应的药物,主要应用于器官移植排斥反应、自身免疫病及过敏应的治疗[9,10]。近年来研究发现有些免疫抑制剂反能够影响Treg细胞的产生和功能[11,12]。DNA疫苗能够刺激机体产生具有抗原专一性的免疫反应,是预防和治疗疾病的重要和有效途径。疫苗免疫能够产生免疫记忆细胞,再次遇到抗原将会在短时间内大量地扩增特异性的免疫细胞,重要的是疫苗免疫能够产生抗原特异性的。本研究探讨了免疫耐受佐剂作为DNA疫苗佐剂对Treg细胞诱导产生的影响。不同免疫抑制剂对Treg细胞的影响不同[13-15],因此我们比较了FK506、CsA或MMF作为DNA疫苗佐剂,对诱导Treg细胞的影响,结果表明FK506能够诱导Treg细胞的产生,而CsA或MMF却不能。因此我们选用FK506作为DNA疫苗佐剂,并发现免疫后小鼠T细胞增殖反应显著受到了抑制。
DCs是目前已知体内效力最强的专职抗原递呈细胞(APC),具有向免疫细胞递呈抗原、影响T细胞亚群分化和诱导免疫耐受等功能。DCs以成熟DCs和不成熟DCs两种状态存在。机体内不成熟DCs可诱导产生抗原特异性Treg细胞[16,17]。本研究证明FK506作为DNA疫苗佐剂能够抑制小鼠DCs细胞的成熟,增加分泌抑制型细胞因子IL-10的产生,进而上调Treg细胞的比例,并降低EAE的发病症状。
综上所述,FK506作为DNA疫苗佐剂能够显著抑制小鼠DCs细胞的成熟,能够分泌抑制型细胞因子IL-10,刺激Treg细胞的产生,并且能够预防EAE的发病,为自身免疫疾病的研究提供了新的方法和思路。
1 Liu Y,Chen Y,Liu FQ et al.Combined treatment with triptolide and rapamycin prolongs graft survival in amouse model of cardiac transplantation[J].Transpl Int,2008;21(5):483-94.
2 Horibe E K,Sacks J,Unadkat J et al.Rapamycin-conditioned,alloantigen-pulsed dendritic cells promote indefinite survival of vascularized skin allograftsin association with T regulatory cell expansion[J].Transpl Immunol,2008;18(4):307-318.
3 Van Amelsfort JM,Jacobs K M,Bijlsma JW et al.CD4+CD25+regulatory T cells in rheumatoid art hritis:differences in the presence,phenotype,and function between peripheral blood and synovial fluid[J].Arthritis Rheum,2004;50(9):2775-2785.
4 Green E A,Choi Y,Flavell RA.Pancreatic limph node derived CD4+CD25+Treg cells:highly potent regulations of diabetes t hat require TRANCE RANK signals[J].Immunity,2002;16:183-191.
5 Kukreja C G,Marker J.Multiple immunoregulatory defect s in type2diabetes[J].JClin Invest,2002;109:131-140.
6 Wang B,Ugen KE,Srikantan V et al.Gene inoculation generatesimmune responsesagainst human immunodeficiency virus type 1[J].PNAS,1993;90(9):4156-4160.
7 Ferrera F,Cava LA,Rizzi M et al.Gene vaccination for the induction of immune tolerance[J].Ann N Y Acad Sci,2007;1110:99-111.
8 Donnelly J J,Ulmer J B,Shiver J W et al.DNA vaccines[J].Annu Rev Immunol,1997;15:617-648.
9 Allison A C.Immunosuppressive drugs:thefirst 50years and aglance forward[J].Immunopharmacology,2000;47:63-83.
10 O'Keefe S J,Tamura J,Kincaid R L et al.FK-506-and CsA-sensitive activation of the interleukin-2 promoter by calcineurin[J].Nature,1992;357:692-694.
11 Gregori S,Casorati M,Amuchastegui S et al.Regulatory T cells induced by 1,25-dihydroxyvitamin D3 and mycophenolatemofetil treatmentmediate transp lantation tolerance[J].JImmunol,2001;167:1945-1953.
12 Silvia G,Nadia G,Simona S et al.A 1,25-Dihydroxyvitamin D3 analog enhances regulatory T-cells and arrests autoimmune diabetes in NOD mice[J].Diabetes,2002;51:1367-1374.
13 Chen X,Murakami T,Oppenheim J J et al.Differential response of murine CD4+CD25+and CD4+CD25-T cells to dexamethasone-induced cell death[J].Eur J Immunol,2004;34(3):859-869.
14 Chung I Y,Dong H F,Zhang X et al.Effect sof IL27 and dexamet hasone:induction of CD25,the high affinity IL-2 receptor,on human CD4+cells[J].Cell Immunol,2004;232(1-2):57-63.
15 Gregori S,Casorati M,Amuchastegui S et al.Regulatory T cells induced by 1 alpha,25-dihydroxyvitamin D3 and mycophenolate mofetilt reatment mediate transplant tolerance[J].JImmunol,2001;167:1945-1953.
16 Cavanagh L L,Von Andrian U H.Travellers in many guises:the origins and destinations of dendritic cells[J].Immunol and Cell Bioltogy,2002;80(5):448-462.
17 Shannon J T.Dendritic cells:inciting and inhibiting autoimmunity[J].Current Opinion in Immunology,2002;14(6):765-770.