盐胁迫对灌木柳无性系幼苗生长及光合作用的影响
2010-07-30隋德宗王保松施士争教忠意
隋德宗,王保松,施士争,教忠意
(江苏省林业科学研究院,江苏 南京211153)
中国有各种类型的盐渍土面积约为9 900万hm2,其中滩涂盐土面积为267万hm2左右。这些滩涂土层深厚,雨水充沛,但由于土地盐碱较重、生态环境恶劣致使林木稀少。研究表明,通过对遗传基础广泛的树种无性系进行耐盐筛选,利用优良无性系造林能有效改良盐碱土,绿化滩涂,改善沿海生态环境[1]。柳树Salix spp.生长快,适应性广,抗逆性强,是世界上分布最为广泛的树种之一。中国柳树种质资源丰富,自然分布的品种有257个,其中灌木柳190多种[2]。江苏省林业科学研究院从20世纪60年代起开展系统的柳树栽培和育种工作,至今已保存优良无性系2 000多个。为了选育耐盐柳树新无性系,综合治理开发沿海低湿滩涂土地资源,课题组成员特选用新近杂交培育的6个灌木柳无性系为试验材料,研究其在盐胁迫下的生长和光合作用,为耐盐柳树品种选育提供理论基础和科学依据。
1 材料与方法
1.1 供试材料
试验材料为江苏省林业科学研究院杂交培育的6个灌木柳杂种新无性系(表1)。

表1 供试灌木柳无性系Table 1 Shrub willow clones tested
1.2 试验方法
2008年3月16日至5月4日采用营养液水培法,在江苏省林业科学研究院温室内进行。室内温度控制在20~30℃,7 d更换1次溶液。用Hogland全营养液加氯化钠配成3种盐质量浓度溶液[3](ρ=1,2,3 g·L-1)研究盐胁迫对苗木生长和光合作用的影响,对照(ck)为不加氯化钠的全营养液。水培容器为350 mL的玻璃瓶。每瓶为1个处理,每处理内加280 mL溶液,水培2根插穗苗。各处理随机排列,重复3次。
1.3 指标测定
1.3.1 生长指标测定 试验处理50 d,测定苗高和根长后分别取水培苗地上和地下部分,洗净擦干,称取鲜质量。
1.3.2 叶绿素质量分数的测定 参考Amon的方法并略改进[4],称取相同部位叶片0.2 g剪碎,加入5 mL(体积分数为95%)乙醇和5 mL丙酮于暗处浸提24 h,中间经常摇动,至叶片呈白色。用分光光度计(UV-760)分别在波长为645 nm和663 nm处测定吸光度值,根据以下公式计算叶绿素质量分数:CT=8.02A663+20.21A645。
1.3.3 叶片光合指标的测定 水培30 d后,选取相同部位的成熟叶片进行净光合速率(Pn)、气孔导度(Gs)和胞间二氧化碳摩尔分数(Ci)测定,应用美国产Li-6400于上午9:00-11:00进行,测定时光强为1 100 μmol·m-2·s-1左右,温度为20℃,大气二氧化碳摩尔分数为385 μmol·mol-1左右。3 次重复,取平均值。
1.4 数据统计分析
实验数据用Excel软件和DPS软件进行方差分析。
2 结果与分析
2.1 盐胁迫对苗木生长的影响
2.1.1 盐胁迫对苗木根长的影响 从表2可以看出,低盐胁迫下(1 g·L-1和2 g·L-1)根长与对照相比并无显著降低,高盐胁迫下(3 g·L-1),除JW2345无性系外其余无性系根长均显著低于对照。其中JW1065和JW2334无性系根长受盐胁迫影响较大,在3 g·L-1盐处理下根系已死亡,根长为0;JW22-2和JW2372无性系受盐胁迫影响较小,在3 g·L-1盐处理下根长仅分别比对照减少23%和28%。
2.1.2 盐胁迫对苗木根系生物量的影响 同时由表2可知,在低盐胁迫下6个无性系苗根系生物量与对照相比没有显著差异,但在3 g·L-1盐胁迫时比对照显著下降。其中JW1065和JW2334无性系根生物量受盐胁迫影响较大,在盐质量浓度3 g·L-1时,根质量比对照降低100%;JW22-2和JW2345无性系根生物量受盐胁迫影响较小,在3 g·L-1盐质量浓度时根质量仅比对照下降25%和24%。
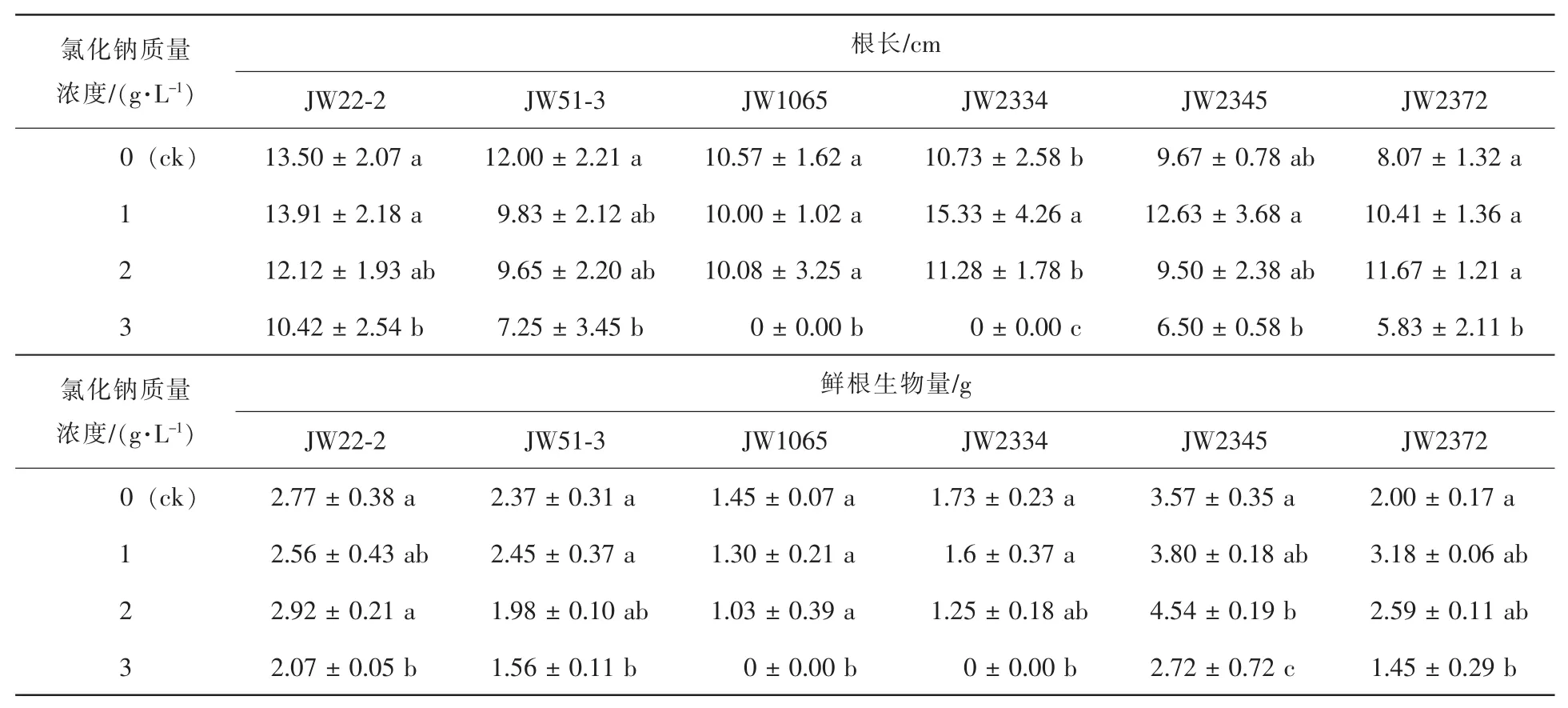
表2 盐胁迫对灌木柳无性系幼苗地下部分(根)生长的影响Table 2 Root growth of shrub willow clones in salt stress
2.1.3 盐胁迫对苗木苗高的影响 由表3结果可知,盐胁迫对6个无性系苗高均有显著影响,各处理均低于对照,差异极显著(F处理=25.81,F0.01=5.42)。其中,JW2345和JW2372无性系苗高受盐胁迫影响最小,3 g·L-1盐处理下分别比对照下降31%和43%。JW1065和JW2334无性系苗高生长受盐胁迫影响最大,3 g·L-1盐处理下茎叶已全部萎蔫致死亡,苗高数据为0。
2.1.4 盐胁迫对苗木茎叶生物量的影响 同时由表3可知,盐处理对6个无性系苗木茎叶鲜质量均有显著影响,各处理均比对照降低,差异极显著(F处理=33.89,F0.01=5.42)。其中,JW1065和JW2334无性系茎叶鲜质量受盐胁迫影响较大,在3 g·L-1盐质量浓度胁迫下茎叶鲜质量比对照降低100%。JW2345无性系和JW 2372无性系苗茎叶鲜质量受盐胁迫影响较小,3 g·L-1茎叶鲜质量仅比对照分别降低35%和53%。

表3 盐胁迫对灌木柳无性系幼苗地上部分(茎叶)生长的影响Table 3 Stems and leaves growth of shrub willow clones in salt stress
2.2 盐胁迫对苗木光合作用的影响
2.2.1 对苗木叶净光合速率(Pn)的影响 由图1可知,盐胁迫对6个灌木柳无性系苗净光合速率有显著影响。双因素方差分析表明:处理间差异极显著(F处理=9.78,F0.01=5.42),无性系间差异显著(F无性系=3.86,F0.05=2.90)。各处理与对照相比均降低,且随着盐处理质量浓度的提高,Pn下降幅度增大。不同无性系苗Pn对盐胁迫的响应程度不同,JW2345和JW2372无性系叶片Pn受盐胁迫影响较小,在盐质量浓度为3 g·L-1时与对照相比分别下降6%和32%。JW51-3和JW2334无性系叶片Pn受盐胁迫影响较大,在3 g·L-1盐质量浓度胁迫下比对照分别下降67%和83%。
2.2.2 盐胁迫对苗木叶气孔导度(Gs)的影响 从图2看出,盐胁迫对6个无性系的气孔导度有显著影响。双因素方差分析表明:处理间差异极显著(F处理=13.50,F0.01=5.42),无性系间无显著差异(F无性系=1.87,F0.05=2.90)。各处理均比对照降低,并随着盐胁迫质量浓度的提高,Gs的下降幅度也逐渐加大。盐胁迫对不同无性系叶片Gs的影响程度不同。JW2345和JW2372无性系受盐胁迫影响较小,在3 g·L-1盐质量浓度胁迫下叶片Gs分别比对照下降39%和48%,JW1065和JW2334无性系受盐胁迫影响较大,在3 g·L-1盐质量浓度下叶片Gs分别比对照下降88%和95%。

图1 盐胁迫对灌木柳无性系叶片Pn的影响Figure 1 The photosynthetic rate of shrub willow clones in salt stress

图2 盐胁迫对灌木柳无性系叶片Gs的影响Figure 2 The stomatal conduction of shrub willow clones in salt stress
2.2.3 盐胁迫对苗木叶胞间二氧化碳摩尔分数(Ci)的影响 盐胁迫对6个无性系胞间二氧化碳摩尔分数(Ci)的影响见图3。双因素方差分析表明,品种和无性系间均无显著差异(F处理=0.21,F0.01=3.29;F无性系=2.38,F0.05=2.90)。在盐胁迫处理下,JW22-2,JW51-3,JW2345和JW2372无性系的Ci与对照相比均降低,并随着盐处理质量浓度的提高下降幅度逐渐加大。JW22-2和JW51-3无性系在3 g·L-1盐胁迫下的Ci与对照相比分别下降20%和22%。盐处理下JW1065和JW2334无性系的Ci高于对照,其中3 g·L-1盐处理时分别比对照增加18%和7%。
2.2.4 盐胁迫对苗木叶绿素质量分数(ρchl)的影响 由图4可知,盐胁迫对6个无性系苗木叶绿素质量分数(ρchl)均有显著影响。方差分析表明:处理间差异极显著(F处理=69.7,F0.01=5.42),无性系间存在显著差异(F无性系=4.29,F0.05=2.90)。各处理与对照相比均降低,并随着盐处理质量浓度的提高下降幅度增大。在 3 g·L-1盐胁迫下6个无性系叶绿素质量分数(ρchl)均受到严重抑制。其中,JW2345无性系和JW51-3无性系受影响较小,比对照分别下降68%和75%。JW22-2无性系和JW2372无性系下降较多,为79%和80%。JW1065和JW2334无性系受盐胁迫影响最大,地上部分全部萎蔫致死亡,因而未获得叶绿素数据。
3 结论与讨论
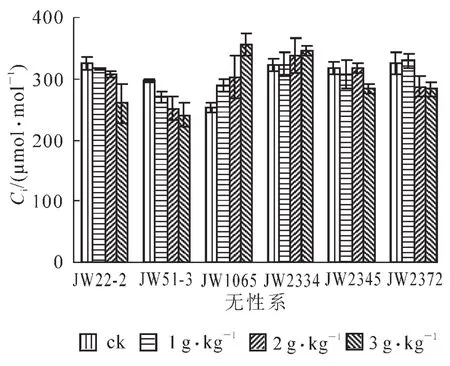
图3 盐胁迫对灌木柳无性系叶片Ci的影响Figure 3 The intercellulan CO2concentration of shrub willow clones in salt stress
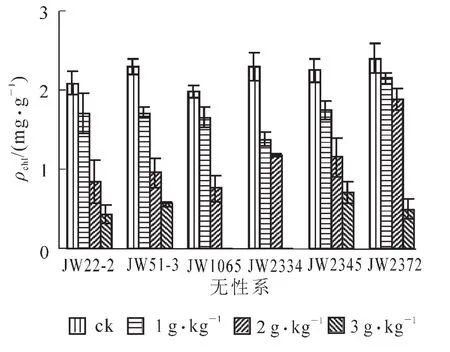
图4 盐胁迫下灌木柳无性系叶绿素质量分数Figure 4 The chlorophyll content of shrub willow clones in salt stress
在盐分胁迫下,植物的根系与盐分直接接触,是最早的受害器官,因此,它的生长发育情况是植物适应盐胁迫的重要标志[5-6]。有研究表明,非盐生植物受到盐胁迫后的早期反应是地上部分生长变得缓慢,根的生长总是很少或几乎不受影响[7-8]。本研究的结果表明:低盐胁迫(1~2 g·L-1)对6个无性系的根长和根生物量均无显著影响,高质量浓度盐胁迫(3 g·L-1)使根长和根生物量显著降低。在盐胁迫条件下,植物具有最大的生长量和生物量是耐盐育种的根本目的,因此,生长量和生物量可作为评价植物耐盐性强弱的可靠指标。但是,仅根据苗期的生长进行选种是不可靠的,将胁迫和非胁迫条件下苗木的生长相比较,则能较好地反映植物对盐胁迫的适应能力[9]。本试验结果显示,盐处理下6个无性系苗高和茎叶生物量均低于对照,并随着盐处理质量浓度的提高下降幅度逐渐增大,6个无性系的下降幅度有所不同,JW2345和JW2372下降幅度最小,3 g·L-1盐质量浓度处理时茎叶鲜质量仅比对照分别降低35%和53%。JW1065和JW2334下降幅度最大,在盐质量浓度为3 g·L-1时苗已全部死亡。
盐胁迫降低光合速率,减小同化物与能量供给,从而限制植物的生长发育[10-12]。本研究表明,盐胁迫处理下,6个灌木柳无性系的净光合速率均比对照降低,并随盐质量浓度的提高下降愈加明显。6个无性系中JW2345和JW2372下降幅度较小,3 g·L-1盐质量浓度时与对照相比分别下降6%和32%,JW51-3和JW2334下降幅度最大,在3 g·L-1质量浓度盐胁迫下比对照分别下降67%和83%。导致光合速率降低的因素包括气孔限制和非气孔限制[13],如果胁迫使气孔导度减小而叶肉细胞仍在活跃地进行光合作用,胞间二氧化碳摩尔分数明显下降,这种情况是典型的气孔限制所致。如果叶肉细胞光合能力显著降低,即使在气孔导度降低的情况下,胞间二氧化碳摩尔分数也有可能升高或者不变[14]。本试验结果为,盐胁迫处理下6个灌木柳无性系的Gs均比对照降低,并随盐质量浓度的提高下降愈加明显。Ci的变化趋势因品种不同而有所不同,盐胁迫处理下JW22-2,JW51-3,JW2345和JW2372的Ci比对照降低,也呈随着盐处理质量浓度的提高下降幅度加大的趋势,而JW1065和JW2334无性系在盐胁迫处理下的Ci均高于对照。这说明,JW22-2,JW51-3,JW2345和JW2372无性系光合速率的下降主要是由气孔限制因素引起的,而JW1065和JW2334无性系叶光合速率的下降是由非气孔因素即细胞光合性能下降引起的[13]。叶绿素是光合色素中重要的色素分子,参与光合作用中光能的吸收、传递和光能的转化,在光合作用中占有重要地位。研究表明,在盐胁迫下叶绿素酶能加速叶绿素的降解,同时过量的Na+渗入细胞后使原生质凝聚导致植物叶绿素质量分数下降,从而降低植物的光合作用[15-19]。本试验结果表明,盐处理对6个供试无性系叶绿素质量分数均有显著影响,各处理均比对照显著下降,并随着盐处理质量浓度的提高,下降幅度加大。在3 g·L-1盐质量浓度处理下,JW2345无性系的叶绿素质量分数最高,仅达对照32%。
综上研究,在盐胁迫下,JW2345和JW2372无性系水培苗的苗高、生物量鲜质量、叶绿素质量分数和净光合速率下降幅度最小,因此耐盐性相对较强;JW1065和JW2334无性系在相同盐胁迫处理条件下的叶绿素质量分数、净光合速率、苗高和生物量下降幅度最大,耐盐性较弱。研究结果尚需在沿海滩涂造林实践中进一步验证。
致谢:研究工作得到李晓储研究员、李博硕士和焦秀洁硕士的支持与帮助,在此致以最诚挚的谢意。
[1]翟凤林,曹鸣庆.植物的耐盐性及其改良[M].北京:农业出版社,1984.
[2]涂忠虞.柳树育种与栽培[M].南京:江苏科学技术出版社,1982:19-20.
[3]潘瑞炽.植物生理学[M].北京:高等教育出版社,2001:28-29.
[4]ZOU Qi.Laboratory Manual of Plant Physiology and Biochemistry [M].Beijing:China Agriculture Press,1995:23-25.
[5]苗海霞,孙明高,夏阳,等.盐胁迫对苦楝根系活力的影响[J].山东农业大学学报:自然科学版,2005,36(1):9-12.MIAO Haixia,SUN Minggao,XIA Yang,et a1.Effects of salt stress on root activity of Melia azedarach L.seedling [J].J Shandong Agric Univ Nat Sci,2005,36(1):9-12.
[6]张立钦,郑勇平,吴纪良,等.黑杨派新无性系水培苗对盐胁迫的反应研究[J].浙江林学院学报,2000,17(2):121-125.ZHANG Liqin,ZHENG Yongping,WU Jiliang,et al.NaCl stress of new Aigeiros clones seedlings from water cultures[J].J Zhejiang For Coll,2000,17(2):121-125.
[7]CHARTZOULAKIS K,LOUPASSAKI M,BERTAKI M,et al.Effects of NaCl salinity on growth ion content and CO2assimilation rate of six olive cuhivars [J].Sci Hortic,2002,96:235-247.
[8]FUNG L E,WANG S S,ALTMAN A,et a1.Effect of NaCl on growth,photosynthesis,ion and water relations of four poplar genotypes [J].For Ecol Manage,1998,107:135-146.
[9]杨敏生,李艳华,梁海永,等.白杨派杂种无性系及其亲本光合和生长对盐胁迫的反应[J].林业科学,2006,42(4):19-26.YANG Minsheng,LI Yanhua,LIANG Haiyong,et al.Comparison of growth and photosynthesis in response to salt stress in Populus hybridization clones and their parent species [J].Sci Silv Sin,2006,42(4):19-26.
[10]朱新广,张其德.NaCl对光合作用影响的研究进展[J].植物学通报,1999,16(4):332-338.ZHU Xinguang,ZHANG Qide.Advances in the research on the effects of NaCl on photosynthesis[J].Chin Bull Bot,1999,16(4):332-338.
[11]PARIDA A K,DAS A B.Salt tolerance and salinity effects on plants:a review [J].Ecotoxicol Environ Saf,2005,60:324-349.
[12]MANSOUR M M F,SALAMA K H A.Cellular basis of salinity tolerance in plants [J].Environ Exp Bot,2004,52:113-122.
[13]BERRY J A,DOWNTON W J S.Environmental Regulation of Photosynthesis [M].New York:Academic Press,1982:263-345.
[14]FARQUHAR G D,SHARKEY T D.Stormatal conductance and hotosynthesis [J].Annu Rev Plant Physiol,1982,33:317-345.
[15]ARO E M,MCCAFFERY S,ANDERSON J M.Photoinhibition and DI protein degradation in peas acclimated to different growth irradiances [J].Plant Physiol,1993,103:599-626.
[16]葛江丽,石雷,谷卫彬,等.盐胁迫条件下甜高粱幼苗的光合特性及光系统(Ⅱ)功能调节[J].作物学报,2007,33(8):1272-1278.GE Jiangli,SHI Lei,GU Weibin,et al.Photosynthetic characteristics and the salt-stressed sweet sorghum seedlings[J].Acta Agron Sin,2007,33(8):1272-1278.
[17]惠红霞,许兴,李守明.盐胁迫抑制枸杞光合作用的可能机理[J].生态学杂志,2004,23(1):5-9.HUI Hongxia,XU Xing,LI Shouming.Possible mechanism of inhibition on photosynthesis of Lyeium barbarum under salt stress [J].Chin J Ecol,2004,23(1):5-9.
[18]DEMMING-ADAMS B.Photoprotection and oter responses of plants to high light stress [J].Ann Rev Plant Physiol Plant Mol Biol,1992,43:599-626.
[19]王慰,黄胜利,丁国剑,等.盐胁迫下舟山新木姜子1年生苗形态变化与生理反应 [J].浙江林学院学报,2007,24(2):168-172.WANG Wei,HUANG Shengli,DING Guojian,et al.Morphological and physiological changes accompanying the induction of salt tolerance in Neolitsea sericea seedlings [J].J Zhejiang For Coll,2007,24(2):168-172.
