紫叶酢浆草遗传转化体系优化*
2010-07-26付慧娟王金刚
徐 婷, 吴 多, 杨 雪, 付慧娟, 王金刚
(东北农业大学 园艺学院,黑龙江哈尔滨150030)
紫叶酢浆草(Oxalis triangularisA.St.-Hil.‘Purpurea’),又称紫蝴蝶,是酢浆草科酢浆草属多年生草本植物。因其叶片紫红色、花淡雅清香、管理粗放、园林应用广泛而深受人们喜爱。为了满足人们对花卉求新求异的需要,且紫叶酢浆草本身具有的诸多优良特性,对紫叶酢浆草进行转基因分子育种,培育更多优良的酢浆草品种具有重要的现实意义。
目前紫叶酢浆草的研究多集中于栽培管理和组织快繁等方面[1,2],对于转基因方面的研究还未见报道。本试验以紫叶酢浆草叶片为外植体,利用根癌农杆菌(Agrobacterium)介导法将查儿酮合成酶基因RNA干扰载体转入紫叶酢浆草中。根据已报道的紫花苜蓿[3]、百合[4]、月季[5]、洋桔梗[6]、马铃薯[7]等植物遗传转化的研究情况,对紫叶酢浆草遗传转化的主要影响因素卡那抗性、除菌剂种类及浓度和侵染时间等影响因素进行研究,旨在建立紫叶酢浆草高效遗传转化体系,为其转基因分子育种寻求一条快速有效的途径。
1 材料与方法
1.1 材料
紫叶酢浆草无菌苗,农杆菌EHA105、查尔酮合成酶RNA干扰表达载体均由东北农业大学园林育种实验室保存。Taq酶、DL2000购于TaKaRa公司,卡那霉素、头孢唑啉那、阿莫西林克拉维酸钾等均为国产针剂,其它试剂均为分析纯。M1培养基:MS+NAA0.5mg/L+6-BA1.5mg/L M2培养基:MS+NAA0.5mg/L+6-BA1.5mg/Lkm30mg/L+Amo100mg/L
1.2 实验方法
1.2.1 卡那霉素筛选压力的确定
首先设定 0,25,50,75,100 mg/L 6 个梯度,结果表明除0mg/L外分化率均为0。此基础上,将Km浓度重新设置为 0、5、10、15、20、25 、30mg/L 7 个梯度。具体过程:将紫叶酢浆草叶盘分别接种在含Km浓度为0、5、10、15、20、25 mg/L的 M1 分化培养基上,光下培养,每15d继代一次,3周后统计分化结果。
1.2.2 除菌剂种类及浓度的确定
根据所查阅文献,选用2种除菌剂,比较其除菌效果及其对紫叶酢浆草叶盘分化的影响。分别是头孢唑啉那 0、100、200、300、400、500、600 mg/L 7 个梯度;阿莫西林克拉维酸钾 0、25、50、75、100、125、150 mg/L 7个梯度。
并 在 此 实 验 基 础 上 设 置 Amo0,75,100,125,150mg/L 5个梯度,将紫叶酢浆草叶盘接种于含有不同浓度AmoM1培养基上,筛选不抑制植物生长的最大除菌剂浓度。
1.2.3 农杆菌最佳侵染时间的确定
采用OD600=0.6~0.8的农杆菌菌液侵染预培养3d的无菌苗叶片,设计的侵染时间分别为 2,5,7,10,15,20 min,侵染结束后,将其接种到M2培养基上,培养一段时间后,观察其外植体和农杆菌的长势并记录结果。
1.2.4 农杆菌对外植体的侵染
根据《植物基因工程》[8]根瘤农杆菌叶盘法转化,将查尔酮合成酶RNA干扰表达载体转入到紫叶酢浆草。
1.2.5 转基因植株PCR检测
用PBI-CHSi中的GUS-1和CHSF-A为的引物进行PCR检测。具体反应条件如下:94℃预变性7min;94℃变性 30s;65℃退火 30s;30 个循环 ;72℃延伸1.5min;72℃延伸10min;4℃终止反应。电泳分析结果。
2 结果与分析
2.1 卡那霉素筛选压力的确定
将 Km 浓 度 重 新 设 置 为 0、5、10、15、20、25 、30mg/L7个梯度。结果见表1和图1。
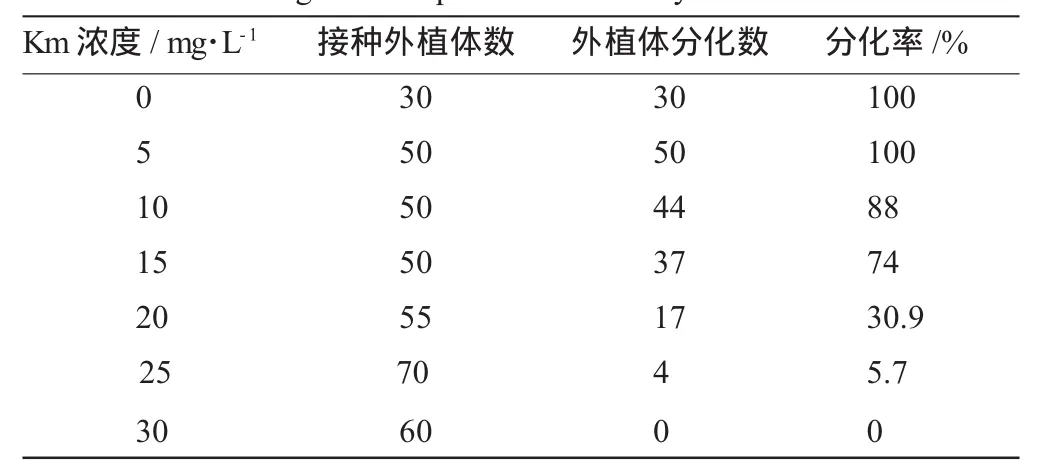
表1 卡那霉素浓度梯度试验Table 1 The gradient experiment ofkanamycin concentration

图1 卡那霉素筛选压力的确定Fig.1The experiment of Km selection pressure
由表1和图1可知,第一次接种Km浓度为25mg/L时紫叶酢浆草叶盘分化率为0,第二次接种Km浓度为25mg/L时紫叶酢浆草叶盘分化率为5.7%。说明具有个体差异性。因此为了提高筛选效果,减少因个体差异而出现的未转化目的基因的抗性植株,将Km浓度确定为30mg/L。
2.2 除菌剂浓度的测定
含有CHS基因RNAi表达载体的农杆菌加入到含有不同浓度除菌剂的YEP培养基中200r/min,28℃培养48h,用紫外分光光度计检测浓度。结果见图2。
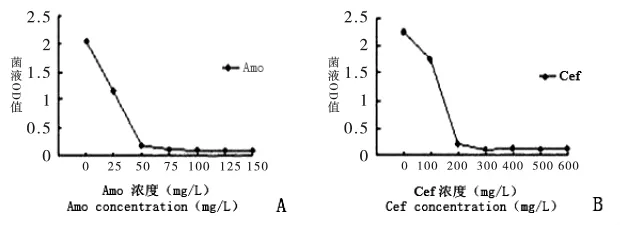
图2 除菌剂及浓度筛选Fig.2 Selection of degerming agent and concentration
当Amo100~150mg/L能有效抑制农杆菌的生长;当Cef 300~500mg/L时能有效抑制农杆菌的生长。同时设置 Amo0,75,100,125,150mg/L5 个梯度接种紫叶酢浆草叶盘,筛选不抑制植物生长的最大除菌剂浓度。结果见表2。
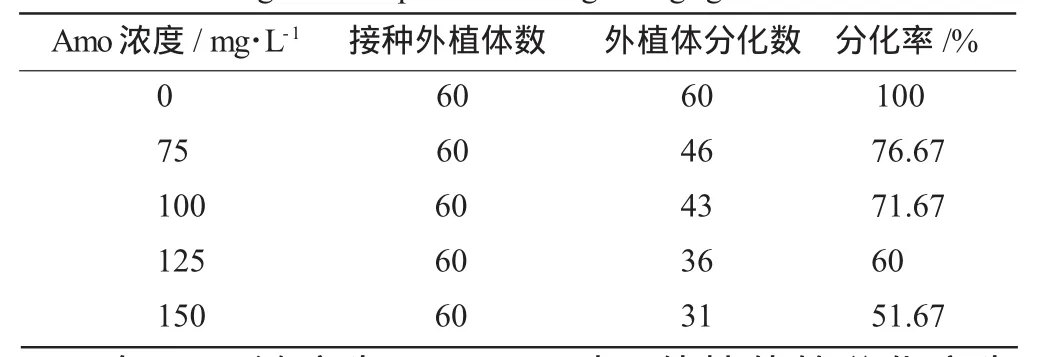
表2 除菌剂浓度梯度实验Table 2 The gradient experiment ofdegermingagent concentration
在Amo浓度为100mg/L时,外植体的分化率为71.67%与Amo浓度为76.67%时差距不大,而当Amo浓度为125mg/L时,外植体分化率仅为60%。且当Amo100~150mg/L均能有效抑制农杆菌的生长,本着筛选不抑制植物生长的最大除菌剂浓度的原则,确定紫叶酢浆草转化除菌剂浓度为Amo100mg/L。
2.3 农杆菌最佳侵染时间的确定
实验证明不同的侵染时间对外植体的转化有较大的影响。对不同侵染时间的外植体分化进行了统计和观察,结果见表3。
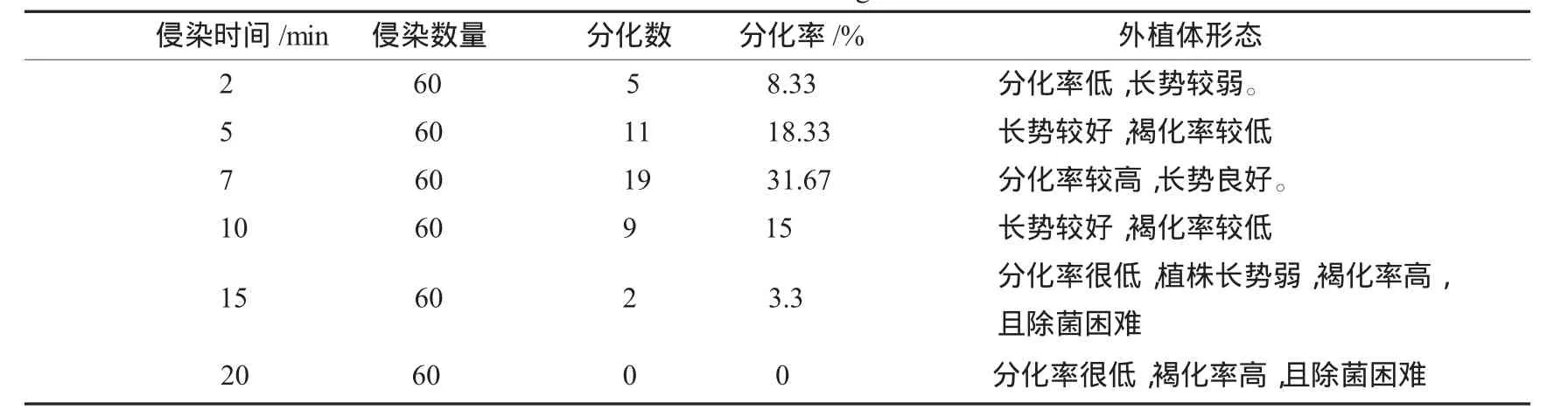
表3 农杆菌侵染时间确定Table 3 The time ofinfection ofagrobacterium
从表3中可以看出,侵染时间为2 min时,转化率稍低,植株长势弱;侵染时间为15~20 min时,转化几乎不成功;且褐化率高,除菌困难;侵染时间5~10 min时分化率较高,褐化率低,除菌较容易,其中侵染时间为7 min时,植株长势最好,确定侵染时间为7 min。
2.4 农杆菌对外植体的侵染
经试验确定农杆菌对紫叶酢浆草侵染转化的具体条件为:
预培养培养基:MS+NAA0.5 mg/L+6-BA1.5 mg/L;预培养时间为3 d;侵染时间为7 min;共培养时间为2~3d;筛选培养基:MS+NAA0.5mg/L+6-BA1.5mg/L+km30mg/L+Amo100mg/;25℃光照培养,15~20d 继代一次。大约25~30d分化出不定芽,当芽长至3cm时进行生根培养,然后进行驯化培养。图3为转基因植株再生过程。

图3 紫叶酢浆草植株再生Fig.3 Plant regeneration of oxalis triangularis A.St.-Hil.‘Purpurea’
2.5 转基因植株的PCR检测
以转pBI-CHSi质粒抗性植株的总DNA为模板,以质粒pBI-CHSi为阳性对照,分别以未转化植株的总DNA和水为阴性对照和负对照,以CHSi基因序列特异引物进行PCR扩增。阳性对照和部分转基因植株扩增出约509p的目的片段,而阴性对照无扩增带(见图4)。用得到的23个转基因植株进行检测,结果表明其中有9株为阳性植株,阳性率为37.5%。
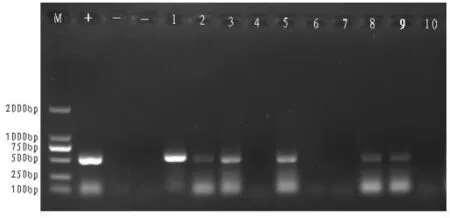
图4 转pBI-CHSi质粒抗性植株的PCR检测Fig.4 PCR analysis of regeneration plants
3 结 论
本实验在实验室已有的研究基础上,确定了紫叶酢浆草利用农杆菌叶盘法转化的最佳遗传转化体系:预培养培养基 M1:MS+NAA0.5mg/L+6-BA1.5mg/L;预培养时间为3d;侵染时间为7min;共培养时间为2~3 d;筛选培养基:MS+NAA 0.5 mg/L+6-BA 1.5 mg/L km30 mg/L+Amo100 mg/L;卡纳筛选浓度为30 mg/L,除菌剂为Amo100 mg/L,25℃光照培养。
在此条件下,观察到转基因植株生长势较弱,生长缓慢,比正常植株生长要迟缓半个月左右。经分析认为由于转入的是查儿酮合成酶RNAi,查儿酮合成酶基因是色素形成的关键基因,对其基因的干扰不仅在花色形成上产生影响,对其光合作用也可能产生影响,如果实验顺利,我们对其功能的变化进行进一步研究。本研究紫叶酢浆草转化率为31.67%,转化率偏低,且有褐化现象。今后将对于农杆菌侵染时间及如何提高紫叶酢浆草的转化率,降低褐化进行进一步的探讨及实验。
[1]付慧娟,徐婷.紫叶酢浆草体细胞无性系建立的研究[A].中国观赏园艺研究进展[C].北京:中国林业出版,2008:241-244.
[2]胡国富,李凤兰,胡宝忠,等.三角紫叶酢浆草的组织培养[J],北方园艺,2008(6):176-178.
[3]曲静,王丕,杨金慧.农杆菌介导紫花苜蓿子叶遗传转化的影响因素研究[J],安徽农业科学,2009,37(22):10421-10423.
[4]王凯,车代弟,王金刚,等.百合遗传转化体系的建立[J].东北农业大学学报,2008,39(5):39-43.
[5]高莉萍,包满珠.优化农杆菌介导的月季遗传转化系统的研究[J].北京林业大学学报,2005,27(4):60-64.
[6]郑阳霞,黄彬城.农杆菌介导的洋桔梗遗传转化体系的建立[J].核农学报,2009,23(4):597-60.
[7]卢翠华,邸宏.马铃薯微型薯外植体遗传转化体系的优化[J].作物杂志,2009(1):31-34.
[8]王关林,方宏筠.植物基因工程[M].北京:科学出版社,2009:479-481.
