临界点的发现者——英国物理学家T◦安德鲁斯
2010-07-24曾铁
曾 铁
(上海市徐汇区社区学院,上海 200032)
1 生平简介
19世纪英国物理学家与化学家、北爱尔兰的贝尔法斯特女王学院(现为贝尔法斯特女王大学,又叫北爱尔兰女王大学,它是英国研究型大学“罗素大学联盟”成员,该联盟由牛津、剑桥等20所著名的大学组成.1845年,该校由维多利亚女王始建,是英国历史最悠久的10所大学之一)教授T◦安德鲁斯(Thomas Andrews),1813年12月19日生于贝尔法斯特,1885年11月26日故于贝尔法斯特,终年72岁.
T◦安德鲁斯先在英国格拉斯哥大学T◦汤姆森(1773~1852)化学实验室学习,这是英国第一个供化学教学用的实验室;后又到法国化学家、巴黎工科大学教授J.B.A.杜马(1800—1884)处学习化学和医学.T◦安德鲁斯早年行医,后从事热学、化学研究,1857~1859年研究臭氧问题等,并担任教学工作.1835年,安德鲁斯获爱丁堡大学医学博士学位.1845年,被任命为贝尔法斯特女王学院副院长,1849年任该校化学教授.1849年,当选为伦敦皇家学会会员,他也是爱丁堡皇家学会会员.
2 临界点的发现
T◦安德鲁斯主要研究气体液化和物质临界状态等问题,1861年起,他用近10年的时间,对气体相变问题做了一系列实验及研究,特别是二氧化碳.
1799年,法国人福克林实现了氨、二氧化硫等气体的液化.19世纪,学者D.L.凯纳发现“乙醚、酒精和水能在相当于该液体原有2~4倍的空间内全部化成气”;英国物理学家M.法拉第用冰冻的混合物使加压的气体降温,液化了气体硫化氢、氯化氢、氯(1823年,他将氯气液化,氯气液化点为-34.5℃)等;1835年,法国化学家狄劳里雅基于法拉第的方法,使用金属圆筒,利用压力液化二氧化碳等,这些都是安德鲁斯物态研究的先声.
安德鲁斯先用碳酸作为研究对象,对它加压和降温,到一定数值时他发现:液体与气体之间的分界线就变得越来越模糊……最后分界线消逝了.后来这个空间完全被一种均匀的流体占有.接着,他又对氨、一氧化二氮、盐酸等进行研究,发现当它们由液态变为气态,或由气态变为液态,都有这个结论:“物质的气态与液态可以通过一系列连续不断的变化而相互转化”.研究中,他发现二氧化碳液体沸腾时,压强低到可逐点测量,为此,他作出了完整的p-V图;随着温度的升高,平衡的二氧化碳气、液两相密度差逐渐减少,安德鲁斯在理论上对此作出了解释.安德鲁斯的实验不仅有新发现,他还就物质液、气两态间的关系给出了圆满说明,以前的有关疑难和看似矛盾的结果,在他的 p-V图上均有恰当的解释.安德鲁斯明确指出温度、压力都没超过临界点时可通过加压或降温使二氧化碳液化;他强调气体液化关键就是怎样把温度降到临界点以下.
1861年,俄国化学家德◦伊◦门捷列夫(1834~1907)研究不同温度下毛细现象时发现,有绝对沸点存在,高于此温度时液体不可能存在,基于此他已有了临界温度的认识.安德鲁斯对这类问题独立进行了全面、深入的研究,首先对气体的等温变化进行实验,获得了普适的理论结果.19世纪60年代初起,安德鲁斯基于1822年法国物理学家C.C.托尔的酒精气、液转变实验(托尔发现达到某温度时,酒精会完全变成气体,此时压强是119 atm)等,利用二氧化碳作为工作物质,长期、系统并认真地研究气、液转变问题.1863年,安德鲁斯用一下端开口的玻璃管将二氧化碳限制在水银面上,调节管中水银量以改变玻璃管上半部的容积;他将装有液态和气态二氧化碳的玻璃容器加热到88 F(30.92℃)时,液体和气体之间的分界面完全消失.他发现温度高于这个数值时,即使压力增大到300或400 atm,也不能使二氧化碳气液化.他把这个温度称为二氧化碳的临界温度,并设想每种气体都有自己的临界温度.1869年,通过一系列等温压缩实验,安德鲁斯获得了大量的二氧化碳在不同温度下等温压缩时气、液相变的实验数据.他发现在31℃附近时,二氧化碳液体和气体的差别消失了,此点即二氧化碳的“临界点”,有了此点,某物质的液体、气体的差别是相对的,就非绝对的.如是,他发现了临界现象[后来,人们又发现了一些临界现象,如临界乳光、体胀系数变大、比热出现尖峰、铁磁性消失(居里点)等]、临界温度和相图上气、液分相的临界点.
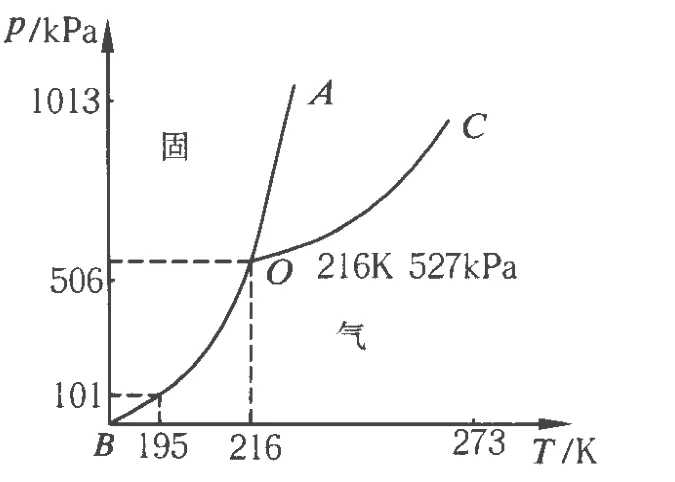
图1
图1是二氧化碳的相图(p-T图),OA是熔解曲线,OB是升华曲线,OC是汽化曲线,其下端起于三相点 O,上端延伸,OC线有无终点呢?这个问题让19世纪的一些物理学家困惑了约50年,安德鲁斯的研究则给出了正确答案.最后,他以《论物质气态与液态的连续性》为题,将研究成果发表在1869年的英国《哲学学报》上.安德鲁斯的实验及研究为后人认识分子力、研究物质相变和开展低温物理研究开辟了道路.安德鲁斯还提出液化“永久性气体”(对于氢、氧、氮、一氧化碳这些气体,直到19世纪60年代,科学家们已尝试各种手段,如压力加到2 790 atm,但都没能使它们液化.因此,这些气体曾被称为“永久性气体”,此名称沿用了25年)的失败,是由于它们的临界温度比迄今已获得的最低温度还要低得多.只要能获得更低的温度,它们也能被液化.所以,必须寻找获得更低温度的手段与方法.
1869年,安德鲁斯将一定量的二氧化碳充入汽缸,汽缸联有压强计测量气体压强,为使过程等温进行,汽缸放在恒温水槽内,缓慢移动活塞压缩二氧化碳,同时记录气体压强随体积的变化.他仔细观测了二氧化碳的等温压缩现象,从13℃开始等温压缩二氧化碳,再慢慢升温压缩,高于31.1℃时,等温压缩二氧化碳它就不再转变为液体,为此他弄清了气、液转变的规律,这有力地促进了气、液相变的理论研究.安德鲁斯用二氧化碳的比容 v代替体积V,取不同的温度值由低到高作了一系列等温压缩实验,在p-V图上作出等温压缩曲线簇.他提出二氧化碳临界压强概念(其数值为72.9 atm)以及临界比容、临界等温线与临界状态,并作出了完整的二氧化碳 p-V图(见图2),即安德鲁斯曲线,这是第1幅真实气体等温线图.由图2可知,在临界温度(31.1℃)以上,二氧化碳不能液化;温度越高,等温线越接近理想气体等温线.
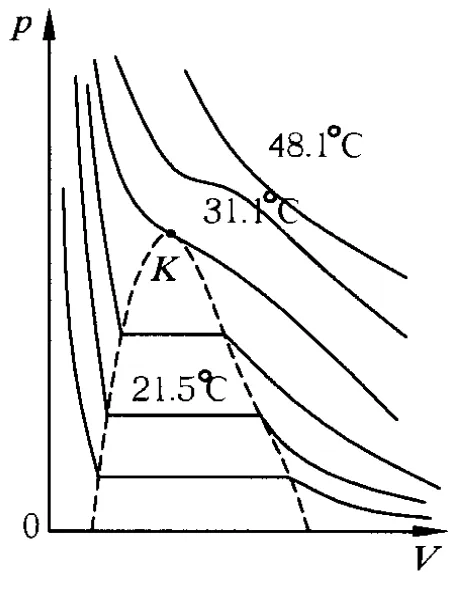
图2
实验表明,其他气体的等温线与二氧化碳的等温线有相似的形状,只不过临界温度不同罢了.安德鲁斯p-V图上曲线簇的形式与内涵,呈现了各种气体在不同温度下气、液转变过程的共性.临界温度以下,等温线出现平行于V轴的直线部分.将气体沿临界温度以下的某一等温线压缩,达到直线部分对应的压强时,气体就开始液化.继续压缩气体越来越少,凝结出的液体越来越多,到达直线的左端时,全部变为液体.如再压缩液体,等温线几乎平行于p轴上升.随着温度升高,直线部分越来越短,当温度升高到临界温度(汽化曲线上对应的温度点)时,直线部分变为一点K,气、液间分界面没有了,气、液二相的差别都消失了,此时物质的状态称为临界态.K点以右的各点都是气、液不分的状态,此时再问物质究竟处于气态,还是液态是没有意义的.由于临界点的存在,只要沿图2中虚线改变温度、压力,就可使物质从液态连续地变到气态而不经过任何相变点.
1869年,他在英国皇家学会作了题为《论物质液态和气态的连续性》的报告.报告描述了二氧化碳液化系列实验所观测到的气、液具有相同密度等现象.安德鲁斯也从其实验及研究推出,每种气体均有一个临界温度,高于此温度即使在高压下它也不能液化.他的这些思想与认识,给以后的研究者以较大启示.安德鲁斯还提出了固态和液态之间互相转化的问题,这也为研究者提出了一个有意义的课题,对物态方程和相平衡理论的发展有较大影响.安德鲁斯的上述观点后被荷兰物理学家J.D.范德瓦尔斯拓展,并建立了相关的理论(1881年,范氏提出了实际气体状态方程),因此,范德瓦尔斯获得了1910年的诺贝尔物理学奖.
1 于渌,郝柏林.相变和临界现象,北京:科学出版社,1999.
2 郭保章等.化学史简明教程.北京:北京师范大学出版社,1985.
3 张玉民.热学.北京:科学出版社,2000.
