糖尿病视网膜增殖膜应用抗VEGF因子后组织病理学观察
2010-07-21胡博杰刘新玲李筱荣宋文静
胡博杰 刘新玲 李筱荣 宋文静
增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)作为糖尿病严重并发症之一已成为糖尿病患者致盲的首位原因[1]。全视网膜光凝和玻璃体切割手术是治疗PDR的有效手段,由于增殖膜与视网膜粘连紧密,玻璃体切割术中剥膜时纤维血管膜出血,影响手术视野,增加手术时间,并且也是术后玻璃体腔复发性积血的主要原因之一[2]。目前研究表明眼内新生血管形成与血管内皮生长因子(vascular endothelial growth factor,VEGF)关系密切[3],该因子可特异性作用于血管内皮细胞,是导致眼内新生血管形成最为直接的因子。本研究通过观察应用抗VEGF因子后糖尿病视网膜增殖膜的组织病理学变化,探讨抗VEGF因子在糖尿病视网膜病变手术中的作用。
1 资料与方法
1.1 一般资料 选择2008年1月—6月在天津医科大学眼科中心拟行手术治疗的PDR患者24例(26眼),其中男13例,女 11 例,年龄 28~65 岁,平均(51.2±8.1)岁,平均血糖(9.69±2.33)mmol/L,均为 2 型糖尿病,发病时间 4~26 年,平均(11.48±5.72)年。本研究经天津医科大学医学伦理委员会批准,并在患者及家属签署知情同意书的前提下完成。
1.2 药品与试剂 Avastin(Genentech美国),HE染色用试剂购自北京中杉金桥公司。
1.3 研究分组 术前随机分为2组,对照组(13眼)直接行玻璃体切割术,研究组(13眼)于玻璃体腔内注射抗VEGF因子(Avastin)10 d后行玻璃体切割术。
1.4 手术方法 手术由同一位医师完成。常规三通道玻璃体切割手术,如晶状体混浊影响手术操作时,先行超声乳化术摘除晶状体,术中切除全部玻璃体,较厚及广泛的增殖膜则先从视盘表面挑起,逐步分离,自增殖膜下剪断与视网膜之间较粗的新生血管连接,当血管弓上形成的厚膜与视网膜紧密连接不能剥除时,尽量寻找膜之间的桥状连接,将膜切断切碎解除牵引,留下孤岛状的碎膜,用剥膜针挑起纤维血管性的视网膜前膜,用玻璃体剪剪除游离前膜,剪断与视网膜血管的联系,再用玻璃体镊取出,标本取出后立即放入10%福尔马林固定液固定。根据术中情况选择眼内气液交换,全视网膜光凝,硅油或气体填充,术毕,抗生素眼膏点眼,包扎。
1.5 标本制作方法 增殖膜常规脱水,浸蜡,石蜡包埋。制成2 μm厚的连续石蜡切片,常规HE染色,光学显微镜下观察,数码相机拍照。每个标本40倍光镜下随机抽取5个视野,分别计数视野中新生血管数目、血管内皮细胞数目及原始组织细胞数目,取其均值。
1.6 统计学方法 采用SPSS 11.0进行统计学处理,计量资料数据以均数±标准差表示,采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
光镜下观察糖尿病视网膜增殖膜由胶原等细胞外基质以及不同形态的细胞构成,有多个新生血管散在分布。根据细胞形态,可见大量的组织细胞及成纤维细胞样细胞,少量的血管内皮细胞和淋巴细胞。
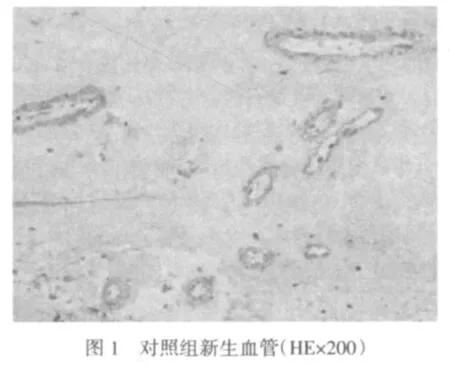
对照组增殖膜表面可见大量新生血管芽,膜内新生血管的构成多由数层内皮细胞围绕而成,为较规则圆形,细胞核较大、淡染,核质较疏松,部分细胞尚可见深染核仁,见图1。研究组增殖膜中,基质成分明显增多,新生血管形状不规则,多由1个或几个单层血管内皮细胞围绕而成,内皮细胞细长形,核椭圆较小,深染无核仁,见图2。研究组增殖膜中还可见大量异物巨细胞包绕的类圆形结构,中央为均质淡染,周围围绕大量异物巨细胞,胞浆相互融合,核大呈椭圆形,淡染,部分可见核仁,见图3。
研究组的新生血管数目、血管内皮细胞数目及原始组织细胞数目均低于对照组,差异有统计学意义(P < 0.05),见表 1。

表1 研究组和对照组各观察指标比较 (个,±s)
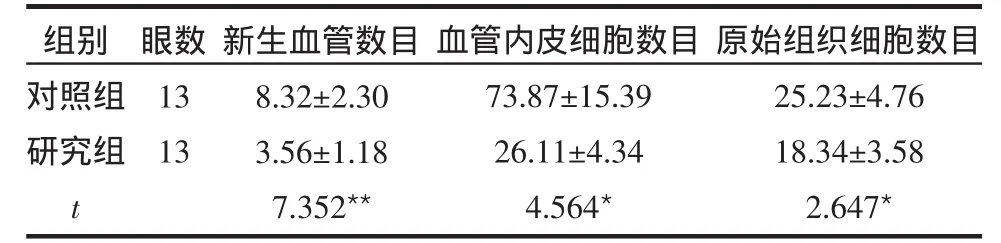
表1 研究组和对照组各观察指标比较 (个,±s)
觹P < 0.05,觹觹P < 0.01
?
3 讨论
VEGF是血管内皮细胞的多肽类生长因子,在血管生成过程中起中心调控的作用,被公认为新生血管发生的最关键细胞启动因子[4]。研究证明,PDR患者眼内VEGF水平显著增高,能导致视网膜新生血管形成,从而引发一系列严重的眼内病理改变[5]。抗血管内皮生长因子制剂Bevacizumab,即Avastin,是近年来出现的一种新型血管生成靶向性治疗药物[6]。作为一种新型的重组人源化单克隆抗体,Avastin可与VEGF的受体结合,抑制VEGF的生物活性,从而抑制新生血管的生成[7]。美国芝加哥召开的第15届美国眼科学会(AAO)年会首次报道针对新生血管性眼病进行玻璃体腔注射Bevacizumab,研究显示,注射后可以产生快速的生物学效应,新生血管在短期内明显减少,同时该药具有较好的耐受性且无明显的不良反应[8]。
Yeh等[9]研究表明在糖尿病视网膜病变手术中注射Avastin后增殖膜的新生血管减退或消失,出血减少,加速手术的进程,同时术后再出血的情况也减少。本研究中的组织病理切片可见,注射Avastin后的增殖膜中新生血管多由1~2个或几个单层血管内皮细胞围绕而成,内皮细胞细长形,核椭圆较小,深染无核仁,表明新生血管明显减退萎缩,与临床观察相符。同时还观察到注射Avastin后的增殖膜中有大量异物巨细胞包绕的类圆形结构,考虑可能是因机体将注射的Avastin视为异物,产生的包裹异物炎症反应所致。这也提示虽然Avastin已经在国内外临床中有广泛的应用,且取得相当的治疗效果,但是仍可能存在一定的炎症反应,导致严重后果,值得临床关注。
笔者发现注射Avastin后的增殖膜中基质成分明显增多的同时,膜中纤维组织也有增加,在临床中也观察到注射Avastin后在新生血管减少的同时,增殖膜的数量和范围有增加的趋势,提示Avastin可能在抑制VEGF水平的同时也使眼内其他因子水平发生变化,导致增殖膜的纤维化程度加强,有待进一步研究。
[1]高立新,张薇.增殖性糖尿病视网膜病变的玻璃体手术治疗[J].中国实用眼科杂志,2005,23(1):55-59.
[2] 姜燕荣,陶勇,黎晓新,等.玻璃体手术治疗增生型糖尿病视网膜病变544眼疗效分析[J].中国糖尿病杂志,2007,15(7):392-394.
[3] Iliev ME,Domig D,Wolf-Schnurrbursch U,et al.Intravitreal bevacizumab(Avastin)in the treatment of neovascular glaucoma[J].Am J Ophthalmol,2006,142(6):1054-1056.
[4] Yi WH,Wei RL,Cai JP,et al.The exp ression and significance of VEGF and TGF2β1 in orbital cavernous hemangiona[J].Int J Ophthalmol 2004,4(2):247-249.
[5] Avery RL,Pearlman J,Pieramici DJ,et al.Intravitreal bevacizumab(Avastin)in the treatment of proliferative diabetic retinopathy[J].Ophthalmology,2006,113(10):1695-1705.
[6] Cohen AF,Van Bronswijk H.New medications:bevacizumab[J].Ned Tijdschr Geneeskd,2006,150(40):2194-2195.
[7] Garg S,Brod R,Kim D,et al.Retinal pigment epithelial tears after intravitreal bevacizumab injection for exudative age-related macular degeneration [J].Clin Experiment Ophthalmol,2008,36(3):252-256.
[8] Nguyen QD,Shah SM,Hafiz G,et al.A phase I trial of an IV-administered vascular endothelial growth factor trap for treatment in patients with choroidal neovascularization due to age-related macular degeneration[J].Ophthalmology,2006,113(9):1522.e1-1522.e14.
[9] Yeh PT,Yang CM,Lin YC,et al.Bevacizumab pretreatment in vitrectomy with silicone oil for severe diabetic retinopathy[J].Retina,2009,29(6):768-774.
