微波辅助萃取-分光光度法测定加拿大一枝黄花中总黄酮
2010-07-12曲有乐于春光杨立业
曲有乐,于春光,王 斌,杨立业
(1.浙江海洋学院食品与药学学院、医学院,浙江舟山 316004;2.佳木斯大学化学与药学院,黑龙江佳木斯 154007)
加拿大一枝黄花Solidago canadensis L为菊科Compositae一枝黄花属Solidago植物,原产北美,为《欧洲药典》收录传统药用植物,应用于糖尿病、慢性肾病、风湿病、尿结石、泌尿疾病和消炎镇痛治疗[1]。近年来,本种在我国华东、华北、华南等地大面积爆发性生长,对我国的生态环境构成了严重威胁[2,3]。已有的研究表明,加拿大一枝黄花富含黄酮、多炔、萜类、皂苷等成分[4-8],特别是总黄酮含量高达11%[9]。黄酮类成分能有效减轻细胞的过氧化胁迫,阻止低密度脂质的过氧化,预防和治疗多种疾病[10,11]。如能以加拿大一枝黄花为原料,进行黄酮类成分的开发,即可变废为宝,又可有效地控制其蔓延。但是,目前未见加拿大一枝黄花总黄酮提取工艺的报道。
与传统的索氏提取法、超声波提取法和浸提法比较,微波辅助萃取技术利用微波对细胞的破壁作用和加热作用,可使细胞内有效成分快速溶出,具有操作简便、经济可靠、重现性好等特点,在中药活性成分,特别是黄酮类成分的提取中得到了较多的应用[12]。
为此,本实验采用微波辅助萃取-分光光度法进行拿大一枝黄花总黄酮的提取和分析,并对其不同部位的总黄酮进行比较,结果表明该法快捷、易控,将为加拿大一枝黄花资源的合理利用提供一定的技术支持。
1 材料与方法
1.1 实验材料
实验用加拿大一枝黄花于2008年10月盛花期采自浙江省舟山市定海区郊区,粉碎、过60目筛得药材粉末待用。标本存放于浙江海洋学院食品与药学学院生药学实验室。
1.2 仪器与试剂
XH-100A型微波催化合成萃取仪(北京祥鸽科技发展有限公司);722型可见光分光光度计(上海精密科技有限公司);SK5200H超声波清洗器(上海科技超声仪器有限公司生产);HWS12型电热恒温水浴锅(上海一恒科技仪器有限公司);高速万能粉碎机(天津市泰斯特仪器有限公司)。
芦丁(中国药品生物制品检定所提供);乙醇、亚硝酸钠、硝酸铝、氢氧化钠、石油醚均为分析纯,实验用水为去离子水。
1.3 实验方法
1.3.1 样品的处理
准确称取5 g样品于四颈烧瓶中,按要求加入一定量的乙醇,控制一定醇浓度,在一定的微波功率下微波萃取一定时间,抽滤,定容,取一定量萃取液进行显色、测定。
1.3.2 总黄酮含量的测定[13,14]
取少量萃取液加入到10 mL容量瓶中,依次加入若干毫升的NaNO2溶液、Al(NO3)3溶液和NaOH溶液后,用乙醇溶液定容至10 mL,于室温下放置10 min。用1 cm比色皿,以试剂空白为参比,在选定波长下测定其吸光度。根据标准曲线求得总黄酮的提取率,其计算公式为:
总黄酮的提取率 =(c×V·M-1)×100%
其中c为溶液中芦丁的浓度(μg/mL),V为萃取液总体积,M为加拿大一枝黄花的质量。
2 结果与讨论
2.1 测定波长的选择
取适量总黄酮萃取液进行显色反应,用分光光度计对其产物在400~700 nm之间扫描,在510 nm处有最大吸收,所以确定510 nm为测定波长。
2.2 标准曲线的建立
精确称取芦丁标准品 10 mg,用 60%乙醇溶液定容至 100 mL,4 ℃冷藏。分别取 0、1.0、2.0、3.0、4.0、5.0 mL标准液于10 mL容量瓶中,加入60%乙醇溶液稀释成5.0 mL。加入5%NaNO2溶液0.3 mL,摇匀,放置6 min;再加入10%的 Al(NO3)3溶液 0.3 mL,摇匀,放置6 min;加4%的NaOH溶液2.0 mL,用水稀释至刻度,放置10 min,在分光光度计上,以试剂空白为参比于510 nm处测其吸光度,得到回归方程为 A=0.844 c+0.006 1(r=0.999 4),式中 A为吸光度,c为溶液中芦丁的浓度(μg/mL),该方程在所测范围内(10~50 μg/mL)线性关系良好。
2.3 微波辅助萃取法的单因素试验
2.3.1 液固比对黄酮提取率的影响
在其他条件相同时,考察了不同液固比微波萃取加拿大一枝黄花中黄酮类物质提取率的影响,结果如图1所示。图1结果表明提取率随着液固比的增大而呈上升趋势,但增大到一定程度后就趋于下降,实验中选择液固比为30∶1~50∶1。
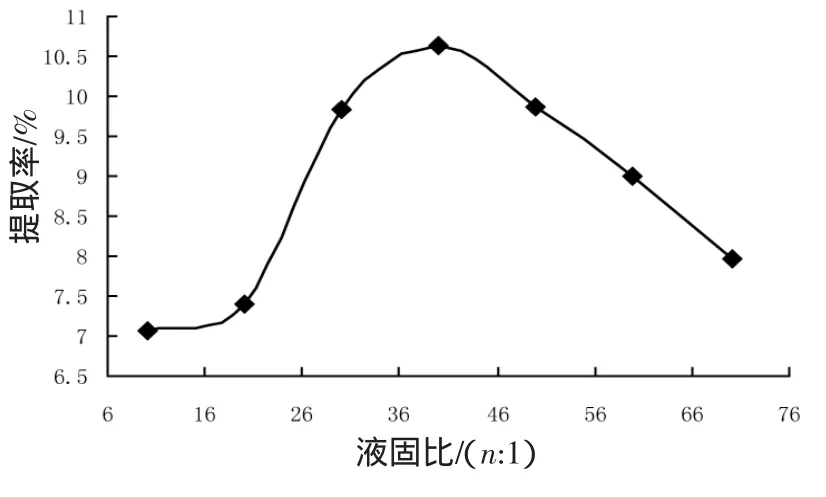
图1 液固比对黄酮提取率的影响Fig.1 Effect of ratio of solution to solid on extraction yield
2.3.2 乙醇浓度对黄酮提取率的影响
本文用乙醇溶液作为提取体系,考察了乙醇浓度对微波萃取加拿大一枝黄花中黄酮类物质提取率的影响,结果如图2所示。图2结果表明黄酮提取率随着乙醇浓度的升高而增加。因此考虑选50%~70%乙醇作提取剂为宜。
2.3.3 微波功率对黄酮提取率的影响
在其他条件相同时,考察了微波功率对微波萃取加拿大一枝黄花中黄酮类物质提取率的影响,结果如图3所示。图3结果表明提取率随微波辐射功率的增加而呈现先增加后下降的趋势。因此实验中微波功率最好控在500~700 W之间。
2.3.4 微波辅助提取时间对黄酮提取率的影响

图2 乙醇浓度对黄酮提取率的影响Fig.2 Effect of concentration of ethanol on extraction yield
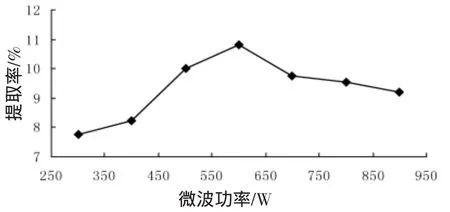
图3 微波功率对黄酮提取率的影响Fig.3 Effect of microwave power on extraction yield
在其他条件相同时,考察了微波辅助提取时间对微波萃取加拿大一枝黄花中黄酮类物质提取率的影响,结果如图4所示。图4结果表明提取率随微波辐射时间的增加而呈现先增加后下降的趋势。从时间效益考虑,微波时间应控制在10~20 min。

图4 微波辅助提取时间对黄酮提取率的影响Fig.4 Effect of microwave time on extraction yield
2.4 正交实验确定微波辅助提取的最佳条件
以上讨论了各单因素的影响,但在实际操作中,各因素之间相互交叉影响。因此,为了全面考察影响因素,选择L9(34)正交表,以微波功率、乙醇浓度、微波时间、液固比为4因素,做3水平的正交实验,结果见表1。
由表1可知:计算分析所得的最佳提取条件为A3B3C1D2。即在样品中加入50%乙醇溶液,控制液固比为40∶1,在700 W微波功率下微波辐射20 min。极差值反映的因子影响顺序为 D(液固比)> A(微波功率)> C(乙醇浓度)>B(微波时间),即乙醇浓度对提取率的影响最大。

表1 正交实验确定微波辅助提取的最佳条件Tab.1 Effects of different microwave extraction factors on the extraction yield of total flavones
2.5 最佳条件下的重现性和回收率实验
2.5.1 重现性实验
取同一批加拿大一枝黄花样品5份,在最佳条件下进行萃取,分别测定各自的总黄酮含量,结果表明其相对标准偏差为1.68%。
2.5.2 加入回收率实验
准确称取一定量样品3份,加入不同量的芦丁对照品溶液在微波条件下进行萃取,萃取物按实验方法进行显色,测定吸光度,计算回收率,结果表明回收率在97.6%~101.0%之间,说明此方法有较好的准确度。
2.6 加拿大一枝黄花各部位黄酮类化合物含量的比较
采用最佳提取工艺对一枝黄花根、茎、叶、花4个部位黄酮类化合物的含量进行比较,结果见表2。由表2可知,黄酮含量顺序为叶>花>根>茎;与一枝黄花地上部分比较发现,加拿大一枝黄花地上部分黄酮含量明显高于地下部分。

表2 加拿大一枝黄花各部位黄酮类化合物含量的比较Tab.2 Analytical results of the position
2.7 提取方法对黄酮提取率的影响
取同一批样品4份,根据最佳提取条件分别进行微波辅助萃取,超声提取,索氏提取,用分光光度法测定3种提取方法的提取率,结果见表3。由表3可知:微波辅助萃取法的提取效率高于其他两种方法,且既节省时间,又节省试剂。
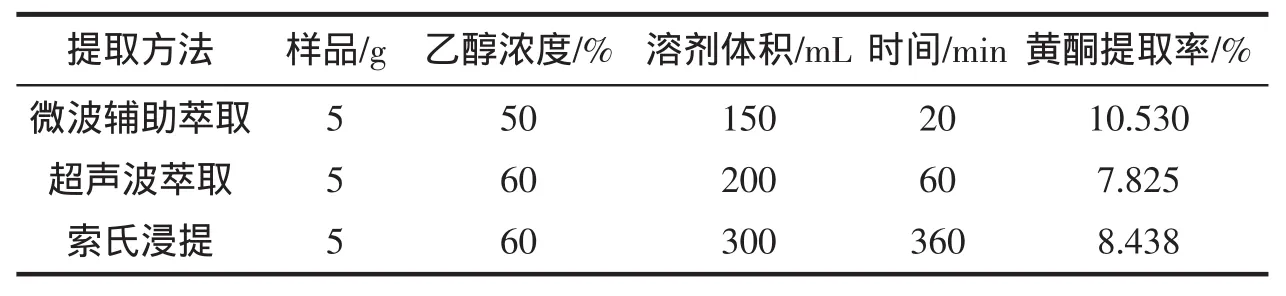
表3 提取方法对黄酮提取率的影响Tab.3 Analytical results of the samples
3 结论
本文主要对微波辅助萃取法萃取加拿大一枝黄花中总黄酮进行了初步研究,由重现性实验和加入回收实验的结果可以看出,本实验建立的萃取方法和测定方法可靠、准确、简便。微波辅助萃取、超声波萃取与索氏提取法的比较表明,微波辅助萃取法具有快速、提取率高、溶剂用量少等特点,适用于传统中草药中黄酮类物质含量的测定。
[1]ARNELL E.Botanic medicines for the urinary tract[J].World J Urol,2002,20(5):285-293.
[2]吴海荣,强 胜.加拿大一枝黄花生物生态学特性及防治[J].杂草科学,2005(1):52-56.
[3]李振宇,解 炎.中国外来入侵种[M].北京:中国林业出版社,2002:170.
[4]BOHLMANN F,FRITZ U,KING R M,et al.Sesquiterpene and diterpene derivatives from Solidago species[J].Phytochemistry,1980,19(12):2 655-2 661.
[5]REZNICEK G,JURENITSCH J,PLUSON M,et al.Four major saponins from Solidago Canadensis[J].Phytochemistry,1991,30(5):1 629-1 633.
[6]LU T,MENELAOU M A,VARGAS D,et al.Polyacetylenes and diterpenes from Solidago canadensis[J].Phytochemistry,1993,32(6):1 483-1 488.
[7]CHATURVEDULA P V S,ZHOU B N,GAO Z J,et al.New lupane trierpenoids from Solidago canadensis that inhibit the lyase activity of DNA polymeraseβ[J].Bioorganic&Medicinal Chemistry Letters,2004,12(23):6 271-6 275.
[8]王开金,陈列忠,李 宁,等.加拿大一枝黄花黄酮类成分及抗氧化与自由基消除活性的研究[J].中国药学杂志,2006,41(7):493-497.
[9]左 坚,纪从兰.比色法测定国产加拿大一枝黄花中总黄酮含量[J].亚太传统医药,2006(3):71-73.
[10]TIJBURGL B,MATTERN T,FOLTSJ D,et al.Tea flavonoids and cardiovascular diseases:a review[J].Critical Reviews in Food Science and Nutrition,1997,37(8):771-774.
[11]PIETTA P G.Flavonoids as antioxidants[J].Journal of Natural Products,2000,63(7):1 035-1 042.
[12]张 帆,周 峰,王桂花,等.微波辅助萃取-分光光度法测定卫矛中总黄酮[J].光谱学与光谱分析,2008,28(7):1 633-1 636.
