水产抗氧化肽研究进展
2010-07-12谢宁宁陈小娥方旭波
谢宁宁,陈小娥,方旭波,余 辉
(浙江海洋学院食品与药学院、医学院,浙江舟山 316004)
近年来,抗氧化剂在国内外发展很快,用途也越来越广。1956年HARMAN[1]提出了衰老的自由基理论(free radical theory of aging)之后,越来越多的人认识到人体内氧化产生的自由基与人的衰老和许多疾病有关。因此,许多抗氧化剂被用作功能因子开发,应用于保健食品及医药等行业。另外,抗氧化剂能延缓含脂肪食物的腐败变质,它也被运用于食品保鲜储藏工业。
抗氧化剂的种类很多,其中已经被广泛使用的多为化学合成类抗氧化剂,由于其具有毒、副作用,各国政府纷纷对其强制规定了ADI值,控制其添加量[2]。1991年PROKORNY[3]提出,一些抗氧化肽和蛋白水解产物能降低自动氧化速率和脂肪的过氧化物含量,之后,寻找和制备高活性的蛋白源抗氧化剂,成为新的研究焦点。
在水产品加工工业中,不可避免地产生了许多废弃低值蛋白,采用生物酶工程和发酵工程等手段,它们可以作为制备抗氧化肽的优良备选原料。同时,开发利用水产副产物中蛋白资源,有利于提高水产品的经济附加值,降低环境污染。已经有许多研究者从多种水产品中制备出具有抗氧化性的活性肽,本文将针对这方面的研究与进展进行综述。
1 氧化作用的危害及防治
很多证据显示,活性氧(ROS)和自由基在许多退行性疾病如癌症、动脉硬化及糖尿病等中起重要作用[4],它们的形成是呼吸过程中不可避免的。这些自由基非常地不稳定,它们能迅速地同机体中的其它基团或物质发生反应,导致细胞或组织的氧化损伤。生物机体依靠多种由酶系(SOD、GSH-Px、CAT、GST等)和非酶系(葡萄糖、维生素、氨基酸类等)物质组成的抗氧化体系,对抗活性氧及自由基。但是,这些防御体系并不能阻止所有氧化损伤。生物体通过补充含有抗氧化物质的成分,可以有效地减少氧化损伤对机体的危害。同样,在食品工业中,由于脂质过氧化,导致食品产生异味、发臭和潜在的毒性物质等不良后果,容易造成不少经济损失[5]。通过在食品中添加抗氧化剂,可以有效地对抗脂质过氧化,防止食物腐败变质,避免浪费。
2 水产品抗氧化肽的原料
许多研究者对鱼类、甲壳类、软体动物进行了抗氧化活性的研究。AMAROWICZ和SHAHIDI[6]通过分离毛鳞鱼Mallotus villosus蛋白水解液,得到一种在β-胡萝卜素-亚油酸模型体系内具有稳定抗氧化活性的组分。SACHINDRA和BHASKAR[7]采用乳酸发酵虾Penaeus mondon的废弃物,制得的产物含有低分子量的蛋白类物质,并且其具有清除多种自由基和促灭单线态氧形成的作用。BINSAN等[8]以不同比例混合的去离子水和乙醇为介质,对白虾Litopenaeus vannamei头胸部提取出的抗氧化肽的活性和稳定性进行了研究。QIAN等[9]通过消化牡蛎Crassostrea gigas蛋白,获得一种由13个氨基酸残基组成的抗氧化肽段。
3 水产品抗氧化肽的制备
3.1 制备方法
3.1.1 蛋白酶水解法
通过酶水解蛋白制备抗氧化肽是目前普遍采用的一种方法。酶促水解反应具有条件温和、易于控制,专一性较强、副反应产物少等优点。目前报道中许多水产品抗氧化肽的制备就是采用蛋白酶水解的方法。其中,由于底物的不同,制备抗氧化肽所选用的蛋白酶也不同。表1列举了部分研究者制备水产品抗氧化肽所选用的酶。

表1 制备水产抗氧化肽选择用酶Tab.1 The selection of proteolytic enzymes to prepare aquatic antioxidant peptides
另外,除采用外源蛋白酶外,有学者利用鱼类含有的内源性蛋白酶,制备出水产抗氧化肽。SAMARANAYAKA和CHAN[19]利用太平洋鳕鱼Merluccius productus肉中感染寄生虫Kudoa paniformis产生的蛋白酶水解活性,制备鳕鱼肉抗氧化肽,其中E-1h FPH组分在亚油酸自氧化体系中的抗氧化活性高于BHA和α-生育酚。JE等[20]采用自制的“鲐鱼肠天然酶(MICE)”水解狭鳕Theragra chalcogramma鱼排蛋白,鱼排蛋白水解产物(APH)被分成5种分子量大小不同的组分,其中分子量最小的APH-V组分具有最高的抗氧化活性,通过纯化之后的多肽样品浓度为53.6 μmol/L时,羟自由基清除率为35%。
3.1.2 发酵法
许多水产品经发酵后,在微生物和内源酶的作用下,有机物质转变成了小分子物质如肽类、氨基酸类和其它含氮化合物。其中的多肽和氨基酸不仅对发酵产物的风味起重要贡献,而且对产品的抗氧化功效起到贡献作用。发酵法与酶解法相比,能将微生物产酶和酶水解两步合一,省去酶的分离和提纯步骤,减少生产工序,降低成本。
RAJAPAKSE等[21]通过分离纯化紫贻贝Mytilus edulis发酵液,制备出具有重复序列“HFGBPFH”的多肽,经检测其具有较高的自由基清除能力、Fe2+螯合能力及提高氧化损伤细胞成活率的作用。PERALTA等[22]研究了菲律宾传统食盐发酵的虾Acetes spp酱的抗氧化性,结果证明通过适当延长发酵时间,在有效地增加自由氨基酸含量的同时,也提高了虾酱的抗氧化能力。
3.2 分离纯化及结构鉴定
从目前报道的水产品抗氧化肽来看,分子量多集中在1 000 Da左右,氨基酸残基的数目一般在20个以内,而且,在抗氧化肽粗品中,肽的种类较多,活性肽组分对外界环境条件也比较敏感,因此,分离纯化较困难,通常采用单一的分离纯化手段不能达到理想的分离效果。目前,普遍采用多种分离技术联用的手段。一般的分离纯化流程如图1所示。
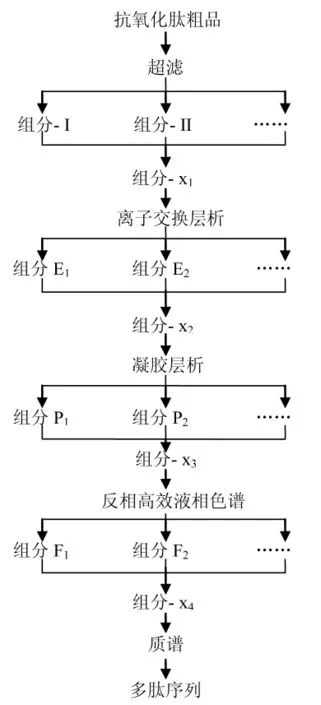
图1 分离纯化流程图Fig.1 The flow chart of isolation and purification
超滤(UF)是膜分离技术的一种,实践证明膜技术具有耗能低、设备小、操作管理方便和质量好等优点。近年来,超滤技术已经被应用于水产品抗氧化肽的分离纯化。MENDIS等[13]采用10 kDa,5 kDa和3 kDa 3种膜截留鱿鱼皮明胶水解产物,初步筛选出小于3 kDa分子量的抗氧化活性最强组分。
离子交换色谱(IEC)是多肽分离纯化过程中经常采用的方法,它是以离子交换剂为固定相,根据流动相中组分离子与交换剂上平衡离子进行可逆交换时,结合力大小差异而进行分离的一种层析方法。很多的研究者采用SP-Sephadex C-25阳离子交换色谱分离水产品抗氧化活性组分。如狭鳕Theragra chalcogramma鱼排[20]、巨鱿鱼Dosidicus gigas肉[14]超滤活性组分等。
凝胶层析(GC)又称凝胶排阻色谱、分子筛层析和凝胶过滤等,是利用分子大小和形状差异进行分离的一种温和、高效的方法。Sephadex G-25凝胶柱层析是分离小分子量水产抗氧化肽采用的最多的一种,如乳酸发酵虾Penaeus mondon废弃物[7]。另外,有学者采用Superdex Peptide10/300 GL凝胶柱纯化牛蛙Rana catesbeiana Shaw[12]皮和草鱼Ctenopharyngodon idellus[15]水解物。
为了获得活性最高的多肽纯化物,通常采用高效液相色谱(HPLC)法进行分离纯化验证。高效液相色谱是近年来肽的分离纯化中广泛应用的技术,主要用于10 kDa以下的极性小分子肽的分离纯化。RAJAPAKSE等[21]采用nucleosil 100-7 C18 HPLC柱和Zorbax SB C18 HPLC柱两步分离,制得962 Da的活性最高抗氧化肽纯品。KIM等[16]将离子交换层析后的活性最高组分进一步经HPLC分离,分别采用了1次Capcell Pak C18UG-120柱和2次Synchropak RPP-100 RP-HPLC analytical柱,制得抗氧化肽纯品。对最终制得的高纯度抗氧化肽,通常采用质谱(CM)进行分子量的测定,推测其氨基酸序列。
4 水产抗氧化肽活性评估方法
评估水产抗氧化肽的活性,一般采用自由基清除能力、抗脂质自氧化能力、金属离子螯合能力、协同抗氧化能力等多种评价方法进行体外活性实验评估。经筛选出的具有抗氧化活性的物质可通过体内试验进一步检验评估。
4.1 清除自由基
自由基是指一类可以独立存在的含有未配对电子的物质,包括分子、原子、原子团或离子。主要包括超氧阴离子(O2-·)、过氧化氢(H2O2)、羟自由基(OH·)、单线态氧(1O2)等,这些自由基具有不稳定性和高反应性。抗氧化剂可以有效地将泄漏出来的、多余的活性氧等清除掉,从而保护细胞、组织免遭氧化损伤。
目前抗氧化肽的自由基清除效果,普遍采用自由基清除率来表示。二苯代苦味酰肼自由基 (1,1-diphenyl-2-picrylhydrazyl,简称DPPH)是一种较稳定的自由基。当有自由基清除剂存在时,DPPH自由基的单电子被分配而使其颜色变浅,利用分光光度法可以检测自由基清除情况,从而评价样品抗氧化能力。羟自由基是化学性质最活泼的活性氧自由基,它带有1个不成对的电子,是对人体毒性最大的自由基,它反应速度极快,可以与活细胞中的大分子如蛋白和DNA发生反应而造成损害[23]。因此,较多的研究者选用以上2种自由基的清除率来评估水产蛋白水解产物的抗氧化性。
除此之外,超氧阴离子自由基[24]、过氧化氢自由基[25]等的清除率也被一些学者作为综合评价水产多肽抗氧化能力的选择方法。
4.2 抑制脂质自氧化
脂类的自氧化是造成食品质量下降最主要的化学因素之一。尤其是富含不饱和脂肪酸的食品,很容易氧化生成过氧化脂质,再经过分解、聚合等反应产生腐败直至出现毒性。另一方面,在生物体内,癌症的发生以及衰老也都与体内脂肪的氧化有关。因此,脂类常作为被氧化的底物用来检测样品的抗氧化能力。
水产抗氧化肽抑制脂质自氧化的效果,一般采用以亚油酸为氧化底物的亚油酸模型系统。亚油酸通过吸收空气中的氧进行自动氧化反应,产生脂肪酸氢过氧化物。水产抗氧化肽的添加,可以抑制自氧化反应。通过比较两种情况下的氢过氧化物的含量,来评估抑制脂类自氧化的效果。很多报道均采用硫氰酸铁法[26]检测氢过氧化物的含量。该法的原理是亚铁离子可被氢过氧化物氧化成高铁离子,其反应为Fe2++2H++O→Fe3++H2O,然后加入硫氰酸铵与Fe3+形成红色的络合物,其在540 nm处有强吸收值,通过比色即可测出氢过氧化物的含量。
4.3 金属离子螯合能力
过渡态金属离子如Fe2+和Cu2+能催化不饱和脂质氧化过程中自由基的形成[27],而水解产生的多肽的羧酸基团和氨基基团具有金属离子螯合能力,因此,能够削弱脂质的氧化。由于水解过程中多肽的断裂,导致了肽片段浓度的增加,从而有助于清除羟自由基中的金属离子,产生抗氧化性。
DONG等[10]研究了鲢鱼蛋白水解物的金属离子螯合活性。随着水解时间的增加,水解产物的螯合活性增强。其中,在任何时间段时,碱性蛋白酶的水解产物的活性均比风味蛋白酶高。经碱性蛋白酶水解6 h的水解物的金属离子螯合活性最高,达92.97%。并且螯合活性和水解度(DH)之间存在线性关系。结果证明低分子量的水解产物具有较高的金属离子螯合活性。
4.4 协同抗氧化性
在水产品水解物中也有协同抗氧化活性肽的报道。这类抗氧化肽本身的抗氧化能力比较低,但是在与其它一些抗氧化剂同时使用时,具有很强的抗氧化效果。JE等[20]研究了狭鳕鱼排的水解产物,经超滤膜过滤后的5种组分中,仅APH-Ι无协同抗氧化性,其它组分在亚油酸模型系统中均具有同α-生育酚的协同抗氧化性。
4.5 细胞损伤模型
最近几年,越来越多的研究者采用细胞损伤模型评估抗氧化活性。氧化作用在细胞的损伤死亡中扮演重要角色,通过添加抗氧化剂对抗细胞中产生的氧化作用,能够提高细胞的成活率。MENDIS等[13]通过建立人工培养的人类肺脏纤维细胞模型,采用MTT法,检测t-BHP介导的氧化损伤细胞的成活率,结果显示,在与天然抗氧化剂α-生育酚相比时,鱿鱼皮明胶多肽能显著提高细胞成活率。
4.6 体内实验
通过体内实验验证样品的抗氧化性,是活性评估中最重要的一环。通常将受试物连续饲喂大鼠或小鼠1-3月,然后处死,测定其血或组织(如肝、脑)中MDA、单胺氧化酶(MAO-B)及抗氧化酶SOD、谷胱甘肽过氧化物酶(GSH-Px)及过氧化氢酶(CAT),同对照组比较,若 MDV、MAO-B 降低,SOD、GSH-Px、CAT 等升高,则说明受试物具有抗氧化能力。
林琳和李八方[28]研究了具有清除自由基作用的鱿鱼多肽的体内抗氧化活性。采用D-半乳糖致衰的小鼠模型,结果表明分子量小于2 kDa的多肽组分,能够提高小鼠血液及皮肤中SOD和GSH-Px的活力,降低MDA含量,并提高小鼠皮肤中Hyp的含量。
5 影响水产抗氧化肽活性的因素
5.1 水解过程因素
通过水解制备出的抗氧化肽的活性与底物原料、酶的种类、酶解温度、酶解时间、酶的加入量、pH、以及酶解产物的水解度(DH)等许多因素有关。
KLOMPONG等[18]采用碱性蛋白酶和风味蛋白酶水解黄斑纹鲹鱼蛋白制得2种水解产物分别为HA和HF。采用不同的酶,活性宜有变化。当水解度增加时,HA的DPPH自由基清除活性和还原能力增强,HF并无此现象。HA和HF的金属离子螯合能力均随着水解度的增加而增强。并且,在相同的水解度时,HF的金属离子螯合能力通常比HA高。在低水解度(DH=5%)时,HA的DPPH自由基清除活性较好,同时,在高的水解度(DH=25%)时,HF的还原能力较好。也有研究者研究了碱性蛋白酶处理的鲢鱼蛋白水解产物,羟自由基清除活性和亚油酸过氧化抑制率分别在水解时间为1.5 h和2.0 h时达到最大值,证明鲢鱼水解蛋白抗氧化能力是与水解度和水解时间相关[10]。

表2 水产抗氧化肽的序列结构及分子量Tab.2 The peptide sequence and molecular weight of aquatic antioxidant peptides
5.2 肽的化学结构
抗氧化肽的功能特性较多地受分子结构和分子量的影响[29,30]。MURASE等[31]认为,抗氧化肽的疏水性增强了它的抗氧化性和乳化效果,并且,这类多肽在同非肽类抗氧化剂协同时具有比较强的协同效果。CHEN等[32]认为组氨酸含量较高的多肽,具有金属离子螯合作用。另外,一些其它的氨基酸,比如,组氨酸、脯氨酸、丙氨酸和亮氨酸,被报道对自由基清除有贡献作用[33]。SUETSUNA等[30]报道了亮氨酸出现在C端具有抗氧化性,并认为在多肽结构中芳香族氨基酸的酚羟基基团能够作为有效的电子供体。MENDISA等[13]报道了鱿鱼皮明胶抗氧化肽P1和P2的抗氧化性来源于序列中富含间隔的“亲水-疏水”序列,同时,由于分子量较低,P1比P2具有更高的抗氧化特性。表2为部分水产抗氧化肽的序列结构及分子量。
另外,除以上两方面外,抗氧化肽所处的pH、温度等外界条件同样影响活性的发挥。BISAN等[8]研究表明,白虾抗氧化肽,在pH 2~11,温度为25~100℃范围内,FARP、TBARS和DPPH 3种活性仍然高于80%。活性肽在100℃加热30 min时,3种活性稍微降低,30~120 min时,3种活性维持在80%左右,120~150 min时,DPPH活性稍微降低。
6 水产抗氧化肽研究展望
我国是水产品加工大国,每年都会产生大量的低值水产品下脚料蛋白资源,开发利用水产抗氧化肽将具有不菲的经济效益和社会意义。水产抗氧化肽能有效地清除体内的活性氧自由基,保护细胞和线粒体的正常结构和功能,同时防止食品脂质过氧化变质,在医药和食品领域具有广泛的应用前景。但水产抗氧化肽的研究中仍有不少问题需要解决。第一、有关抗氧化能力的测定方法很多,但是通用的方法很少,使得各种实验缺乏可比性,需统一抗氧化能力测定标准;第二、水产抗氧化肽单一组分和不同组分协同作用的机制等还有待深入研究;第三、有关水产抗氧化肽的活性研究大多缺乏临床试验,体内抗氧化机理还需要进一步深入研究;第四、对于水产抗氧化肽在浓缩干燥过程中的活性损失,还缺乏系统性的深入研究;第五、在抗氧化肽分离纯化的研究中,盐的存在一定程度上会影响抗氧化活性的测定,但是脱盐问题一直没能得到很好的解决;第六、目前的分离纯化手段很难纯化得到分子量很小、由2~3个氨基酸组成的肽段,这也是大多数研究报道所得到的抗氧化肽分子量都大于500 Da的原因之一。
[1]HARMAN D.Aging:a theory based on free radical and radiation chemistry[J].Journal of gerontology,1956,11(3):298-300.
[2]GB 2760-1996食品添加剂使用卫生标准[S].
[3]PROKORNY J.Natural antioxidants for food use[J].Trends Food Sci Technol,1991,2(9):223-227.
[4]BECKMAN K B,AMES B N.The free radical theory of aging matures[J].Physiological Reviews,1998,78(2):547-581.
[5]MAILLARD M N,SOUM M H,BOIVIN P,et al.Antioxidant activity of barley and malt:Relationship with phenolic content[J].Food Science and Technology,1996,29(3):238-244.
[6]AMAROWICZ R,SHAHIDI F.Antioxidant activity of peptide fractions of capelin protein hydrolysates[J].Food Chemistry,1997,58(4):355-359.
[7]SACHINDRA N M,BHASKAR N.In vitro antioxidant activity of liquor from fermented shrimp biowaste[J].Bioresour Technol,2008,99(18):9 013-9 016.
[8]BINSAN W,BENJAKUL S,VISESSANGUAN W,et al.Antioxidative activity of Mungoong,an extract paste,from the cephalothorax of white shrimp(Litopenaeus vannamei)[J].Food Chemistry,2008,106(1):185-193.
[9]QIAN Z J,JUNG W K,BYUN H G,et al.Protective effect of an antioxidative peptide purified from gastrointestinal digests of oyster,Crassostrea gigas against free radical induced DNA damage[J].Bioresource Technology,2008,99(9):3 365-3 371.
[10]DONG S Y,ZENG M Y,WANG D F,et al.Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp(Hypophthalmichthys molitrix)[J].Food Chemistry,2008,107(4):1 485-1 493.
[11]YANG J L,HO H Y,CHU Y J,et al.Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia(Rachycentron canadum)skin[J].Food Chemistry,2008,110(1):128-136.
[12]QIAN Z J,JUNG W K,KIM S K,et al.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin,Rana catesbeiana Shaw[J].Bioresource Technology,2008,99(6):1 690-1 698.
[13]MENDIS E,RAJAPAKSE N,BYUN H G,et al.Investigation of jumbo squid(Dosidicus gigas)skin gelatin peptides for their in vitro antioxidant effects[J].Life Sciences,2005,77(17):2 166-2 178.
[14]RAJAPAKSE N,MENDIS E,BYUN H,et al.Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J].The Journal of Nutritional Biochemistry,2005,16(9):562-569.
[15]REN J Y,ZHAO M M,SHI J,et al.Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electro spray ionization-mass spectrometry[J].Food Chemistry,2008,108(2):727-736.
[16]KIM S,JE J,KIM S.Purification and characterization of antioxidant peptide from hoki(Johnius belengerii)frame protein by gastrointestinal digestion[J].The Journal of Nutritional Biochemistry,2006,18(1):31-38.
[17]JE Y J,QIAN Z J,BYUN H G,et al.Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J].Process Biochemistry,2007,42(5):840-846.
[18]KLOMPONG V,BENJAKUL S,KANTACHOTE D,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroides leptolepis)as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1 317-1 327.
[19]SAMARANAYAKAA A G P,CHAN E C Y L.Autolysis-assisted production of fish protein hydrolysates with antioxidant properties from Pacific hake(Merluccius productus)[J].Food Chemistry,2008,107(2):768-776.
[20]JE J Y,PARK P J,KIM S K.Antioxidant activity of a peptide isolated from Alaska Pollack(Theragra chalcogramma)frame protein hydrolysate[J].Food Research International,2005,38(1):45-50.
[21]RAJAPAKSE N,MENDIS E,JUNG W K,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38(2):175-182.
[22]PERALTE E M,HATATE H,KAWABE D,et al.Improving antioxidant activity and nutritional components of Philippine saltfermented shrimp paste through prolonged fermentation[J].Food Chemistry,2008,111(1):72-77.
[23]CACCIUTTOLO M A,TRINH L,LUMPKIN J A,et al.Hyperoxia induces DNA damage in mammalian cells[J].Free Radic Biol Med,1993,14(3):267-276.
[24]GUO Q,ZHAO B,SHEN S,et al.ESR study on the structure-antioxidant activity relationship of tea catechins and their epimers[J].Biochimica et Biophysica Acta(BBA)-General Subjects,1999,1 427(1):13-23.
[25]HIRAMOTO K,JOHKOH H,SAKO K I,et al.DNA breaking activity of the carbon-centered radical generated from 2,2-azobis-(2-amidinopropane)-hydrochloride(AAPH)[J].Free Radic Res,1993,19(5):323-332.
[26]OSAWA T,NAMIKI M.Natural antioxidants isolated from eucalyptus leaf waxes[J].Journal of Agriculture and Food Chemistry,1985,33(3):777-780.
[27]STOHS S J,BAGEHI D.Oxidative mechanisms in the toxicity of metal ions[J].Free Radical Biology and Medicine,1995,18(2):321-336.
[28]林 琳,李八方.鱿鱼皮胶原蛋白水解肽抗氧化活性研究[J].中国海洋药物杂志,2006,25(4):48-51.
[29]JEON Y J,BYUN H G,KIM S K.Improvement of functional properties of cod frame protein hydrolysates using ultra filtration membranes[J].Process Biochemistry,1999,35(5):471-478.
[30]SUETSUNA K,UKEDA H,OCHI H.Isolation and characterization of free radical scavenging activities peptides derived from casein[J].Journal of Nutritional Biochemistry,2000,11(3):128-131.
[31]MURASE H,NAGAO A,TERAO J.Antioxidant and emulsifying activity of N-(long-chain-acyl)histidine and N-(longchainacyl)carmnosine[J].Journal of Agricultural and Food Chemistry,1993,41(3):1 601-1 604.
[32]CHEN H M,MURAMOTO K,YAMAUCHI F,et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1998,46(1):49-53.
[33]KIM S K,KIM Y T,BYUN H G,et al.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska Pollack skin[J].Journal of Agricultural and Food Chemistry,2001,49(4):1 984-1 989.
