一株产纤维素酶真菌的筛选和诱变
2010-07-09蒋琼凤张金金谢达平黄光文
蒋琼凤 ,张金金 ,周 斌 ,谢达平 ,黄光文
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.湖南科技学院生命科学与化学工程系,湖南 永州 425100)
纤维素是植物材料的主要成分,也是地球上最丰富的可再生资源,它曾被指望用于解决人类的食品、能量和环境问题,但目前这些生物量除了用于燃烧和造纸等以外很少有其它的用途[1]。将纤维素物质转变为糖、乙醇、甲烷等容易利用的小分子有机物是国际上重大课题之一[2]。国内外科研工作者已先后筛选和培育了许多产纤维素酶的菌种,其中木霉属菌株产生的纤维素酶活力较高。由于其粗酶制剂中含有较高活力的酶,因而成为当前生产上应用较多的菌种。但与淀粉酶和蛋白酶相比,其生产规模小,酶的活力也较低,酶解效率不高[3-4]。因此,筛选酶活力高且稳定的野生菌株,以及对筛选的菌株进行诱变处理提高其酶活力具有重要的现实意义。笔者拟从自然环境筛选具有较好产纤维素酶活力的野生菌株,诱变出酶活提高较大的菌株。
1 材料与方法
1.1 材料
1.1.1 土 样 菜地、造纸厂、枯木、竹林土、树林树叶土,牛粪、腐烂的谷壳和秸秆下的腐殖土,废弃蘑菇培养基、苗圃土。
1.1.2 试 剂 0.1 mol/L、pH值 4.8柠檬酸-柠檬酸钠缓冲液:称取柠檬酸21.014 g、柠檬酸钠29.412 g溶于500 mL去离子水中,待溶解之后定容至1 000 mL,再用pH计调节其pH值至4.8。
羧甲基纤维素钠(CMC-Na):称取10 g CMCNa 溶于 500 mL、pH 4.8(0.1 mol/L)柠檬酸-柠檬酸钠缓冲液中,待溶解之后用缓冲液定容至1 000 mL。DNS试剂的配制参考文献[5]。
1.1.3 培养基 (1)筛选培养基。NaNO33 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,CMC-Na 15 g,蒸馏水 1 L,pH 值 5.5~6.0,琼脂 15~20 g,2%去氧胆酸钠溶液 20 mL(预先灭菌,临用前加入),链霉素溶液(10 000 U/mL)3.3 mL(临用前加入)。(2)滤纸条培养基。参考文献[6]并稍加改动:无机盐液(KH2PO42 g,(NH4)2SO41.4 g,MgSO4·7H2O 0.3 g,CaCl20.3 g,FeSO4·7H2O 5 mg,MnSO41.6 mg,ZnSO41.7 mg,CoCl21.7 mg,吐温-80 1 mL,加蒸馏水定容到 1 L,pH 5.5~6.0。(3)固体发酵培养基。固体料(稻草粉∶麸皮∶豆粕粉∶玉米粉=4∶2∶2∶1),无机盐液同滤纸条培养基,固料∶无机盐液=1∶2.5。于250 mL的三角瓶中加入9 g固体料和22.5 mL上述无机盐液并用玻璃棒搅拌均匀,加棉塞121℃灭菌1 h。
1.2 方法
1.2.1 稻草纤维素的制备及滤纸的预处理 制备与预处理参考文献[7]进行。
1.2.2 菌种筛选 菌种初筛:菌种的分离纯化[8],待菌种纯化后再将纯种点种到初筛培养基于28℃培养4 d,用2 g/L的刚果红染色30 min,再用适量的1 mol/L NaCl脱色30 min,测量菌落和水解圈的直径并计算酶的相对比活力:A=水解圈直径/菌落直径。
菌种复筛:取斜面培养的孢子接入固体发酵三角瓶,28℃条件下培养2 d,扣瓶,发酵108 h左右取酶液测定其CMC酶活和FPA酶活。
1.2.3 酶液的制取 固体发酵培养基,向三角瓶固体曲加入一定量的双蒸水(按干曲重量加水10 mL/g)于室温、160 r/min振荡1~2 h,用双层纱布过滤,4 000 r/min离心15 min,上清液为粗酶液,适当稀释后测定还原糖浓度。固曲的换算[9]:取鲜曲5 g于105℃烘干,测定其含水量。
1.2.4 酶活力的测定 (1)羧甲基纤维素钠(CMC-Na)酶活力。以1%CMC-Na溶液为底物,在50℃,pH值4.8的条件下,1 h分解CMC-Na产生1 μmol葡萄糖所需的酶量,定义为一个CMC酶活单位,以U/g(干曲)表示。测定方法:取1%CMC-Na溶液2 mL于10 mL的离心管中,放入50℃水浴锅中预热5 min后加入0.5 mL适当稀释的酶液,50℃恒温酶解反应30 min;取0.5 mL反应后的酶液和1.5 mL DNS于试管,将试管沸水浴15 min,冷却后加入10 mL去离子水,摇匀,于540 nm比色测定OD值。根据吸光度从葡萄糖标准曲线中查出相应的葡萄糖含量,根据生成的葡萄糖含量计算出CMC-Na酶活值。
(2)滤纸(FPA)酶活力。以滤纸为底物,在pH值4.8,50℃恒温条件下,1 h分解滤纸产生1 μmol葡萄糖所需的酶量,定义为一个滤纸酶活单位,以U/g表示。测定方法:将定性滤纸(新华滤纸1 cm×6 cm)卷成小卷,放进10 mL的离心管中,加入柠檬酸缓冲液(0.1 mol/L,pH值 4.8)2 mL放入50℃水浴锅中预热5 min后,再加入1 mL适当稀释的粗酶液,轻轻摇匀,使滤纸完全浸泡在液体中,50℃保温1 h;然后取0.5 mL反应后的酶液和1.5 mL DNS于试管,将试管沸水浴15 min,冷却后加入10 mL去离子水,摇匀,于540 nm比色测定OD值。根据吸光度从葡萄糖标准曲线中查出相应的葡萄糖含量,根据生成的葡萄糖含量计算出滤纸酶活值。
1.3 紫外诱变
制备好的孢子悬液在紫外灯20 W,照射距离24 cm条件下进行诱变,诱变时间分别为20~180 s(间隔为20 s)。到达照射时间后,用移液枪吸取0.1 mL并稀释涂平板,每个照射时间的依次稀释到104/mL、103/mL、102/mL 3个梯度,每个梯度吸取 0.1 mL涂平板。用黑色塑料袋包好,避光,29℃倒置培养。2~3 d后挑取长势较好的单菌落接PDA斜面培养,以备进一步筛选。
1.4 诱变菌株的筛选
酶活等的测定方法与上述的菌株筛选同。
2 结果与分析
2.1 菌株的初筛
初筛过程中,在CMC-Na平板能够长出明显的菌落的真菌大多可以看到明显的水解圈,但有的菌落虽然长势较好,但没有水解圈。测量其水解圈和菌落的直径,结合二者比值及菌株的生长状况选择其中较好的16株真菌,分别进行划线分离、编号并保藏于固体斜面培养基上,为下一步复筛做准备。
2.2 菌株的复筛
对初筛得到的16株真菌摇瓶复筛分别测出这些真菌的CMC酶活值和FPA酶活值并且观察它们的滤纸崩解情况,最后得到了一株酶活力较高的菌株zzh7。
从 图 1 中 可 以 看 出 ,zzh2、zzh3、zzh5、zzh7、zzh8、zzh11、zzh13、zzh14、zzh15 的 CMC 酶活值在16株真菌中较高,其中zzh5的最高,为3 134.54 U/g,zzh7为2 972.53 U/g。从图2中可以看出,zzh2、zzh5、zzh7、zzh8、zzh14的 FPA 酶活值在 16株真菌中较高,其中zzh7的最高,为203.86 U/g,zzh5为128.33 U/g。从表1中看出,zzh7等11株滤纸崩解的较厉害,zzh4、zzh7、zzh10滤纸崩解为不定形。试验结果表明,zzh7为酶活力较高的野生菌株。
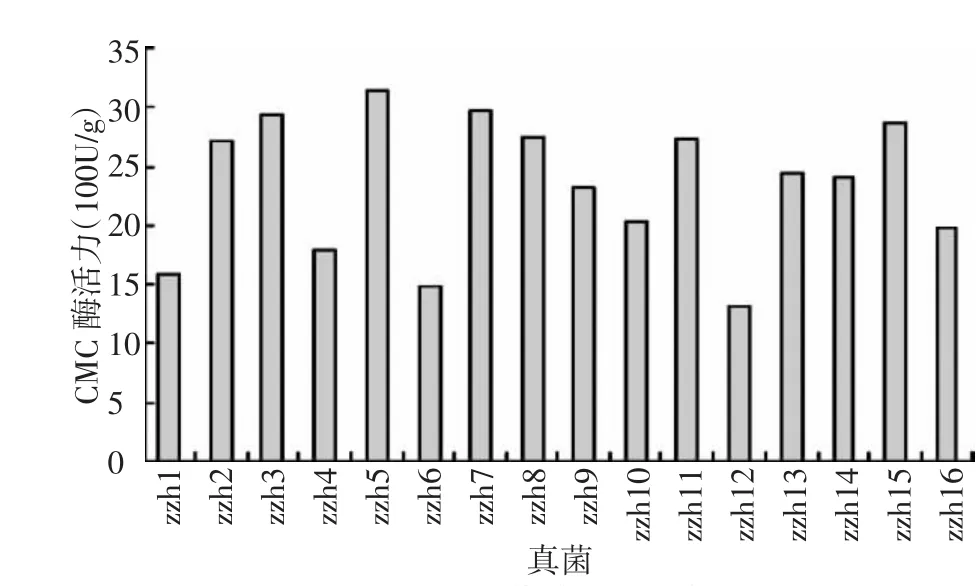
图1 不同真菌的CMC酶活力值
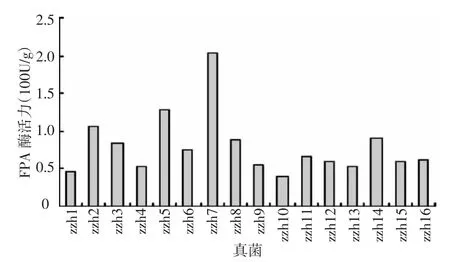
图2 不同真菌的FPA酶活力值
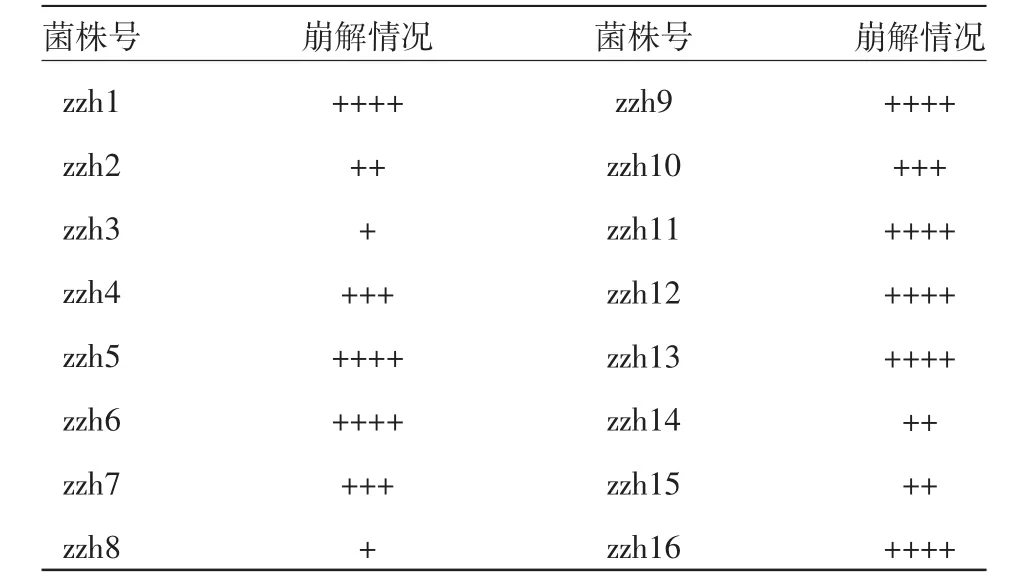
表1 不同真菌的滤纸的崩解情况
2.3 紫外诱变结果分析
图3和图4所示,突变菌株z1~z5的各组酶活与出发菌株相比都有不同程度的提高。其中z1菌株酶活力的提高幅度最大,CMC-Na酶活力、FPA酶活力分别达3 554.88 U/g、506.76 U/g,比出发菌株相应提高1.19倍和2.48倍。其中FPA的提高最大,说明纤维素酶系中3种酶,即纤维二糖水解酶(C1)、葡聚糖内切酶(CMCase)和 β-葡萄糖苷酶(β-Glase)的协同作用增强了,意味着对纤维素的降解能力有较大程度的提高。由图5、图6可知,z1传代后纤维素酶活力值高且稳定。
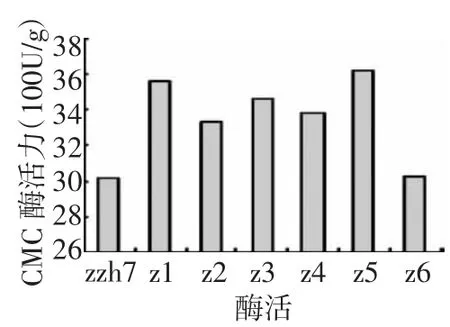
图3 不同菌株的CMC酶活力值
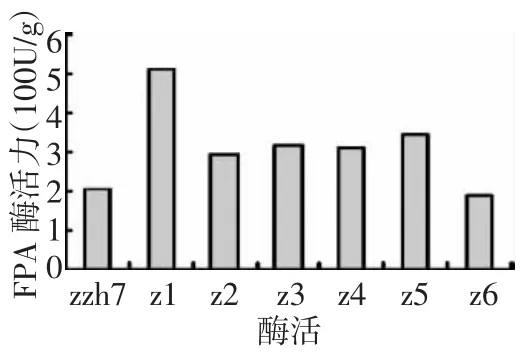
图4 不同菌株的FPA酶活力值
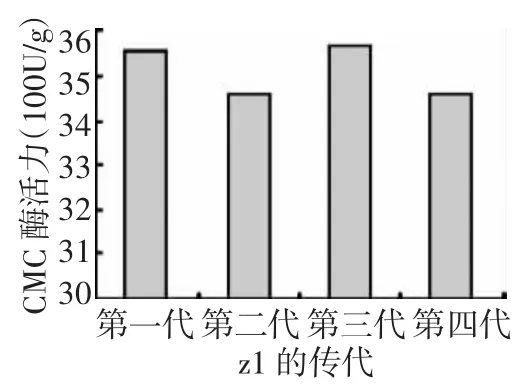
图5 z1传代的CMC酶活值
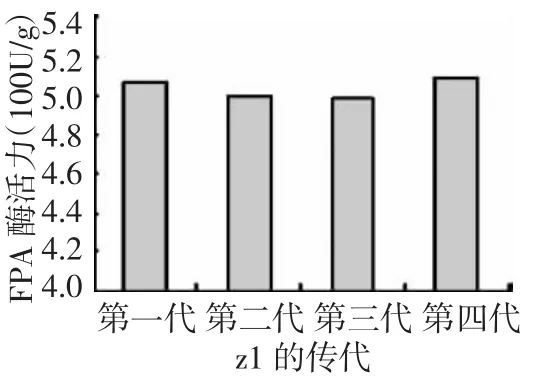
图6 z1传代的FPA酶活值
3 结论与讨论
3.1 结论
通过CMC固体培养基培养,刚果红染色、NaCl脱色,根据透明圈直径和透明圈直径与菌落直径之比的大小及酶活测定,初筛出产纤维素酶活力较高的真菌16株。通过摇瓶发酵复筛,获得了产纤维素酶活较高且酶活力稳定的真菌1株,命名为zzh7。在紫外照射160 s、致死率为87.2%条件下获得的一株突变株z1,其CMC酶活力为3 554.88 U/g、FPA酶活力为506.76 U/g,较出发菌株分别提高了19.59%、148.58%。z1传代后纤维素酶活力值高且稳定。
3.2 讨论
3.2.1 菌株与酶活 我国目前纤维素酶生产的菌株,其 FPA 酶活仅为 100 μmol/g·h[10]。张建强[11]分离的脉纹孢菌(Neurospora sp.)FPA酶活为386.7 μmol/g·h,CMC 酶活为 3551.1 μmol/g·h。邬敏辰[12]研究的绿色木霉的FPA酶活达到555 μmol/g·h。而笔者在筛选的zzh7的滤纸酶活值达到203.86 U/g、CMC酶活为2 972.53 U/g,经紫外诱变后的z1滤纸酶活值达到506.76 U/g、CMC酶活为3 554.88 U/g。zzh7和z1与张、邬所研究的菌株相比较,z1的CMC酶活与张的相差很小,但FPA酶活却明显大于张,与邬的FPA酶活相似。因此,笔者得到的这两个菌株酶活比较高,属于高酶活菌株。
3.2.2 水解圈与酶活 纤维素分解菌目前普遍采用的分离方法是刚果红法[13]。一般情况下,纤维素刚果红培养基用于识别产纤维素酶菌株和初步判定酶活性高低:产酶愈多,水解圈愈大;产酶越快,水解圈则出现越早[14]。但水解圈的大小并不是判断菌株产纤维素酶活高低的唯一依据。笔者发现,在筛选的过程中有的菌落长势较好但无水解圈,有的透明圈小但酶活大,这与姚强、冯健玲观察到的现象一致[15-16]。其原因有很多方面,如固体和液体培养条件不同;不同菌株具有不同的生长和产酶速度以及不同的纤维素酶系;菌苔大小及其在平板上堆积情况的差异等,都会造成透明圈大小与液体发酵酶活结果的不完全一致[17-18]。
3.2.3 吐温-80与酶产量 真菌产生的纤维素酶属于胞外酶。胞外酶必须分泌到细胞外才能充分发挥作用,因此改变细胞膜的通透性能提高酶产量。表面活性剂能改变细胞膜的通透性提高酶的产量,但离子表面活性剂对细胞是有毒性的,而少量非离子表面活性剂可以提高酶的产量[19]。因此,吐温-80可作为培养基添加物质来提高酶的产量。刘颖和许晓鹏的研究均表明,0.05%~0.1%的吐温-80可显著提高纤维素酶活力[20-21]。笔者根据出发菌株zzh7的生长特点选择在培养液中添加0.1%吐温-80,实验表明能够提高纤维素酶的产量。
3.2.4 菌种鉴定与培养条件优化 研究得到的菌株zzh7的菌落形态与18S rDNA的ITS序列数据支持其是一个新的菌种,此内容另文发表。
由于纤维素酶系是一类复杂的复合诱导酶,不同的底物对纤维素酶活力会有很大的影响[22]。大量研究证明,不同的碳源、氮源及不同的浓度都会对纤维素酶系中的各组分酶活有促进作用;不同的培养条件(pH值、温度、湿度等)也会对其有较大的影响。笔者所使用的固体发酵培养基是根据相关文献设计的,该培养基还有待完善。因此,zzh7及其诱变后菌株z1最佳产酶的基质组分和培养条件还有待进一步研究。确定该菌株最佳的产酶条件后,其纤维素酶活力有望进一步提高。
[1]张平平,刘宪华.纤维素生物降解的研究现状与进展[J].天津农学学报,2004,11(3):48-54.
[2]魏亚琴,李永泉,李红玉.分解纤维素的三株真菌的筛选与鉴定[J].兰州大学学报(自然科学版),2008,7,44(专辑):92-96.
[3]高 雯,姜培荣,张之佳,等.食品酶学原理与分析方法[M].哈尔滨:黑龙江科学技术出版社,1995:200-209.
[4]江玉姬,陈汉青,童金秀,等.产纤维素酶菌株C真3的筛选[J].福建农业科技,2003,3:45-46.
[5]魏亚琴,李永泉,李红玉.纤维素分解菌—青霉和放线菌的分离选育研究[J].兰州大学学报(自然科学版),2008,7,44(专辑):87-91.
[6]佟 勇.产纤维素酶放线菌及其酶学性质和淡水湖底泥微生物区系研究[D].上海:中国科学院研究生院(上海植物生理生态研究所),2004.
[7]郝 月,杨翔华,洪 新.秸秆纤维素分解菌的分离筛选试验[J].中国饲料,2005,11:15-17.
[8]沈 萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999.
[9]武秀琴,王 敏.纤维素酶高产菌株的诱变选育[J].安徽农业科学,2008,36(23):9817-9818.
[10]迟乃玉,张庆芳,刘长江,等.纤维素酶高产菌株最适发酵条件的研究[J].沈阳农业大学学报,2000,31(4):380-382.
[11]张建强,李亚澜,李 勇.纤维素降解菌的分离鉴定及固态发酵条件[J].西南交通大学学报,2006,41(4):442-446.
[12]邬敏辰,方诗月,李剑芳,等.绿色木霉WL0422高产纤维素酶的研究[J].江苏食品与发酵,2006,1(研究报告):1-3.
[13]岳思君,李学斌,李爱华,等.高酶活纤维素分解菌分离筛选的研究[J].安徽农业科学,2009,37(1):11-12,15.
[14]叶姜瑜.一种纤维素分解菌鉴别培养基 [J].微生物学通报,1997,24(4):251-252.
[15]姚 强,黄 琰,陈冠军.产耐碱性纤维素酶丝状真菌的筛选及鉴定[J].山东大学学报(理学版),2005,40(1):121.
[16]冯健玲,姚晓华,韦秉兴,等.稻草秸秆纤维素分解菌的分离筛选[J].基因组学与应用生物学,2009,28(3):477-480.
[17]吴 琳,景晓辉,黄俊生.产纤维素酶菌株的分离、筛选及酶活性测定[J].安徽农业科学,2009,37(17):7855-7857,7859.
[18]包 衎,王晓辉,张伟琼,等.纤维素分解菌的选育及酶活测定[J].生物学杂志,2007,24(2):56-58.
[19]郭 勇.酶工程原理与技术[M].北京:高等教育出版社,2005:51.
[20]刘 颖,张玮玮,王 馥.绿色木霉产纤维素酶发酵条件的研究[J].食品工业科技(研究与探讨),2008,3:128-130.
[21]许晓鹏,袁士芳,刘立明.突变黑曲霉高产β-葡萄糖苷酶的培养基优化[J].食品与生物技术学报,2008,27(5):124-127.
[22]曾盈宇,陈介南,何 钢,等.纤维素酶及相关基因克隆的研究进展[J].湖南农业科学,2009,(12):1-3,7.
