微量波动Ames试验在卷烟烟气毒理学评价中的应用研究
2010-07-09潘秀颉吴维佳刘姜瑾杨陟华周冀衡朱茂祥
邹 琳 ,潘秀颉 ,吴维佳 ,刘姜瑾 ,徐 龙 ,杨陟华 ,周冀衡 ,朱茂祥
(1.湖南农业大学烟草科学与健康重点实验室,湖南 长沙 410128;2.军事医学科学院放射与辐射医学研究所,北京 100850;3.湖南中烟工业有限责任公司公司技术中心,湖南 长沙 410014)
自1975年鼠伤寒沙门氏菌突变试验(Ames试验)创建以来[1],国内外发表了大量科学文献,确认Ames试验为一种简便快速初筛环境诱变剂或致癌物的方法。目前,其已成为在世界范围内基因毒性测试中应用最为广泛的一种方法,通常是体外毒理学测试的第一步[2]。此方法在创建伊始就检出卷烟烟气凝聚物具有致突变性[3-4]。2002年,国际烟草科学研究合作中心(CORESTA)卷烟烟气体外毒性测试工作组推荐采用此方法评价卷烟产品的相对毒性[5]。
传统Ames试验采用平板法,存在敏感性低的缺点。1976年Green等通过改良Ames试验发明了波动试验(Fluctuation test)[6],有研究表明该方法的灵敏度比Ames试验高100倍[7-8]。1978年Gatehouse又将其改进为微量波动试验方法(Microtitre fluctuation test),并已证明此方法更为灵敏[9]。笔者采用微量波动试验方法和传统的Ames平板渗入法检测了4种卷烟烟气凝聚物致突变性,以考察不同烤烟原料的致突变性、不同添加剂添加量对卷烟致突变性的影响和微量波动试验在卷烟烟气毒理学评价中的应用价值。
1 材料和方法
1.1 供试材料
试验所用非商品卷烟均由湖南中烟工业有限责任公司技术中心提供。共4个处理,其中1号烟和2号烟为同一产地烤烟制成的单料卷烟,其中1号烟的原料为B2F,2号烟的原料为X3F;3号烟和4号烟为同一叶组配方卷烟,但2种烟的某一添加剂的添加量不同。
1.2 仪器设备与试剂
1.2.1 主要仪器设备 JJ100型单通道吸烟机(由中国烟草总公司郑州烟草研究院生产);YJ-875净化工作台(苏州工业园区三兴净化科技有限公司),MLS-3020高压灭菌锅(SANYO公司),101A-3型干燥箱(上海市实验仪器总厂);电热恒温水浴锅(北京长风仪器仪表公司);低温冰箱(Thermo Format公司);低温高速离心机(KUBOTA公司);DHP-9082型电热恒温培养箱(上海一恒科学仪器有限公司);AL204电子天平(梅特勒-托利多仪器有限公司)。
1.2.2 主要试剂 牛肉膏(Ausable),胰胨(OXOID),葡萄糖-6-磷酸盐(SIGAMA),氧化性辅酶-Ⅱ(ROCHE),组氨酸(SIGAMA),生物素(SIGAMA),氯化钠,磷酸氢二钠,氯化钾,氯化镁,磷酸氢钠铵,柠檬酸,磷酸氢二钾,硫酸镁,溴甲酚紫。
1.3 卷烟烟气凝聚物(CSC)的制备
设定JJ100型单通道吸烟机的抽吸周期为60 s、抽吸时间为2 s,连接好密封的两个玻璃气体采样器,第一个气体采样器内盛有95%的乙醇5.0 mL,第二个气体采样器内盛有5.0 mL蒸馏水,点燃香烟,将卷烟的烟气导入气体采样器管,然后按设定的速率,连续收集10支卷烟。待最后一支吸完,气体采样器管内气体完全吸收后,将两管中的收集液混在一起,并用乙醇洗涤气体采样器,与前混合液混和在一起,定容至10.0 mL容量瓶中,摇匀后分装在0.5 mL EP管中,放至液氮罐中储藏。此CSC的浓度为1.0支烟/mL。
1.4 试验方法
1.4.1 试验菌株 选取对卷烟烟气敏感的TA98和TA100两个菌株[10],试验前均经性状鉴定合格。
1.4.2 微粒体酶制备 用Aroclor 1254诱导大鼠按AMES法制备S9混合液。
1.4.3 平板渗入法 在预先保温45℃的2 mL软琼脂中加入0.1 mL CSC,0.1 mL测试菌株,0.5 mL S9混合物,充分混匀后倒入底层培养基上铺平[11]。每一个试验样品做3个平皿,每皿CSC加入量分别为 6.25、12.50、25.00、50.00 μL。最后将试验平皿放入温箱内,37℃培养48 h,分别记录回变菌落数并取其平均值。
1.4.4 微量波动法 96孔板中每孔加入50 μL含500个细菌的受试菌混合物(1×Vogel-Bonner盐缓冲液,16 g/L葡萄糖,0.002 g/L组氨酸,0.000 3 g/L生物素,0.024 mol/L磷酸盐缓冲液,0.006 6 mol/L氯化钾,0.001 6 mol/L氯化镁,0.001 mol/L葡萄糖-6-磷酸,0.000 8 mol/L辅酶Ⅱ,2%肝S9液及相应浓度受试物)。各受试物分别采用6.25、12.50、25.00、50.00 μL/板浓度进行测试,每种浓度每种菌接种48个孔,37℃孵育16 h后加入选择培养基150 μL(1×Vogel-Bonner盐缓冲液,8 g/L 葡萄糖,0.006 7g/L溴甲酚紫),继续培养72 h后观察,孔内培养物由紫色变为黄色为阳性[12-14]。
1.4.5 结果判定 计数每种菌每种CSC每个浓度的突变菌落数或阳性孔数,以浓度为横坐标,突变菌落数或阳性孔数为纵坐标作图,比较不同样品的相对毒性。
2 结果与分析
2.1 2种Ames试验方法测定4种卷烟CSC致TA98菌突变性结果
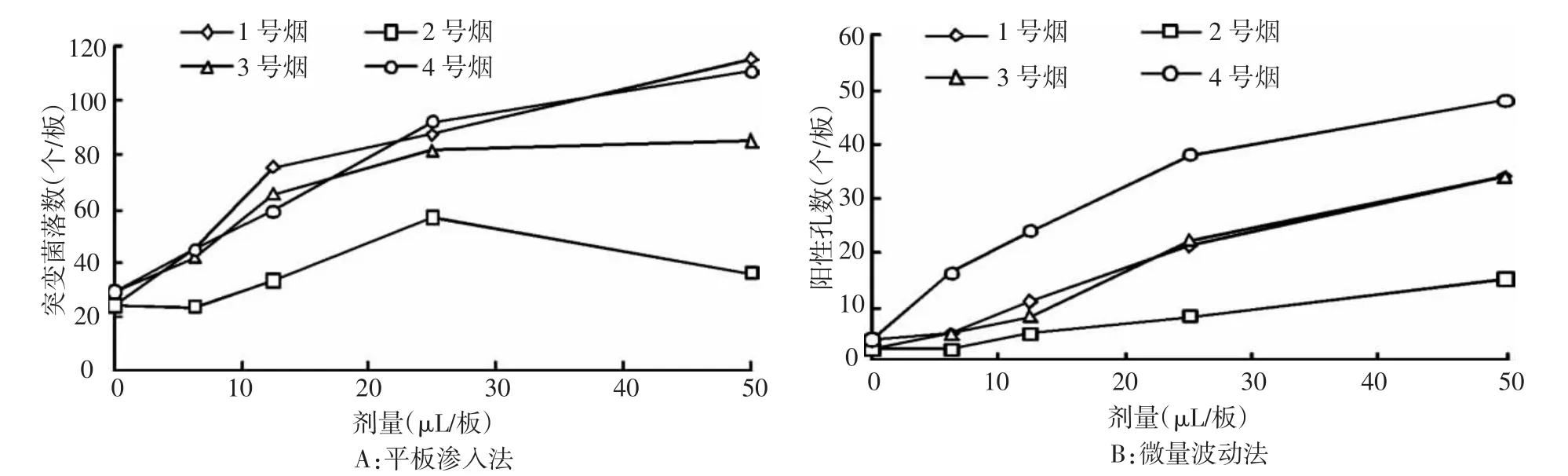
图1 平板渗入法和微量波动法测定4种卷烟CSC对TA98菌株的致突变结果
分别用平板渗入法与微量波动法检测4种卷烟样品CSC对鼠伤寒沙门氏菌TA98菌株的致突变性,结果如图1所示,对同一卷烟样品,2种Ames试验方法检测的卷烟烟气细菌致突变性均有良好的剂量效应关系。4种不同样品的卷烟,2种Ames试验方法检测的卷烟烟气细菌致突变性结果一致,即2号卷烟对TA98菌的致突变性最低,1号和3号卷烟相当,4号卷烟最高。进一步分析2种检测方法的实验结果,线性范围和剂量效应曲线如表1所示,与传统的平板法计数结果比较,微量波动法检测结果的线性范围更宽,单位剂量致突变率更低,表明试验的灵敏性更高(为平板法的2倍以上)。
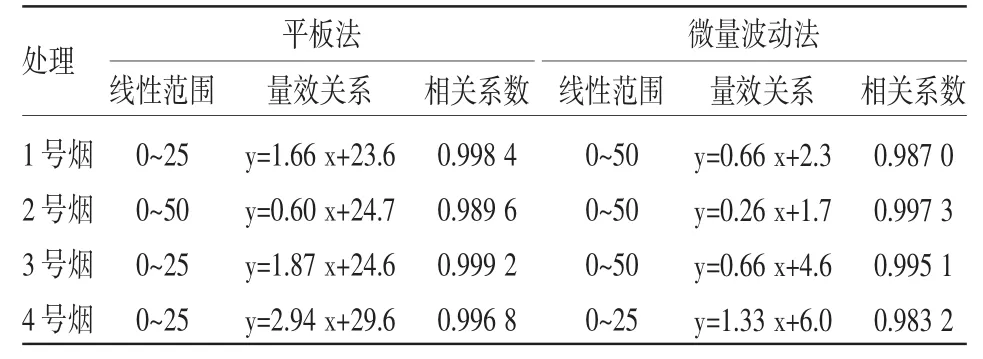
表1 平板渗入法和微量波动法测定4种卷烟CSC对TA98菌株的致突变性结果分析比较
2.2 2种Ames试验方法测定4种卷烟CSC致TA100菌突变性结果
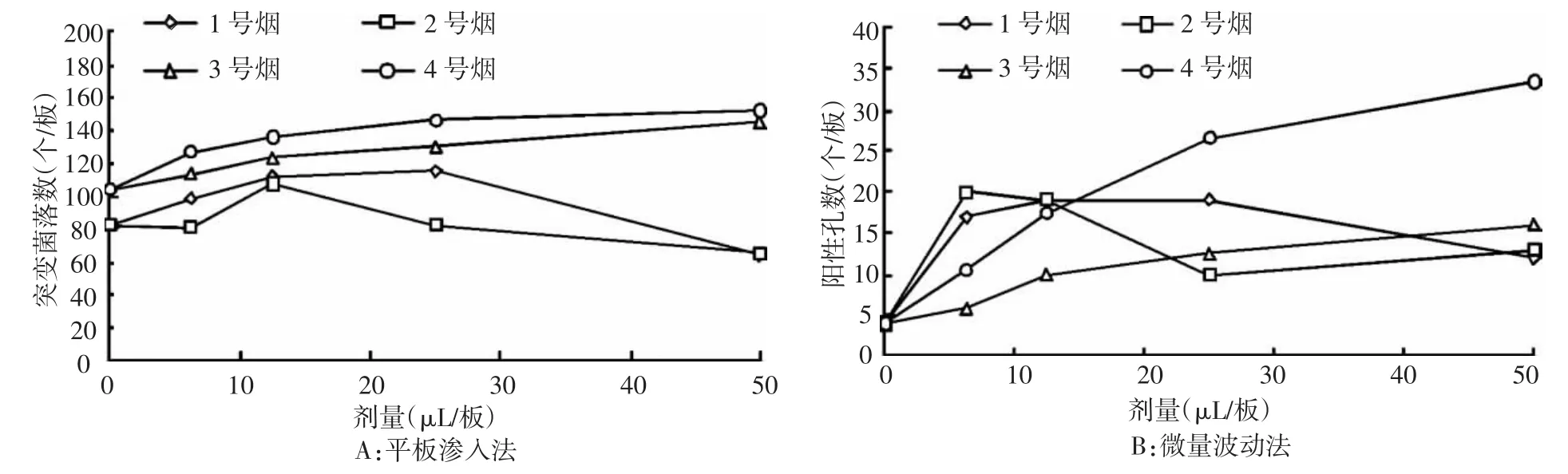
图2 平板渗入法和微量波动法测定4种卷烟CSC对TA100菌株的致突变结果
分别用平板渗入法与微量波动法检测4种卷烟样品CSC对鼠伤寒沙门氏菌TA100菌株的致突变性,结果如图2所示,与TA98菌的检测结果相似,2种Ames试验方法检测的卷烟烟气细菌致突变性结果一致,即1号和2号卷烟对TA100菌的致突变性相当,3号卷烟居中,4号卷烟最高。进一步分析2种检测方法的实验结果,线性范围和剂量效应曲线如表2所示,与传统的平板法计数结果比较,微量波动法检测结果的线性范围更宽,单位剂量致突变率更低,表明试验的灵敏性更高(为平板法的4倍以上)。
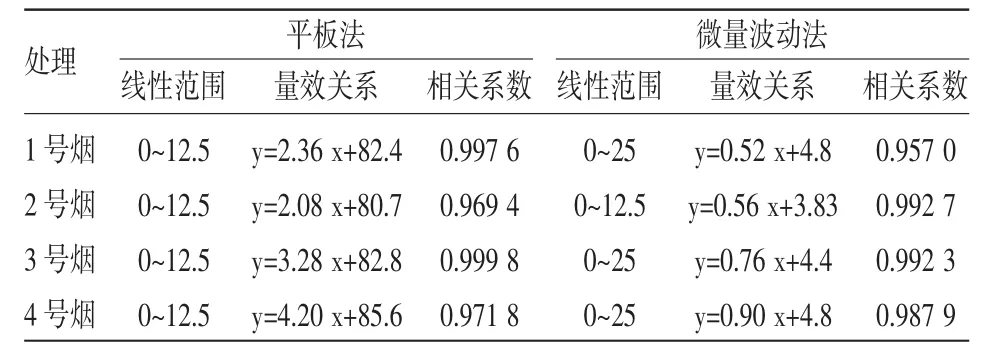
表2 平板渗入法和微量波动法测定4种卷烟CSC对TA100菌株的致突变性结果分析比较
3 讨论
传统的Ames平板渗入法采用半固体培养液,在有外源致突变物存在的情况下,组氨酸缺陷型鼠伤寒沙门氏菌发生回复突变,回复为野生型,可在无组氨酸的培养基生长。故可根据菌落形成数量,检查受试物是否为致突变物[15]。微量波动试验(Microtitre fluctuation test)的基本原理与传统Ames试验相似,不同的是在微量波动实验中,培养系统采用液体培养基,在96孔板中培养,并通过细菌代谢产物导致培养基酸碱性变化,用酸碱指示剂进行结果检测。外源化合物致突变能力越强,变色的孔数越多。微量波动法的全液体测试环境使得S9及受试物等在测试环境下仍可继续作用一定的时间,从而使得可诱变受试菌的代谢物增加,Ames突变率增加,增强灵敏性。
本实验采用微量波动法和平板渗入法分别测定了4种供试卷烟CSC的致突变性。结果显示,随着CSC加入量的增加,2种方法测定的突变性均呈剂量依赖性的增强。表明微量波动法测定的结果与平板渗入法测定的结果具有一致性,微量波动法应用于卷烟的安全性评价具有一定的可靠性和实用性。而从结果中可以看出,对于致突变性相近的CSC,平板渗入法在受试物较高浓度才能显示出差别,而微量波动法在受试物低浓度时就可表现出明显差异,表明微量波动法相对于平板渗入法在进行卷烟安全性评价中具有灵敏度高的特点。
通过平板渗入法和微量波动法的测定,1号烟(B2F)和2号烟(X3F)烤烟的致突变性存在显著差异,1号(B2F)烤烟的致突变性明显大于2号(X3F)烤烟。实验表明通过合理的选择叶组配方,能够在一定程度上降低卷烟产品的致突变性,提高卷烟产品的安全性。对于采用同一叶组配方的卷烟产品,某一种添加剂添加量的不同也会造成其致突变性的差异,合理的选择烟用添加剂及其用量对于降低卷烟产品的危害性具有一定意义。
[1]Ames BN,Mccann J,Yamasaki E.Methods for detecting carcinogens and mutagens with the Salmonella/mammalian-micro some mutagenicity test[J].Mutat Res,1975,31(6):64-347.
[2]Josephy P D,Gruz P,Nohmi T.Recent advances in the construction of bacterial genotoxicity assays[J].Mutation Research,1997,386:1-23.
[3]Hutton J J,Hackney C.Metabolism of cigarette smoke condensates by human and rat homogenates to form mutagens detectable by Salmonella typhimurium TA1538[J].Cencar Res,1975,35(9):2461-2468.
[4]Kier L D,Yamasaki E,Ames B N.Detection of mutagenic activity in cigarette smoke condensates[J].Proc Natl Acad Sci USA.,1974 ,71(10):4159-4163.
[5]卢斌斌,姚玮华.卷烟烟气体外毒理学测定方法研究进展[J].中国烟草学报,2008,(4):56-61.
[6]Green M H,Muriel W J,Bridges B A.Use of a simplified fluctuation test to detect low levels of mutagens[J].Mutat Res,1976,38(1):33-42.
[7]Falck K,Sorsa M,Vainio H,et al.Mutagenicity in urine of workers in rubber industry[J].Mutat Res,1980,79(1):45-52.
[8]Kuhnlein U,Bergstrom D,Kuhnlein H.Mutagens in feces from vegetarians and non-vegetarians[J].Mutat Res,1981,85(1):1-12.
[9]Levin DE,Blunt EL,Levin RE.Modified fluctuation test for the direct detection of mutagens in foods with Salmonella typhimurium TA98[J].Mutat Res,1981,85(5):309-321.
[10]和智君,李绍臣,陈章玉.遗传毒理学在低危害卷烟研究中的应用综述[J].烟草科技,2004,(10):24-26.
[11]赵同刚.化妆品卫生规范 [M].北京:军事医学科学出版社,2007.
[12]宋 芬,李 彤,徐品良,等.微量波动试验方法的研究[J].中国公共卫生学报,1990,(39):39-40.
[13]胡长灯,詹卓玲.微量波动试验的影响因素及灵敏度研究[J].卫生毒理学杂志,1990,(4):115-116,121.
[14]D Gatehouse,D J Wedd.The differential mutagenicity of isoniazid in fluctuation assays and Salmonella plate tests[J].Cardnogenesis,1984,(5):391-397.
[15]GB15193.4-2003鼠伤寒沙门氏菌/哺乳动物微粒体酶试验[S].
