大孔树脂纯化柿叶总黄酮的工艺研究
2010-07-09董江涛徐慧强蒋橙华
董江涛,李 燕,徐慧强,蒋橙华
(上海海洋大学食品学院,上海 201306)
柿叶中含有黄酮、Vc、β-胡萝卜素、生物态碱和必需氨基酸等多种营养物质和生理活性物质,其中黄酮类化合物是主要的活性成分之一,具有抗氧化、抗过敏、抗炎、抗菌、抗突变、抗肿瘤、保肝等作用[1],在防治中老年人脑动脉硬化、预防脑血栓形成、脑中风后遗症康复治疗中有辅助作用,在皮肤抗衰老美容等方面也有广泛开发应用前景[2]。柿叶黄酮类化合物开发意义重大,但现有的提取方法所得黄酮纯度一直不高,因此需要选择一种较为经济快速的方式提高黄酮的纯度。
大孔树脂是一种具有多孔立体结构的聚合物吸附剂,依靠其表面基团与待分离物质的作用力不同进行吸附与洗脱。其物理化学性能稳定、吸附选择性好、富集效果好、不受无机物存在的影响、解吸条件温和、使用周期长、再生简便、节省费用等优点,被广泛应用于天然产物的分离纯化[3]。本试验通过对10个不同型号的大孔树脂对比,选取NKA-2树脂作为纯化柿叶黄酮的树脂,并对其纯化参数进行了优化。
1 材料
1.1 材料与试剂
柿叶:柿树科(Ebenaceae)柿树属(Persimmonl)柿树,树龄三年。11月霜后采集河北大磨盘柿树树叶,经60℃恒温烘箱烘干备用。
树脂:D101型、HPD-826型、HPD-722型、HPD-600型、DM-130型、NKA-9型ADS-17型、ADS-7型(沧州宝恩化工有限公司);NKA-2型、AB-8型(上海华震科技有限公司);芦丁标准品由中国药品生物制品检定所提供;NaNO2、Al(NO3)3、NaOH均为分析纯。
1.2 仪器与设备
2.0 cm×60 cm层析柱(上海锦华层析设备厂);HL-2恒流泵(上海青浦沪西仪器厂);WFZUV2000紫外可见分光光度计(尤尼柯仪器有限公司);sartorius BS210S电子天平(北京塞多利斯天平有限公司);高速冷冻离心机(H2050R-1长沙湘仪离心机仪器有限公司);微量移液枪(德国eppendorf公司)。
2 试验方法
2.1 树脂的选择
大孔树脂主要是通过其表面的基团与待分离物质的结合力不同来实现物质分离的,结合力强弱与基团的极性有关。根据黄酮类化合物的极性,选取了具有极性、弱极性、和非极性的10个大孔树脂进行筛选,表1为10个型号大孔树脂的物理结构参数。
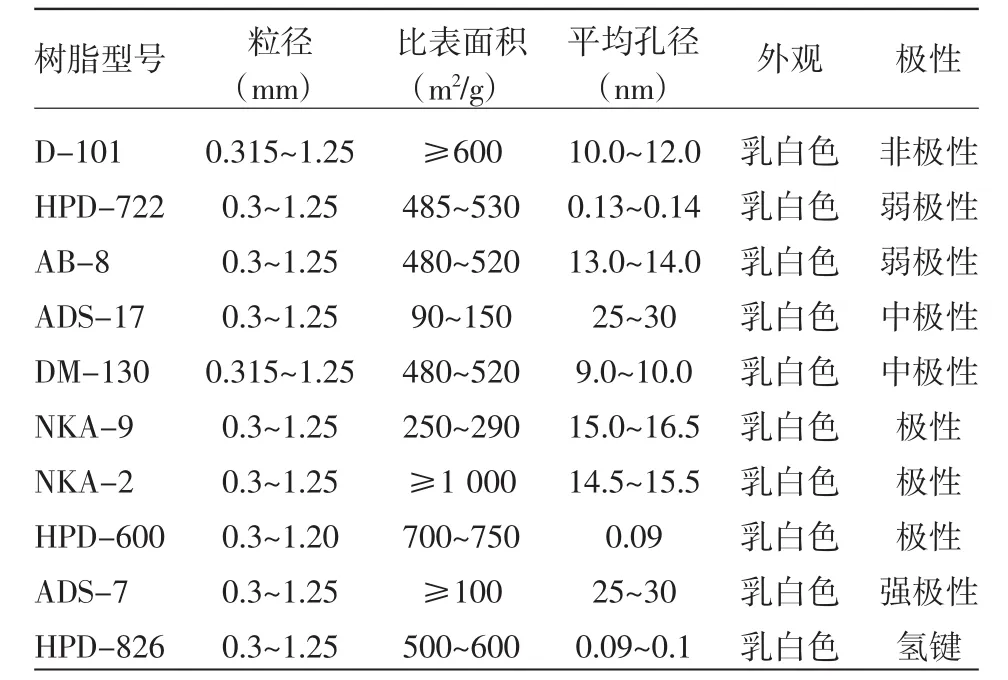
表1 10个型号大孔树脂的物理结构参数
2.2 树脂的预处理
经筛选后的各树脂,先用95%乙醇浸泡,于120次/min的摇床内震荡24 h充分溶胀,然后加入去离子水洗至洗出液无白色浑浊;用4倍体积的5%HCl溶液浸泡,于120次/min的摇床内震荡12 h,而后用去离子水速洗至出水pH值为中性;再用4倍体积的5%NaOH溶液浸泡,于120次/min的摇床内震荡12 h,用去离子水洗至pH值中性,滤去水后,于室温晾干即得[3-4]。
2.3 芦丁标准曲线制作
准确称取0.010 0 g芦丁标准品,用60%的乙醇溶解,定容到50 mL容量瓶中,摇匀,得0.200 mg/mL的芦丁标准液。分别移取 0.0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL的芦丁标准液于8个25 mL容量瓶中,各加1.0 mL 5%的NaNO2溶液,摇匀后静置6 min。再各加1.0 mL 10%的Al(NO3)3溶液,摇匀后静置6 min。继续各加入10.0 mL 4%的NaOH溶液,用60%的乙醇稀释到刻度,静置15 min。在510 nm处测定吸光度(A),以浓度(mg/mL)为横坐标,A 为纵坐标制作标准曲线[5]。
2.4 黄酮溶液配制
将黄酮提取液旋转蒸发后冷冻干燥,得到粗黄酮粉末,取1 g粉末溶解在50 mL 60%的乙醇中,量取0.2 mL,测定黄酮含量,经计算得提取粗粉中黄酮含量为18.7%。根据含量按1∶93.5(g/mL)的比例,配置浓度为2.0 mg/mL的黄酮溶液。
2.5 黄酮含量测定原理及方法
2.5.1 黄酮含量测定原理 黄酮含量测定采用硝酸铝络合分光光度法,其原理是先用亚硝酸钠还原黄酮,再加硝酸铝络合生成稳定的红橙色化合物,然后以芦丁作标准,于510 nm(符合定量分析的比尔定律)波长处测定吸光度,计算黄酮类物质的含量。
2.5.2 黄酮含量测定方法 准确量取黄酮溶液1 mL于容量瓶中,加1.0 mL 5%的NaNO2溶液,摇匀后放置6 min;再加入1.0 mL 10%的Al(NO3)3溶液,摇匀后放置6 min;继续加入10.0 mL 4%的NaOH溶液,用60%的乙醇稀释到刻度,放置15 min。在510 nm处测定吸光度,根据标准曲线计算黄酮含量[6]。
2.6 10个型号树脂对柿叶黄酮的吸附率与解吸率的测定
2.6.1 吸附率测定 将选择的10个不同极性的大孔树脂进行吸附率的测定比较。测定方法为:准确称取经预处理的树脂各1 g于50 mL具塞磨口三角瓶中,加入柿叶总黄酮溶液25 mL(黄酮浓度为2.0 mg/mL),置摇床上振荡24 h,振荡频率为220次/min,充分吸附后过滤,测定滤液中剩余黄酮浓度,按下式计算各树脂的吸附率式中:Q—吸附率(mg/g),C0—初始浓度(mg/mL),Cr—剩余浓度(mg/mL),V—溶液体积(mL),W—树脂的质量(g)[7]。
2.6.2 解吸率测定 取经上述方法充分吸附黄酮后的树脂各1 g,准确加入70%的乙醇30 mL,置摇床上振荡12 h,振荡频率为120次/min,过滤,测定滤液中黄酮浓度,根据黄酮解吸量计算解吸率(%)。
2.7 树脂纯化参数的优化
对2.6.2选取的树脂的纯化参数工艺进行优化,分为静态吸附与动态吸附两部分试验。静态吸附试验主要考察上样液pH值、吸附时间、解吸乙醇的浓度的影响。动态吸附试验主要从上样浓度、上样流速、上样量、洗脱流速、洗脱终点等方面进行考察。当流出液吸光度达上样液的1/10时,认为达到穿透点停止上样,计算吸附量。
3 结果与分析
3.1 10个不同型号树脂对柿叶黄酮的吸附率与解吸率
如表2所示:吸附率较高的树脂有:ADS-7、NKA-2、HPD-826,解吸率较高树脂有:DM-130、HPD-600、NKA-2、HPD-826。综合比较吸附率与解吸率选取NKA-2作为纯化黄酮的较理想树脂。
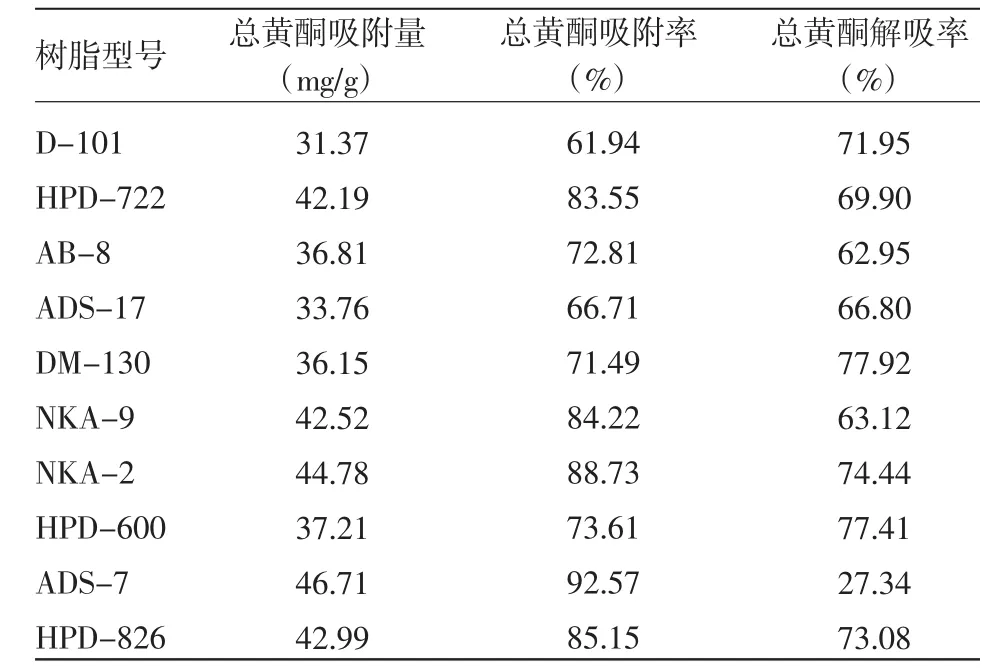
表2 10个型号大孔树脂对黄酮类化合物的吸附率与解吸率
3.2 芦丁标准曲线
从图1中可以看出,芦丁标准曲线回归方程为:A=9.412 2C-0.005 4(R2=0.999 7),其中C为黄酮浓度(mg/mL),A为吸光度,线性关系良好。
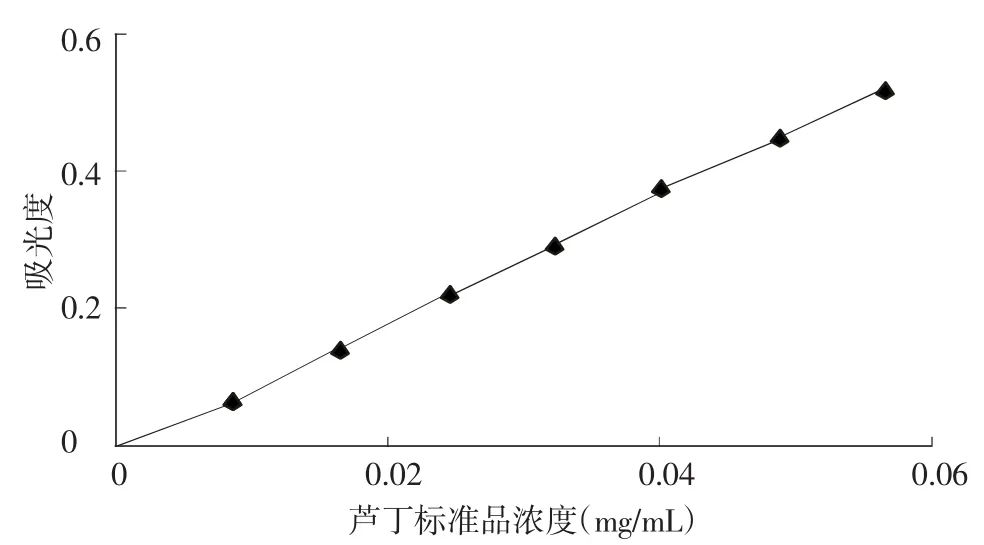
图1 芦丁标准曲线图
3.3 NKA-2树脂的静态吸附试验
3.3.1 上样液pH值的考察 分别考察了pH值为2、3、4、5、6 条件下黄酮的吸附率。结果(见图 2)可知,当溶液的pH值为3时,黄酮的吸附率最高,吸附率随着pH值继续增加而降低。这是因为在酸性较强时易形成“佯盐”,偏碱性时分子中酚羟基H+易失去,形成离子结构,不易被吸附[8]。
3.3.2 吸附时间的考察 分别考察了1、2、3、4、5、6、8、10、12 h 后黄酮的吸附率,结果(见图 3)中得知:吸附率在前3小时内增长较快,到达第5小时树脂基本达到吸附平衡。这是因为在吸附的最初阶段,树脂表面与黄酮接触充分,但随着吸附时间的继续延长,由于孔容的极限,吸附量的增加速率减小。
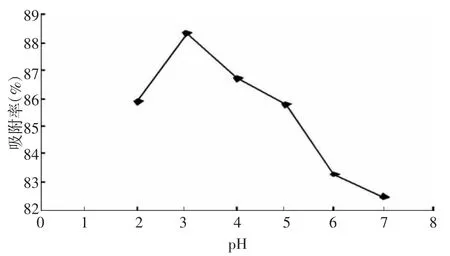
图2 pH值对吸附率的影响
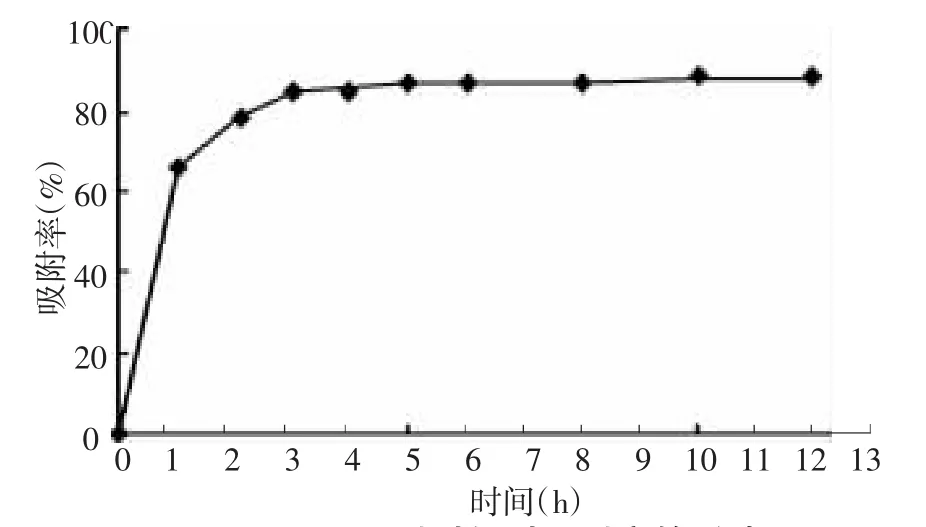
图3 吸附时间对吸附率的影响
3.3.3 乙醇解吸浓度 分别以浓度为30%、40%、50%、60%、70%、80%、90%的乙醇,进行解吸,测定解吸液浓度计算解吸率,从结果(图4)可看出随着乙醇浓度的不断增加,黄酮的解吸率不断上升,这是由于柿叶中黄酮类化合物的极性决定的。当乙醇浓度达到70%后,解吸率增加不明显,从节省原料的角度考虑,选取70%作为解吸乙醇的浓度。
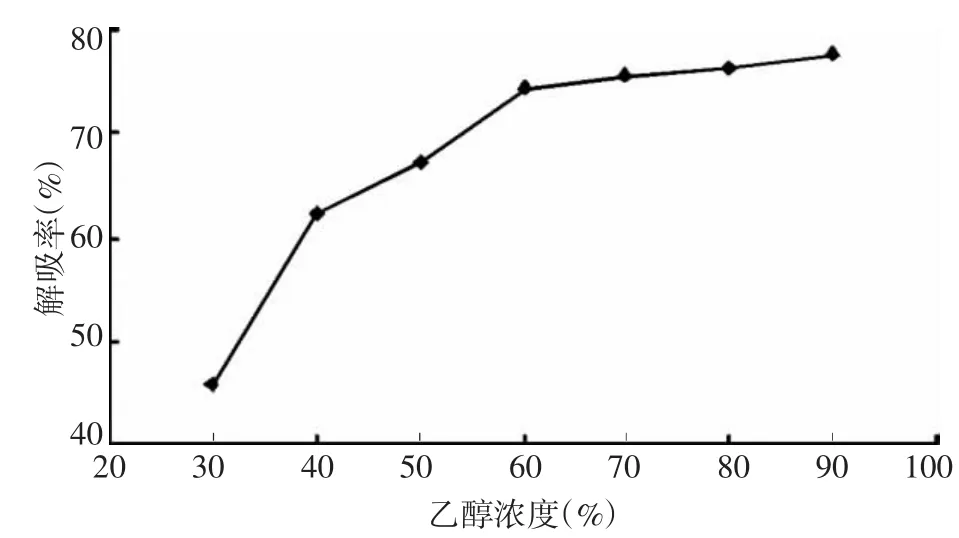
图4 乙醇浓度对解吸率的影响
3.4 NKA-2树脂的动态吸附试验
3.4.1 上样液浓度的考察 分别以浓度为4、6、8、10 mg/mL的黄酮溶液上样,计算黄酮的吸附率,从结果(图5)可知:随着上样液浓度的增加,黄酮的吸附率不断降低,这是由于在较低的浓度下,黄酮与树脂能够充分接触,吸收较强。大孔吸附树脂的吸附量一般与上样液浓度成反比,在低浓度下对吸附有利。在相同流速和相同吸附时间下,若上柱液浓度过大,由于孔容的限制,存在一个吸附极限,所以会有更多的有效物质未被充分吸附而流出。
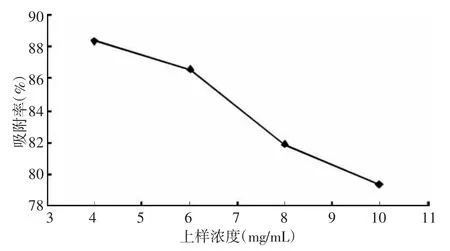
图5 上样液浓度对吸附率的影响
3.4.2 上样量的考察 分别以 1、2、3、4、5、6、7、8 BV的量上样,检测上样后流出液的黄酮浓度,计算NKA-2树脂的吸附率,结果(图6)可知:在上样量较小的情况下,树脂对黄酮的吸附基本与上样量成正比,这是由于起始阶段树脂表面有足够的基团吸附黄酮,随着上样量的不断增大,树脂表面基团不断饱和,吸附能力逐渐减弱,表现为流出液的浓度升高,当C’/C=1/10时即达到吸附穿透点,认为吸附饱和,因此选择5 BV作为上样体积。
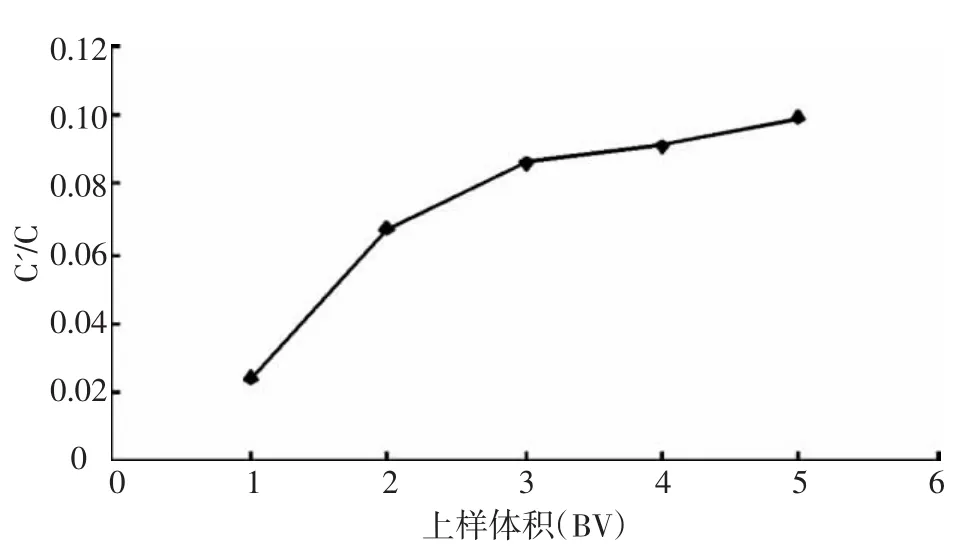
图6 上样量的考察
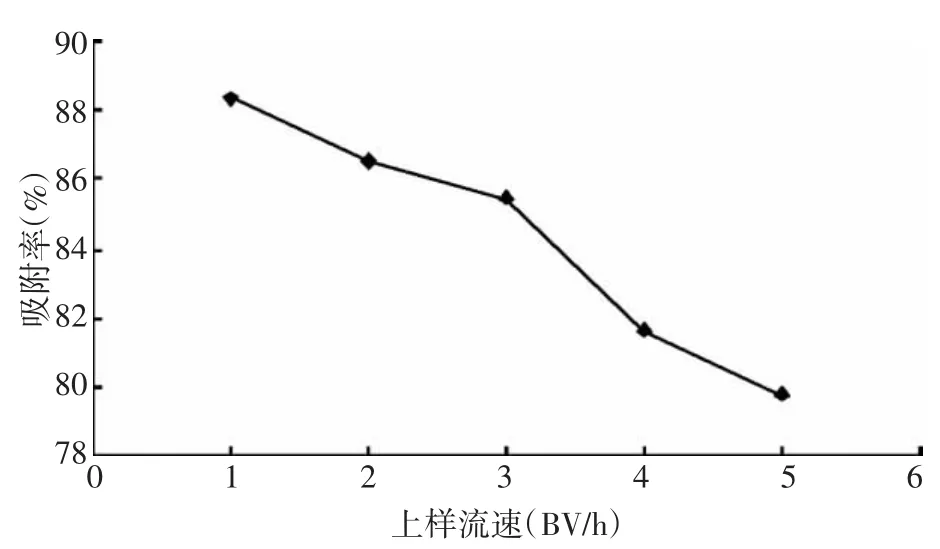
图7 上样流速对解吸率的影响
3.4.3 上样流速的考察 分别以1、2、3、4、5 BV/h的流速通过NKA-2树脂柱,计算树脂对黄酮的吸附率,结果(图7)可知:随着上样液流速的增加,黄酮的吸附率不断降低,上柱液流速主要影响溶质向树脂表面扩散,从而决定了吸附效果。如果吸附流速过大,会使树脂的吸附量下降。因为在相同的吸附速度下,加快流速使得相对吸附时间减少,溶质分子来不及扩散到树脂内表面,未被充分吸附就流出来了,造成样品的流失;如果流速过小,试验周期延长,效率降低。考虑到吸附效果与试验周期的要求,以2 BV/h作为上样流速。
3.4.4 洗脱速度的考察 分别以 1、2、3、4、5 BV/h的流速进行洗脱,收集洗脱液检测黄酮含量,计算总黄酮的解吸率,结果(图 8)可看出,以1、2 BV/h的流速洗脱时,黄酮回收率相近,更高的流速并没有将黄酮充分解吸,这是由于较低流速下乙醇能够充分溶解已吸附的黄酮,而过高的流速使得乙醇没能来得及溶解黄酮就已经流走。因此结合试验周期的需求,以2 BV/h的流速进行洗脱较优。
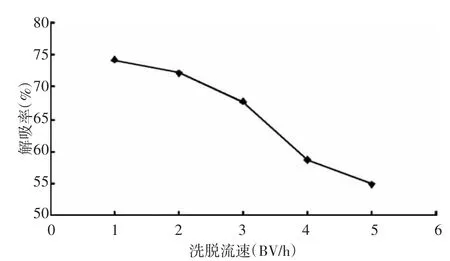
图8 洗脱流速对吸附率的影响
3.4.5 洗脱终点的考察 取柿叶样品液(总黄酮含量为4.0 mg/mL),调节 pH=3,以2 BV/h的流速、5 BV的上样量加入 NKA-2树脂柱,进行吸附,再以5 BV水洗脱后,用70%乙醇以2 BV/h的速度洗脱,按树脂床体积收集洗脱液,计算含量,结果(图9)可看出,在起始阶段,随着乙醇体积的增大,黄酮的解吸率增加很快,当洗脱液用量为6 BV时,解吸率增加缓慢,通过计算得知基本达到解吸平衡,因此选定6 BV作为洗脱体积。
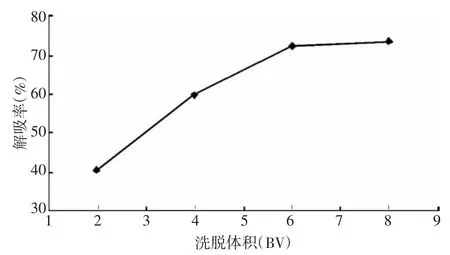
图9 洗脱终点的考察
3.5 分离的柿叶总黄酮纯度考察
取柿叶样品液(总黄酮含量为2.0 mg/mL)20 mL平行3份,调节pH=3,以BV/h的上样流速通过NKA-2树脂柱(2 cm×20 cm),上样体积为5 BV,以2 BV/h的洗脱流速用70%的乙醇洗脱,收集洗脱液,取10 mL,旋转蒸发后,冷冻干燥,测定总黄酮的含量,经计算总黄酮的纯度分别为51.7%、52.2%、52.1%,平均为52%,测定结果稳定,偏差不大,说明经NKA-2大孔树脂处理后的总黄酮含量可达50%以上,且具有良好的重现性。
4 结论
通过对大孔树脂动态吸附及解吸的相关因素研究,确定了大孔树脂分离柿叶总黄酮的最佳工艺:树脂型号为NKA-2型大孔树脂,上样液浓度为4 mg/mL(溶液pH=3),吸附速率为2 BV/h时吸附效果最好,上柱量为5 BV,洗脱最佳工艺为:6 BV的70%乙醇,以2 BV/h的速率洗脱效果最佳。经NKA-2处理后的柿叶总黄酮可达52%,与粗粉中黄酮含量比较,纯化了33.8%。
[1]卫静莉,高松平,董 梅,等.柿叶提取黄酮类化合物方法及鉴定[J].林业科技开发,2007,21(3):47-49.
[2]贝伟剑,彭文烈,罗 杰.柿叶黄酮的大孔吸附树脂分离提纯富集[J].中成药,2005,27(3):3257-261.
[3]刘志祥,曾超珍.大孔树脂法纯化苦丁茶总黄酮的研究[J].时珍国医国药,2009,20(9):2183-2184.
[4]Liu J,Luo J G,Sun Y,et al.A simple method for the simultaneous decoloration and deproteinization of crude levan extract from Paenibacillus polymyxa EJS-3 by macroporous resin.[J].Bioresource technology,2010,19(3):1-7.
[5]熊曼萍,梁 静,周 蓉,等.超声波提取柿叶总黄酮的工艺研究[J].安徽农业科学,2007,35(30):9708-9709,9726.
[6]汪河滨,郭志愿,赵小亮,等.超声-微波协同萃取灰叶胡杨花粉中总黄酮的工艺研究[J].食品科学,2009,261(30):61-64.
[7]Zhang F X,Wan Z,Xu S Y.Macroporous resin purification of grass carp fish (Ctenopharyngodonidella)scale peptides within vitro angiotensin-Iconverting enzyme(ACE)inhibitoryability[J].Food Chemistry,2009,15(4):387-392.
[8]张 玲,刘青梅,杨性民,等.杜仲叶绿原酸总黄酮的分离纯化及检测[J].湖南农业科学,2009,(12):122-125.
