鸭多杀性巴氏杆菌外膜蛋白A基因表达及抗原性鉴定
2010-07-04郭东春刘家森姜骞司昌德林欢韩凌霞崔玉东曲连东
孙䶮 ,郭东春 ,刘家森 ,姜骞 ,司昌德 ,林欢 ,韩凌霞 ,崔玉东 ,曲连东
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室实验动物研究室)
鸭巴氏杆菌病又叫鸭出血性败血症或鸭霍乱,是由多杀性巴氏杆菌(Pasteurella multocida,Pm)引起的一种急性、败血性传染病。多种禽类都可感染,但以鸭、鸡、鹅最易感[1]。雏鸭的发病率和死亡率较高。本菌革兰氏染色为阴性,主要以其荚膜抗原和菌体抗原区分血清型,前者有5种,后者分为16个型[2]。到目前为止,分离的禽多杀性巴氏杆菌血清型主要是1:A、3:A和5:A,我国分离到的鸭多杀性巴氏杆菌以 5:A 为最多,其次为 8:A[3,4]。该菌正常存在于多种健康鸭口腔和咽喉部粘膜,当机体处于应激状态,抵抗力低下时,细菌侵入体内,大量繁殖并致病,发生内源性传染[2]。本菌广泛分布于世界各地,给养禽业造成巨大的经济损失,被列为重点防治的疫病之一。
外膜蛋白(Outer membrane proteins,OMPs)是革兰氏阴性菌细胞壁的特有成分,镶嵌于细胞膜的中间,在维持外膜结构、物质转运,以及细菌对宿主的感染和致病过程等方面,起着重要的作用[5]。Omp A蛋白是外膜蛋白中的的一种重要的蛋白,这种蛋白是相对保守的,作为跨膜蛋白与宿主细胞外基质相互作用从而达到粘附作用[6]。Dabo报道[7],重组后的多杀性巴氏杆菌Omp A蛋白免疫小鼠能够引起较强的TH2型免疫反应,产生较高的IgG抗体。
目前,关于多杀性巴氏杆菌Omp A蛋白的研究,国内尚未见相关报道。本研究以鸭多杀性巴氏杆菌C48-102外膜蛋白A为研究对象,将去信号肽的Omp A蛋白进行克隆,实现了该蛋白在大肠杆菌中的表达,Western-blot结果表明,表达产物具有良好的抗原性,现具体报道如下。
1 材料与方法
1.1 菌株和质粒
多杀性巴氏杆菌株C48-102购自中国兽医药品监察所,大肠杆菌 TOP10、BL21(DE3)、质粒 pPROEX-Htb由本室保存。
1.2 培养基
BHI培养基购自BD公司。
1.3 酶及主要试剂
Ex-Taq聚合酶、dNTP购自宝生物工程(大连)有限公司,DNA胶回收试剂盒购自上海华舜生物技术有限公司;鸭阳性血清由本室制备;HRP标记的羊抗鸭IgG购自KPL公司;其它化学试剂均为国产分析纯试剂。
1.4 omp A基因的扩增和克隆
1.4.1 引物设计
按GenBank上登录的多杀性巴氏杆菌Pm70序列(登录号:AE004439),应用软件设计两对扩增的omp A基因引物:
PAF2:5’ -CGTCGAGGATCATCCAAATG-3’;PAR2:5’-GCCCGTTACAATAGCCACG-3’
pPMEA2:5’-GCGGGATCCTATGTAGGTGCTAA AGCAG-3’(下划线为BamHI位点);
pEPMAR1:5’-CCCGTCGACTTATTTGTTACCTT TAAC-3’(下划线为SalⅠ位点)
引物由上海invitrogen公司合成,其中,PAF2和PAR2为扩增omp A全基因;pEPMAF1和pEPMAR1为扩增omp A去信号肽的基因。
1.4.2 基因组DNA的提取
将多杀性巴氏杆菌C48-102划线接种于BHI固体培养基平板上,37℃恒温过夜培养。用接种环挑取单菌落,于 400 μL Lysis buffer(10 mmol·L-1Tris.Cl,0.5 mol·L-1NaCl,1 mmol·L-1EDTA,2%SDS) 和终浓度为 100 μg·mL-1的 Proteinase K,置 55 ℃水浴消化2 h,冷却至室温后用酚/氯仿/异戊醇及氯仿抽提,乙醇沉淀,最后用100 μLTE溶解DNA,-20℃保存备用。
1.4.3 PCR扩增
PCR总体积为50 μL,反应体系如下:10×Ex-Taq Buffer 5 μL,2.5 mmol·L-1dNTP 4 μL,DNA 模板2 μL,上下游引物各 1 μL,Ex-Taq DNA 聚合酶0.5 μL,水36.5 μL。PCR反应条件为:94 ℃变性5 min;进入PCR循环,94℃变性30 s,52退火℃ 30 s,72℃延伸90 s,共进行32个循环;最后72℃延伸10 min,PCR产物4℃保存。反应结束后,加到含EB的1%琼脂糖凝胶电泳检测。
1.4.4 克隆与鉴定
采用凝胶回收试剂盒进行PCR产物的纯化回收,操作方法按上海华舜生物技术有限公司凝胶回收试剂盒操作说明书进行。纯化PCR产物与pMD18-T载体连接,并转化TOP10感受态细胞,于含氨苄青霉素的LB琼脂平板,培养过夜。筛选阳性重组克隆,送上海invitrogen公司测序。应用DNAStar软件对C48-102 omp A基因的测序结果与P52、PM 70、T931317、T94289 进行比对分析。
1.5 原核表达载体的构建及鉴定
将扩增去信号肽的omp A用BamH I和Sal I酶切,同时用BamH I和Sal I酶切pPRO-EX-Htb质粒,用DNA胶回收试剂盒将酶切的扩增去信号肽的omp A和pPRO-EX-Htb回收,操作方法按试剂盒操作说明书进行。回收后的pPRO-EX-Htb载体与omp A基因片段连接,将连接产物转化大肠杆菌TOP10,挑取转化子,小提质粒,用BamH I和Sal I酶切鉴定,正确的重组质粒Htb-omp A送上海invitrogen公司测序。
1.6 omp A基因的表达及SDS-PAGE分析
取测序正确的重组质粒Htb-omp A转化BL21(DE3)感受态细胞,挑取单个菌落,37℃振荡培养至OD600值 0.4~0.6,加入 IPTG 至终浓度为 1 mmol·L-1,诱导表达5 h,同时设空白载体对照。用12%聚丙烯酰胺凝胶进行SDS-PAGE电泳。
1.7 Western-blot分析
按常规方法转膜,转移后的NC膜在5%脱脂乳中封闭过夜,将膜浸入1∶50用5%脱脂乳稀释的鸭抗多杀性巴氏杆菌阳性血清,37℃孵育1 h,用PBS洗涤3次,每次10 min,再加入到1∶2500倍稀释的HRP标记的羊抗鸭IgG中,37℃孵育1 h,用PBS洗涤4次,以二氨基联苯氨(DAB)为底物显色,观察结果。
2 结果
2.1 omp A基因的扩增与克隆
利用引物PAF2和PAR2成功扩增了ompA全基因片段,扩增片段大小为1062 bp(见图1)。利用截断信号肽引物pPMEA2和pEPMAR1扩增片段大小为975 bp,编码324个氨基酸(具体结果略)。
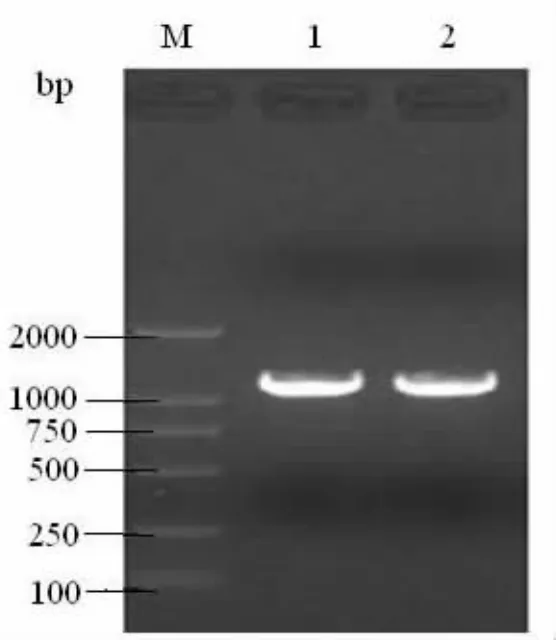
图1 Omp A全基因的PCR扩增Fig.1 PCR ampification of omp A gene
2.2 omp A的序列分析
C48-102 与 GenBank 中 P52、PM 70、T931317、T94289等多种血清型多杀性巴氏杆菌的omp A基因序列比对结果表明:在核苷酸水平上同源性为89.0%~98.9%;在氨基酸水平上同源性为90.7%~99.2%。
通过生物学软件比对Omp A氨基序列发现,C48-102株Omp A蛋白全长为1062个氨基酸,C48-102株Omp A氨基酸序列只与B型多杀性巴氏杆菌P52存在部分的缺失,即63-64位、151-153位。
2.3 原核表达重组质粒的构建
利用引物pEPMAF1和pEPMAFR1扩增的去信号肽的omp A基因与pPRO-EX-Htb构建的重组质粒Htb-omp A,用BamH I和SalⅠ双酶切得到约1000 bp目的条带,鉴定结果见图2。同时,将重组质粒Htb-omp A送上海invitrogen公司进行测序,与原测序结果一致。
2.4 omp A基因的原核表达及Western-blot检测
将重组质粒Htb-omp A转化BL21,用IPTG诱导后进行SDS-PAGE电泳,在大约35 kDa处有一条明显的表达带,与预期的分子量大小相符合(图3A)。Western-blot的结果表明,表达的蛋白具有较好的抗原性(图3B)。

图3 Omp A表达产物的SDS-PAGE和Western-blot检测结果Fig.3 SDS-PAGE and Western-blot analysis of the recombinant protein Omp A
3 讨论
本研究采用PCR技术成功扩增了鸭多杀性巴氏杆菌C48-102株omp A基因,整个ORF为1062 bp,编码354个氨基酸,利用生物学软件对omp A基因序列进行同源性分析发现,C48-102菌株与其余已发表的不同血清型的多杀性巴氏杆菌P52、PM 70、T931317、T94289的序列比对结果表明:omp A基因在核苷酸水平上同源性为89.0%~98.9%;在氨基酸水平上同源性为90.7%~99.2%;C48-102株Omp A氨基酸序列只与B型多杀性巴氏杆菌P52株存在部分的缺失,血清B型P52株omp A全长1077 bp,比PM70和C48-102都长15 bp,多编码4个氨基酸,鉴于GenBank中多杀性巴氏杆菌的omp A的序列有限,这与多杀性巴氏杆菌的血清型和毒力的相关性有待于进一步研究。
近年来,外膜蛋白对细菌致病机理和免疫性作用机理的研究取得了很大的进展,这将有助于解释外膜蛋白诱发保护性反应的机理,以及外膜蛋白在诱发免疫应答时与免疫细胞的相互作用。Omp A蛋白为跨膜蛋白,有研究表明,该蛋白除了具有维持外膜结构的作用外,其主要作用是在细菌感染早期与细胞基质相互作用,定植于宿主细胞[7]。外膜蛋白A序列具有很高的保守性,良好的免疫原性,可刺激体液免疫和细胞免疫[8]。据报道,重组的Omp A蛋白能够引起强烈的Th2类型的免疫反应,具有较高水平的IgG抗体产生等特点[7]。这些均表明该蛋白对禽巴氏杆菌的研究有着较深的理论基础,为筛选多杀性巴氏杆菌omp A基因缺失株奠定基础。
本研究所表达的成熟的Omp A蛋白是革兰氏阴性菌外膜蛋白的一种重要成分。全基因表达产物由于携带有某些碱基干扰大肠杆菌的正常表达,这可能是由于Omp A蛋白整合到大肠杆菌外膜中,代替大肠杆菌外膜中原有的蛋白而发挥作用,从而使得大肠杆菌无法正常表达,因此截断前90个碱基的信号肽序列后,对大肠杆菌不产生任何干扰作用,外膜蛋白A在大肠杆菌中表达。
利用基因技术制备重组蛋白,关键是获得能够具有活性的单一的目的蛋白。本研究选择pPROEX-Htb表达载体,该载体含有一段编码6个组氨酸的基因,可与重组蛋白进行高效融合表达,利用重组蛋白上组氨酸残基能与Ni2+结合的特性,该蛋白能够用His标签蛋白柱式纯化系统进行纯化,这种解离蛋白很容易被层析柱吸附,因此可以得到纯度较高的目的蛋白,并且所纯化的目的蛋白Omp A保持了抗原活性,为敲除omp A基因多杀性巴氏杆菌突变株的血清学检测奠定基础。
[1]B.W.卡尔尼.禽病学[M].11版.北京:中国农业出版社,2005.
[2]陆承平.兽医微生物学[M].北京:中国农业出版社,2003.
[3]程安春,汪铭书,陈孝跃,等.256株鸭源多杀性巴氏杆菌血清学鉴定及病原特性研究[J].中国兽医科技.1997,27(7):13-15.
[4]陈笃生,陈登杰,邓培芳,等.四川省畜禽多杀性巴氏杆菌菌体抗原的血清学鉴定[J].中国兽医科技,1987(4):28-29.
[5]Lin.J,Huang,.S,Zhang.Q.Outer membrane proteins:key players for bacterial adaptation in host niches[J].Microbes Infect,2002,4(3):325-331.
[6]Davies RL,Lee I.Sequence diversity and molecular evolution of the heat-modifiable outer membrane protein gene(omp A)of Mannheimia(Pasteurella)haemolytica,Mannheimia glucosidal, and Pasteurella trehalosi[J].Bacteriol,2004,186(17):5741-5752.
[7]Dabo SM,Confer A,Montelongo M.Confer.Molecular and immunological characterization of Pasteurella multocida serotype A:3 Omp A :evidence of its role in P.multocida interaction with extracellular matrix molecules[J].Microbial Pathogenesis,2003,35(4):147-157.
[8]Robert L.Davies,Inkyoung Lee.Sequence Diversity and MolecularEvolution ofthe Heat-Modifiable Outer Membrane Protein Gene(omp A)ofMannheimia(Pasteurella) haemolytica,Mannheimia glucosida,and Pasteurella trehalosi[J].J Bacteriol,2004; 186(17):5741-5752.
