电化学法制备聚苯胺网络结构及其应用*
——一个由科研发展起来的综合创新型化学实验
2010-07-02张雷杨良准
张雷杨良准
(上海师范大学生命与环境科学学院化学系 上海200234)
电化学法制备聚苯胺网络结构及其应用*
——一个由科研发展起来的综合创新型化学实验
张雷**杨良准
(上海师范大学生命与环境科学学院化学系 上海200234)
用三步递减恒电流电化学氧化法在对氨基苯甲酸功能化的玻碳电极表面原位生成三维聚苯胺纳米线状网络结构(PAN)。用扫描电子显微镜、红外光谱、紫外光谱及电化学方法对PAN的结构和性能进行了表征。
为适应大学化学实验课程中综合创新型实验教学改革的需要,教师应不断设计出理论合理、表征方法(技术)先进、并能激发学生创造潜能的综合创新型实验。这样的新型实验应当是前沿性与基础性、新颖性与易操作性、全面性与综合性相结合的能全面综合地运用学生所学化学知识且难度适中的实验。我们结合科研工作开发的综合创新型教学实验——电化学法制备聚苯胺网络结构及其应用,体现了“合成制备→分析表征→实际应用”的综合思维模式,使学生能从各分支学科的结合上学习解决综合性问题的能力,使科学思维能力和创新意识得到进一步的培养。
1 实验目的
了解纳米化学的发展和意义,掌握电化学方法制备聚苯胺(PAN)线状网络结构的方法和原理,学习红外光谱(FT-IR)、紫外可见光谱(UV-vis)、扫描电子显微镜(SEM)及电化学工作站的工作原理、使用方法及如何根据这些表征结果对PAN的结构和性能进行分析。
2 实验原理
本实验以玻碳电极(GCE)为工作电极,首先采用循环伏安法将对氨基苯甲酸(ABA)共价键合在GCE表面,然后采用三步递减恒电流电化学氧化法制备PAN三维网络结构。从而得到ABA掺杂的PAN复合膜修饰的GCE(记为PAN-ABA/GCE)。由于ABA的掺杂作用,PAN在中性介质中仍具有电化学活性,由此,可用于对抗坏血酸(AA)的催化氧化。
3 仪器与试剂
试剂:对氨基苯甲酸(Sigma),苯胺(Sigma),抗坏血酸(Sigma),N-甲基吡咯烷酮(NMP,Sigma),硫酸溶液(pH 1~3),0.1mol/L醋酸-醋酸钠缓冲液(pH 4~5),0.1mol/L磷酸缓冲液(PBS,pH 6~8)以及0.1mol/L的硼酸-氢氧化钠缓冲液(pH 9.0)。
仪器:Nicolet520红外光谱仪;JXA 840扫描电子显微镜;CARY 500 UV-vis光谱仪。电化学实验均在CHI 600B(USA)电化学工作站上进行。工作电极为玻碳电极(GCE,直径= 3.0mm)及PAN-ABA/GCE,参比电极为Ag/AgCl,盘状铂丝(Pt)为对电极。
4 实验内容
4.1 复合膜的制备
4.1.1 ABA在GCE上的共价固载
将GCE依次用0.5、0.03μm的氧化铝湿粉抛光,分别放入乙醇、二次蒸馏水中超声清洗各3min,然后将电极置于0.5mol/L硫酸溶液中,在-0.5~1.5V电位范围内以0.1V/s速度扫描,直到循环伏安图稳定,取出,用二次蒸馏水清洗后干燥备用。将上述处理后的GCE置于ABA(0.001mol/L)的乙腈溶液中(含有0.1mol/L NaCIO4),用循环伏安法以20mV/s扫速在0.50~1.70V电位范围内循环扫描8圈(图1),然后在乙醇和二次水中分别超声清洗2min以除去吸附在电极表面未反应的物质,从而制得ABA功能化的GCE(记为ABA/GCE)[1]。

图1 ABA的循环伏安图
4.1.2 三维PAN线状网络结构的制备
将ABA/GCE置于含有0.01mol/L苯胺的H2SO4溶液(0.1mol/L)中进行三步递减恒电流聚合。即先施加一个大的电解电流,一定时间后再在较小的电流下进行电解,最后,再施加一个更小的电流进行电解。本实验所采用的电解电流及相应的电解时间分别为:先在0.08mA/cm2电流密度下电解0.5h,然后在0.04mA/cm2电流密度下电解1h,最后再在0.02mA/cm2电流密度下电解1h。聚合完毕后,用0.1mol/L H2SO4对电极进行反复冲洗,以除去膜中未反应的单体及低聚物,即得PAN-ABA/GCE。观察并记录复合膜的外观形貌。
4.2 复合膜表征
4.2.1 复合膜的SEM表征
PAN-ABA复合膜呈深绿色,表面光滑,厚度均匀。图2为GCE表面PAN-ABA复合膜的SEM照片。由图2可见,PAN-ABA复合膜呈紧密的不规则三维网状结构,接点之间距离大于600nm,线直径为80~250nm。
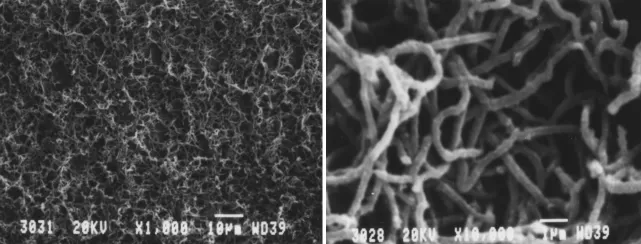
图2 三维PAN线状网络结构
4.2.2 PAN的FT-IR表征
将电极表面的PAN溶于NMP中,将溶解有PAN的NMP溶液滴到KBr片上,进行红外测定(图3)。其中,位于4000~2000 cm-1之间的宽峰表明在导电聚合物中自由电子的传递[2];位于3450 cm-1处的宽峰为N—H的伸缩振动[3];位于1559.4和1488.4 cm-1处的峰分别为苯(环)型和苯醌型结构的伸缩振动[3];位于1305.3 cm-1处C—H峰常用来估价聚合物中电子传递的特性,所以该处的强吸收表示共聚物有较好的导电性,这与4000~2000 cm-1之间的表示电子传递的宽峰相一致[4];位于1120.1 cm-1和810.4 cm-1处的峰表示聚合物链中的苯环存在有1,4-二取代和1,2,4-三取代结构,这表示苯胺在聚合时是头尾相接的结构[5]。
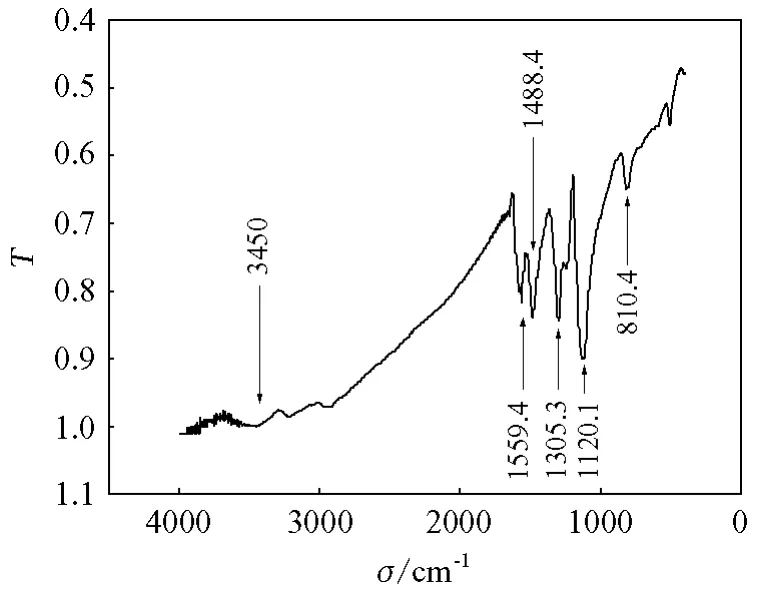
图3 PAN的FT-IR光谱图
4.2.3 PAN的UV-vis表征
图4为PAN的NMP溶液的UV-vis光谱。由图4可以看出,对应于333.8nm处的峰为PAN的π-π*跃迁,对应于639.7nm处的峰为PAN结构(图5)中苯-苯(1A)和苯-醌(2A)结构之间的相互转换。
4.3 ABA掺杂PAN的电化学活性
图6为PAN-ABA/GCE在不同pH缓冲溶液中的循环伏安图。由图6可以看出,在强酸性介质中(pH 1),PAN呈现3对氧化还原波,其中位于0.1 V和0.7 V处的两对峰分别对应LEB/EB和EB/PNB的氧化还原转变,而位于中间的一对峰是由PAN链的不完整性/缺陷造成的[6]。随着溶液pH增加(pH 3),中间的一对峰基本消失。当pH≥5时,位于0.1V和0.7V的两对峰“合并”为一对峰,对应于LEB/PNB的氧化还原,这是由于EB/PNB的氧化还原反应受pH的影响很大。当缓冲溶液的pH增至9时,仍可以看到PAN的氧化还原行为。由此可知,ABA掺杂的PAN在很宽的pH范围内有良好的电化学活性,这为其实际应用创造了条件。PAN在中性甚至弱碱性介质中良好的电化学活性主要是由于ABA掺杂。ABA分子中的羧酸基团可在聚合物内部形成局部的酸碱平衡,这种平衡具有很好的稳定性,可使其在一定pH范围的介质中保持稳定,因而可使PAN的导电性基本不受外部介质酸碱度的影响,从而使其在很宽的pH范围内都有电化学活性。
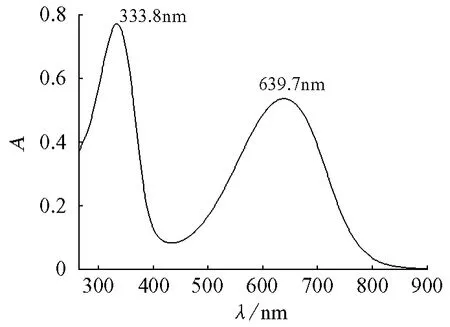
图4 PAN的UV-vis光谱图
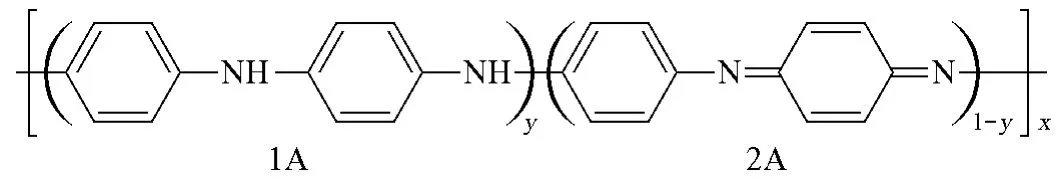
图5 PAN的结构图
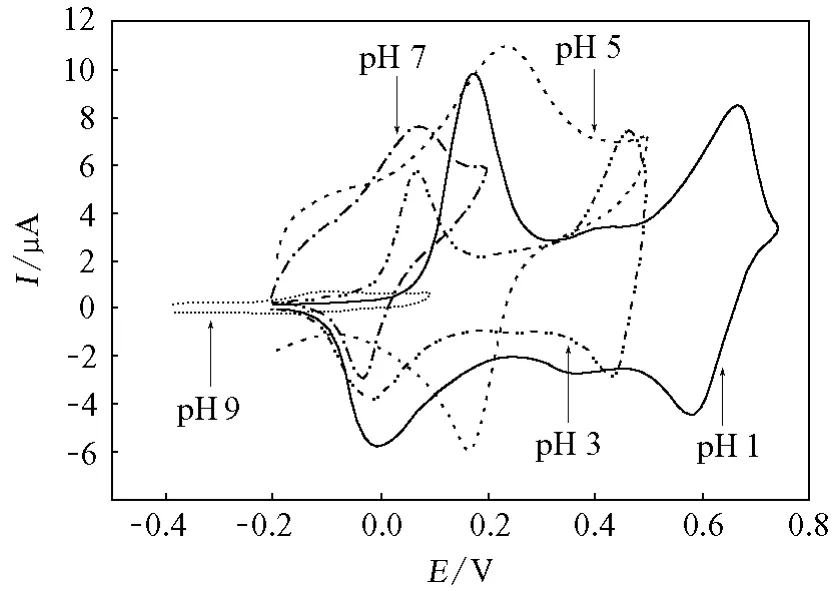
图6 PAN-ABA/GCE在不同pH缓冲溶液中的循环伏安图
4.4 AA在PAN-ABA/GCE上的电催化氧化
图7A给出了AA(0.01mol/L)在GCE(虚线)和PAN-ABA/GCE(实线)上的循环伏安图。由图7A可知,在GCE电极上,AA的氧化峰电位位于0.63V(Ep-Ep/2=0.23 V),峰电流为12.5μA;而在PAN-ABA/GCE上,AA呈现一尖锐的氧化峰,峰电位负移到0.34V(Ep-Ep/2= 0.10V),峰电流(28.7μA)明显增加。电流的增加和氧化过电位的负移(0.29V)表明PANABA/GCE对AA的氧化有催化作用,加快了AA在PAN-ABA/GCE上的电子转移速率,改善了AA与电极之间电子转移的可逆性。图7B为不同浓度的AA在PAN-ABA/GCE上的循环伏安图,图7B内插图表示的是AA的氧化峰电流与其浓度之间的关系。由图7B可以看到,随着AA浓度增加,其氧化峰电流呈线性增加,线性范围为5~50mmol·L-1,工作曲线为Ip,a= 6.270+2.003c,相关系数为0.998。
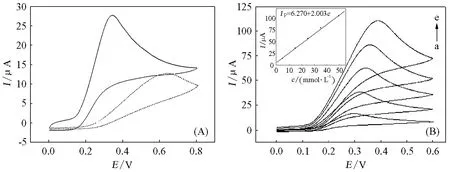
图7 AA的循环伏安图
5 思考题
①目前PAN纳米线的合成常采用模版法[7-9],而本实验在无模版辅助下采用电化学方法制备PAN三维线状网络结构,可让学生结合三步递减恒电流电化学氧化法的特点来解释PAN三维线状网络结构的形成机制。
②PAN通常在酸性介质中(pH≤3)才具有电化学活性,这限制了其在实际中的应用,尤其是在生物分析中的应用。为了拓宽PAN的应用范围,研究者采用多种方法制得了掺杂态PAN。在教学中可让学生广泛查阅文献,了解掺杂态PAN的制备方法以及本实验的掺杂方法具有的优点;
③本实验以AA为靶物考察PAN修饰电极在实际中的应用。可让学生通过检索PAN的用途,使他们对PAN这类实用的聚合物有全面的认识。
本实验涉及到有机化学、分析化学及结构化学等基础学科的基本理论知识,通过综合运用多种操作方法,使用多种仪器,可以提高学生对各种现代化仪器的认知能力和操作能力;同时本实验又涉及到前沿研究的热点——纳米科学,有利于激发学生的学习热情和培养学生的创新意识。
由于本实验内容比较丰富,在开设过程中,各校可根据各自教学内容与实验时数自行取舍。此实验在我校化学实验课程中已进行了5年实践,效果良好,深受学生欢迎。
[1] Zhang L,Jiang X E,Dong S J.Biosensors and Bioelectronics,2005,21(2):337
[2] Cao Y,Li S,Xue Z,et al.Synthetic Metals,1986,16(3):305
[3] Patil R C,Ahmed SM,Shiigi H,et al.Journal of Polymer Science:PartA:Polymer Chemistry,1999,37(24):4596
[4] Chiang JC,Macdiarmid A G.Synthetic Metals,1986,13(1~3):193
[5] Bellamy L J.The Infrared Spectra of Complex Molecules.London:Chapman&Hall,1975
[6] LapkowskiM.Synthetic Metals,1990,35(1~2):169
[7] Wang C,Wang Z,LiM,et al.Chemistry Physical Letter,2001,341(5~6):431
[8] Wei Z,Zhang Z,Wan M.Langmuir,2002,18(3):917
[9] Huang L,Wang Z,Wang H,et al.Journal of Material Chemistry,2002,12(2):388
上海师范大学面上项目(SK200719);上海师范大学分析化学重点学科(DZL706)
** 通讯联系人,E-mail:chmzhanglei@gmail.com
