纳米金刚石药物输运系统的研究
2010-06-30张小勇李文新
李 静 诸 颖 张小勇 李文新 黄 庆
1 (中国科学院上海应用物理研究所 上海 201800)
2 (中国科学院研究生院 北京 100049)
碳纳米材料已广泛应用于各领域中的纳米科技研究,构建纳米药物输运系统是碳纳米材料在生物医药领域的一个重要研究方向。碳纳米管以及修饰有各种化学分子的碳纳米管复合物,能有效地被细胞摄取[1−3]。另一方面,碳纳米管表面特殊的结构,使许多化学分子或生物大分子能以共价或非共价方式连接在碳纳米管上,组成碳纳米管复合物。因此,碳纳米管能成为一种有效的细胞内药物输运载体,一些很难穿越细胞膜的小分子药物(多肽、蛋白质药物或 DNA),可借助碳纳米管有效进入细胞,从而增强它们的药效[4−6]。除载带的药物外,碳纳米管的外壁还能修饰一些功能化基团,如荧光素、靶向基团等。以碳纳米管为平台构建的纳米药物输运系统,能同时发挥多种功能,即药物的靶向、细胞内输入的高效、可控或缓释、在生命体系中可视化检测与研究等,达到降低用药量、增强药效、减少药物毒副作用等目的[7−9],这是新一代复合药物研制的重要发展方向。
近年来,纳米金刚石(NDs)作为药物载体的研究已引起关注。NDs具有化学惰性,研究结果表明,NDs对细胞无明显的细胞毒性,显示出良好的生物相容性[10−12]。研究发现,无机分子 NaCl和 NaOH能促进药物在NDs上的药物负载量[13−16]。因此,水溶性差的药物分子能被NDs有效载带,并转运至细胞内而高效行使其生物效应。目前已有就多种癌症的化疗剂和糖尿病治疗药物,进行了 NDs载带研究,每次仅载带一种药物分子。NDs可否成为像碳纳米管那样的同时载带若干不同功能分子的多功能药物输运系统,此类研究尚未见报道。本文尝试了抗癌药物 10-羟基喜树碱(HCPT)、异硫氰酸荧光素(FITC)和肿瘤细胞靶向分子转铁蛋白(TF)在NDs上的负载,研究了负载多种功能基团的金刚石复合物的细胞摄取,以及复合物对肿瘤Hela细胞的毒性,目的在于探索以 NDs为平台构建多功能药物靶向输运系统的可能性。
1 实验材料与方法
1.1 材料及其表征
采用爆炸法合成的 NDs(甘肃金石纳米材料有限公司),单颗粒尺寸2–10 nm,未经处理直接用于实验。将一定量的 NDs分散在纯水溶液中,超声30 min以彻底分散,得到分散性良好稳定的ND储存液。用荷兰 Philips公司生产的透射电镜(TEM,CM120)表征100 µg/mL的NDs水溶液,红外光谱(FT-IR,Nicolet Avatar-360)表征NDs干粉。
1.2 异硫氰酸荧光素(FITC)在NDs上的吸附
将2 mg/mL的NDs水溶液与溶解于DMSO溶液的FITC(1 mg/mL)混合,超声10 min,室温震荡24 h,将混合液离心,弃上清液,清洗沉淀三次,得到FITC-ND复合物,用于吸附HCPT及TF后的荧光显微镜(德国Zeiss公司,Axioskop2 plus)观察实验。
1.3 10-羟基喜树碱(HCPT)在NDs上的吸附
将HCPT分散在纯水中,并加入适量NaOH助溶,所得HCPT溶液(4 mg/mL, pH=8.2)与2 mg/mL的 NDs水悬液混合后,在 25℃条件下震荡 3 d,13000 r/min离心1 h,吸出上清液待测。不含NDs的 HCPT溶液为对照组,紫外光谱仪(UV-spectra,Hitachi U-3010)扫描实验组和对照组在300–500 nm范围内的光谱,基于实验组与对照组在380 nm处的吸光值差异,计算HCPT在NDs上的3 d吸附量。
将制得的FITC-ND复合物分散于纯水中,按上述方法吸附HCPT,制得HCPT-FITC-ND复合物备用。
1.4 转铁蛋白(TF)在NDs上的吸附
将转铁蛋白以 10%的终浓度,加入 HCPT-ND及HCPT-FITC-ND复合物悬液中,并短时超声混合。为使TF充分负载于复合物上,将混合液置于25℃环境下震荡4 h,依上述方法离心清洗分散后,得到TF-HCPT-ND及TF-HCPT-FITC复合物。
1.5 复合物TF-HCPT-ND的细胞存活率检测
Hela细胞以105cells/mL的密度接种于24孔板中,培养过夜,将HCPT-ND、TF-HCPT-ND复合物分散于细胞培养基,按实验要求加入24孔板,使孔中复合物终浓度达100 µg/mL(以ND计)。对照组孔中加入 100 µg/mL NDs,或 50 µg/mL HCPT。此时,复合物组的HCPT剂量基本接近对照组。24 h培养,MTT法检测Hela细胞24 h存活率。所有实验均重复三次。
1.6 复合物FITC-HCPT-NDs孵育细胞后荧光镜下观察
NDs吸附FITC后,按前述方法吸附HCPT及TF,分别得到复合物HCPT-FITC-ND及TF-HCPTFITC-ND。Hela细胞培养过夜,使其充分贴壁,将两种复合物分别加入培养体系中,孵育3、8、24 h后用PBS小心冲洗细胞,尽量去除未被细胞吞噬的复合物,将细胞置于倒置荧光显微镜(Zeiss,Axioskop 2)下观察。
2 实验结果
2.1 表征
本文所用NDs悬浮于纯水中,很易超声分散,且不易沉降。TEM表征结果显示(图1a),NDs大多以团聚的颗粒状存在,尺寸40–200 nm。红外光谱表征NDs的结果如图1(b),所得光谱峰位与文献[13]纳米金刚石特征峰位一致。

图1 纳米金刚石的表征 (a)透射电镜图像,(b)红外光谱Fig.1 TEM image (a) and FT-IR spectra (b) of the NDs.
2.2 NDs对HCPT吸附量测定
少量的NaOH能显著提高HCPT的水溶解度,紫外光谱显示,加入NaOH后HCPT在380 nm处的特征峰未被改变,所以可借此提高HCPT在NDs上的吸附[16]。紫外光谱对 NDs吸附前后的 HCPT溶液进行检测,结果显示,吸附后的HCPT溶液吸光值明显低于未吸附溶液(图 2),提示了 HCPT在NDs上的吸附。测量吸附前后样品在380 nm处的吸光值变化,计算出HCPT在NDs上的吸附量。本文将NDs与HCPT共同混合震荡孵育3天,得到吸附量为42.5%。同样方法得到HCPT在FITC-ND上的吸附量为41.3%,与HCPT在ND上的吸附量差别不大。
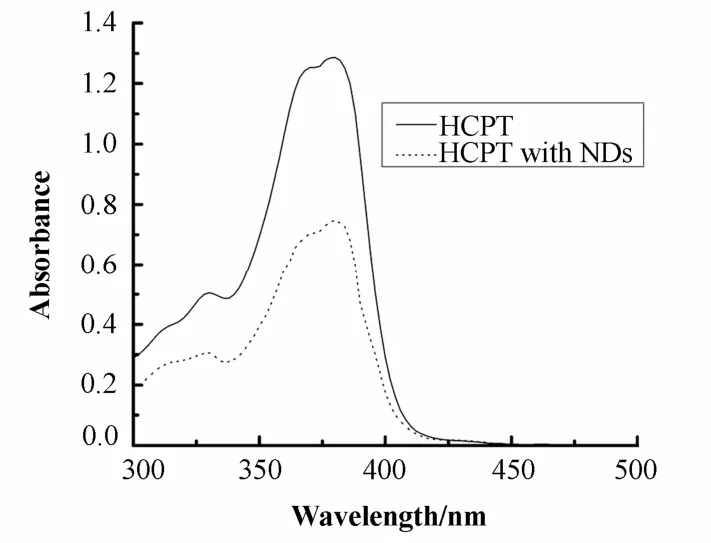
图2 HCPT被NDs吸附前后的紫外光谱比较Fig.2 UV-Vis spectra of HCPT before and after adsorption with NDs for 72 h.
2.3 复合物细胞存活率检测
纳米颗粒能通过不同的途径进入细胞,如吞噬作用、液相内吞及受体介导的胞吞作用。因此,设置两种复合物组(HCPT-ND、TF-HCPT-ND)以比较靶向基团转铁蛋白的作用。细胞 MTT存活率检测结果表明(图3),NDs对细胞无毒性,比较单独药物组HCPT及复合物HCPT-ND、TF-HCPT-ND结果,复合物组的药效明显高于单独药物组,证明了NDs吸附HCPT后,将其有效带入胞内发挥药效。各组比较,毒性最强的是TF-HCPT-ND,提示复合物上的TF很可能与Hela 细胞表面的TF受体结合,通过 TF受体介导的内吞作用,使更多的复合物进入细胞。实验数据采用 SPSS11.0软件进行统计学分析,各组与对照组比较P<0.05;TF-HCPT-ND组与HCPT-ND组相比,存活率下降 9.03%,差异显著(P<0.05)。
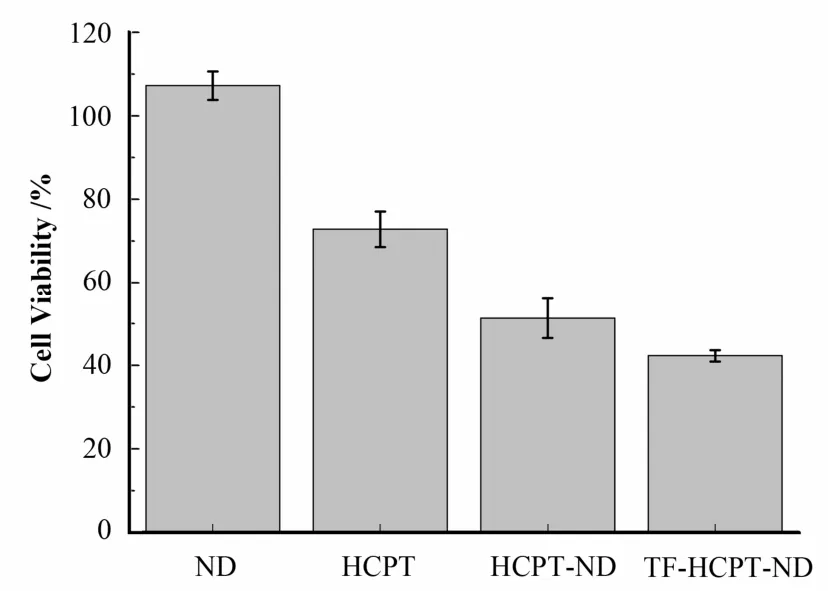
图3 ND、HCPT、HCPT-ND、TF-HCPT-ND的24 h细胞存活率检测Fig.3 Viability of Hela cells treated with ND, HCPT,HCPT-ND and TF- HCPT-ND for 24 h.All data were averaged from three parallel experiments.
2.4 荧光显微镜下观察
FITC标记的复合物孵育细胞后,荧光镜下观察细胞的形态如图 4所示。由图 4,孵育 3 h后,HCPT-FITC-ND组可见细胞轮廓及较淡的荧光,说明复合物在细胞膜上有少量粘附,而TF-HCPT-FITC-ND 组的荧光强度明显高于HCPT-FITC-ND组,两种复合物孵育细胞24 h后,镜下观察看到约大半细胞形态变圆,胞膜不完整,证明细胞死亡,TF-HCPT-FITC-ND组死亡细胞略多于HCPT-FITC-ND组。观察结果与细胞存活率结果相符。
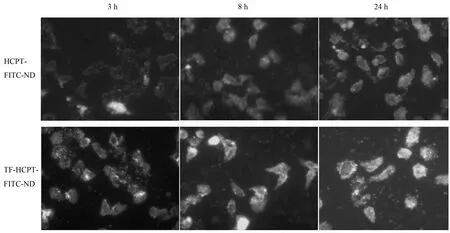
图4 复合物TF-HCPT-FITC-ND及HCPT-FITC-ND孵育细胞不同时间后的荧光显微镜图像Fig.4 Fluorescence images of Hela cells incubated with TF-HCPT-FITC-ND and HCPT-FITC-ND after incubation of different time.
3 讨论
细胞存活率检测结果表明,ND无显著细胞毒性,单独HCPT的毒性也较小,而药物-纳米金刚石复合物的毒性高,结果与文献[16]一致,证明 ND能有效吸附HCPT并将其带入胞内发挥药效。另外,载有TF的复合物毒性最强,说明TF发挥了靶向作用。我们选用 TF作为靶向分子,是因为在多种癌细胞表面,都存在TF受体的过表达,因此,TF能被多种癌细胞特异性识别,与 TF受体结合,激活TF受体介导的胞吞作用[17−19]。这为复合物的细胞摄取提供了更高效的途径。荧光显微镜下观察结果显示,TF-HCPT-FITC-ND组的荧光强度明显高于HCPT-FITC-ND组,说明当TF-HCPT-ND孵育细胞3 h后,复合物上的TF已与细胞膜上的TF受体结合,通过受体介导的细胞内吞途径,使更多的复合物进入到胞内。此结果与细胞存活率结果相符。
在现有药物载体研究中,碳纳米管[4−9,20,21]、石墨烯[22−24]、树状高分子[25−28]等材料均具有特殊的结构及丰富的化学活性(表层分布的大量的官能基团),利用这些化学性质可将多种药物和其他功能基团修饰上去,使它们成为多功能的药物载体。纳米金刚石修饰多种基团的工作尚处于起步阶段[29−32],可能是因为纳米金刚石的化学惰性,使其多功能基团的同时修饰相当困难,NDs的多基团修饰需另辟蹊径。
我们在NDs吸附多种分子的初期实验中发现,其对不同大小的分子吸附行为的差异较大,如细胞全培养液中的蛋白类分子BSA在NDs上的吸附1 h即达平衡,而较小药物分子HCPT至少需5天才能达到平衡。由此提出如下的NDs吸附模型:当NDs分散于培养基中,形成了团聚,这些团聚物具有与外界相通、尺寸不一的纳米通道或小孔,当小分子药物(如HCPT)与NDs团聚物接触后,慢慢进入团聚物内部的孔道中,故HCPT在NDs上充分负载需较长时间,吸附量也相对较高;而BSA类的蛋白质分子因分子大而不能进入孔道,则更多地被吸附在团聚物表面,故短时间内即达平衡。
根据这种团聚物的特殊空间构型及对多种分子较强的吸附能力,我们设想,NDs有可能以不同于碳纳米管、氧化石墨烯和树状高分子的机制来组装复合药物输运系统。本实验基于所提出的假设,让较小的分子先进入纳米金刚石团聚物内部,大的分子吸附在外部,从小到大按层组装药物复合系统。实验证明,此复合系统具有药物活性、荧光及靶向功能,且药效也提高了,证明了我们提出假设的合理性和可靠性。
本文基于纳米金刚石的团簇多孔特性,成功组装具有多种功能的纳米金刚石复合药物输运系统,达到预期效果,开创了纳米金刚石药物输运系统的研制新途径。
1 Pantarotto D, BriandJ P, Prato M,et al. Chem Commun,2004, 1: 16–17
2 Kostarelos K, Lacerda L, Pastorin G,et al. Nat Nanotechnol, 2007, 2(2): 108–113
3 ZHU Ying, LI Wenxin, LI Qingnuan,et al. Carbon, 2009,47(5): 1351–1358
4 Kam N W S, Jessop T C, Wender P A,et al. J Am Chem Soc, 2004, 126(22): 6850–6851
5 CHEN Jinyi, CHEN Shuyi, ZHAO Xianrui,et al. J Am Chem Soc, 2008, 130(49): 16778–16785
6 Kam N W S, Liu Z, Dai H J. Angew Chem Int Ed, 2006,118(4): 591–595
7 Kam N W S, O’Connell M, Wisdom J A,et al. P Natl Acad Sci, 2005, 102(33): 11600–11605
8 Liu Z, Sun X M, Nakayama-Ratchford N,et al. ACS Nano, 2007, 1(1): 50–56
9 ZHANG Xiaoke, MENG Lingjie, LU Qinghua,et al.Biomaterials, 2009, 30(30): 6041–6047
10 Schrand A M, Huang H, Carlson C,et al. J Phys Chem B,2007, 111(1): 2–7
11 Schrand A M, Dai L, Schlager J J,et al. Diam Relat Mater,2007, 16(12): 2118–2123
12 Liu K K, Cheng C L, Chang C C,et al. Nanotechnology,2007, 18(32): 325102–325111
13 Huang H, Pierstorff E, Osawa E,et al. Nano Lett, 2007,7(11): 3305–3314
14 Chen M, Pierstorff E D, Lam R,et al. ACS Nano, 2009,3(7): 2016–2022
15 Shimkunas R A, Robinson E, Lam R,et al. Biomaterials,2009, 30(29): 5720–5728
16 LI Jing, ZHU Ying, LI Wenxin,et al. Biomaterials, 2010,31(32): 8410–8418
17 QIAN Zhongming, LI Hongyan, SUN Hongzhe,et al.Pharmacol Rev, 2002, 54(4): 561–587
18 YANG Peihui, SUN Xuesong, CHIU Jenfu,et al.Bioconjugate Chem, 2005, 16(3): 494–496
19 HONG Minghuang, ZHU Saijie, JIANG Yanyan,et al. J Control Release, 2010, 141(1): 22–29
20 LI Ruibin, WU Ren’an, ZHAO Liang,et al. ACS Nano,2010, 4(3): 1399–1408
21 Bhirde A A, Patel V, Gavard J,et al. ACS Nano, 2009,3(2): 307–316
22 WANG Ying, LI Zhaohui, HU Dehong,et al. J Am Chem Soc, 2010, 132(27): 9274–9276
23 ZHANG Liming, XIA Jinggaung, ZHAO Qinghuan,et al.Small, 2010, 6(4): 537–544
24 Sun X M, Liu Z, Welsher K,et al. Nano Res, 2008, 1:203–212
25 Guillaudeu S J, Fox M E, Haidar Y M,et al. Bioconjugate Chem, 2008, 19(2): 461–469
26 Singh P, Gupta U, Asthana A,et al, Bioconjugate Chem,2008, 19(11): 2239–2252
27 HU Jingjing, CHENG Yiyun, WU Qinglin,et al. J Phys Chem B, 2009, 113(31): 10650–10659
28 Dhanikula R S, Hildgen P. Bioconjugate Chem, 2006,17(1): 9–41
29 ZHANG Xueqing, Chen Mark, Lam R,et al.ACS Nano,2009, 3(9): 2609–2616
30 Liu K K, Chen F, Chen P Y,et al. Nanotechnology, 2008,19: 205102–205111
31 Roberto M, Mercedes A, Jose R H,et al. ACS Nano,2010, 4(1): 65–74
32 Krueger A, Stegk J, Liang Y,et al. Langmuir, 2008, 24(8):4200–4204
