80 MeV/u C-12离子诱变选育PHB高产菌株
2010-06-30薛林贵常思静武振华景春娥
薛林贵 赵 旭 常思静 张 红 武振华 景春娥
1(兰州交通大学化学与生物工程学院 兰州 730070)
2(中国科学院近代物理研究所 兰州 730000)
聚β-羟基丁酸酯(PHB)是微生物细胞内积累的一种贮能物质,可由多种微生物在碳氮比失衡的情况下合成,它不仅具有类似于塑料性质,如可拉丝、成膜等,还具有生物相容性和生物降解性,在工业、农业、食品、环保、医药等领域有广泛应用前景[1],但PHB的工业生产成本还远高于合成塑料。为此,国内外在PHB生产研究中做了大量工作,其中,通过诱变筛选PHB高产菌株,是非常有效的降低成本途径。常用的诱变方法主要有化学诱变和物理诱变,其中物理诱变的手段主要有紫外线、γ射线、X射线等低LET射线。重离子诱变是近年来发展起来的一种新方法。重离子属高LET辐射,其相对生物效应比低LET辐射大得多,能产生较高的突变率和较宽的变异谱,有利于选育生物新品种[2]。重离子辐照有可能使一些其它方法很难取得诱变效果的工业微生物,发生有经济意义的突变,为工业微生物诱变育种开辟新的途径[3]。本实验在兰州重离子加速器国家实验室的支持下,对PHB产生菌BacillusP-9进行不同辐照强度的诱变筛选研究,取得了十分有意义的结果。
1 材料和方法
1.1 材料
1.1.1 菌种
芽孢杆菌(BacillusP-9),由本校微生物工程研究室分离筛选获得。
1.1.2 仪器
落射荧光显微镜(宁波永新光学股份有限公司),紫外分光光度仪 UV2100(尤尼柯仪器有限公司),洁净工作台(苏州安泰空气技术有限公司),高温灭菌器DSX-280B(上海中安医疗器械厂)等。
1.1.3 培养基
(1) 斜面培养基(g/L):蛋白胨5.0,酵母膏1.0,甘油1.0,pH 7.0,121℃灭菌20 min。
(2) 平板培养基(g/L):蛋白胨5.0,酵母膏1.0,甘油10.0,pH 7.0,121℃灭菌20 min。
(3) 基础发酵培养基(g/L):蛋白胨5.0,酵母膏1.0,甘油 5.0,麦芽糖 5.0,pH 7.0,121℃灭菌 20 min。
1.2 方法
1.2.1 出发菌株生长曲线和PHB积累曲线
(1) 生长曲线测定:采用血球计数板法进行测定[4];
(2) PHB含量测定:采用硫酸法测定。浓硫酸在100℃加热条件下会使PHB降解为巴豆酸,巴豆酸在235 nm紫外光谱区有吸收峰,通过紫外分光光度仪测定其吸收值,对照PHB标准曲线计算PHB含量。
1.2.2 菌悬液的制备
取两环培养24 h的斜面培养物,接入50 mL种子培养基中,在温度为29℃,转速为150 r/min的恒温振荡培养箱中培养,随时检测菌液浓度,待菌液浓度达到108个⁄mL时,取2 mL菌悬液装入Φ30 mm皿中备用。
1.2.3 重离子辐照
12C6+束由中国科学院近代物理研究所兰州重离子研究装置(HIRFL)产生,引出能量为80 MeV/u,LET为35.5 keV/mm,吸收剂量率约为1 Gy/min,用空气电离室监测剂量。样品更换及剂量数据获取由计算机控制,将装有菌悬液的Φ30 mm皿固定于特制转盘,用Φ40 mm重离子束斑垂直辐照,剂量分别为2.5、5、10、15、20 Gy,每个剂量做三个平行。
1.2.4 致死率测定
将处理过的菌悬液稀释至105倍,吸取0.2 mL涂平板,根据长出菌落的数量计算致死率。
1.2.5 诱变菌株初筛
将经过辐照处理的菌液,稀释至 105倍,吸取0.2 mL涂布在固体平板培养基上,使每个培养皿中的菌落数量约为50个,每个剂量涂布20个平皿,共计菌落数约为1000个,在29℃的培养箱中培养96 h备用。尼罗蓝是一种荧光染料,能特异性地对PHB进行荧光染色。用尼罗蓝溶液对细胞进行染色,尼罗蓝随之渗入细胞,与胞内的PHB颗粒结合,在荧光显微镜下可观察到细胞内含有许多发橙黄色光的颗粒,这种颗粒即PHB,其大小、多少及发光强弱代表细胞中PHB的含量[5]。挑取培养好的菌落制成尼罗蓝染色装片,在荧光显微镜下观察,选取PHB颗粒较大、数量较多、荧光较强的菌株进行复筛。
1.2.6 诱变菌株复筛
根据初筛结果,从固体平板上挑取需要的单菌落接入试管斜面培养基,待长满后,分别取两环接入50 mL液体种子培养基中,29℃摇瓶培养24 h,再以2%的接种量分别接入50 mL液体发酵培养基中,29℃摇瓶培养96 h。以细胞量和PHB含量为指标,原始菌株为对照,每12 h取样,测定细菌总量和PHB含量,绘制PHB含量曲线和生长曲线,选出PHB含量较高的突变株检测其遗传稳定性。
1.2.7 稳定性检测
筛选出的菌株连续传代 8次,测定每一代的PHB产量,比较其变化。
1.2.8 胞内PHB颗粒成分分析
FT-VERTEX 70的全数字化红外光谱仪[6],德国Bruker公司;MERCURY 400 Plus的核磁共振仪[7],美国Varian公司。
2 结果与分析
2.1 Bacillus P-9和G15菌生长和PHB积累规律
采用摇瓶发酵培养,每12 h取样,测定细胞量和PHB的含量,重复三次取平均值,制作BacillusP-9和G15菌的生长曲线与PHB积累曲线(图1)。结果表明,BacillusP-9菌株在接种后的前24 h处于延迟期,24 h以后进入对数生长期,同时开始积累PHB,在84 h细胞进入稳定生长期。稳定生长期时,细胞量和PHB积累均为最大,即BacillusP-9的PHB积累与菌体细胞的生长是同步的,属于一步发酵类型[8]。108 h时BacillusP-9的细胞量为 2.408×108个/mL,PHB产量为1.25 g/L。对G15菌的生长和PHB积累规律进行研究发现,与P-9菌株相比较,该菌株进入对数期的时间明显缩短,在培养72 h后即进入稳定期,PHB产量在培养60 h时达到最大,结果如图2所示。
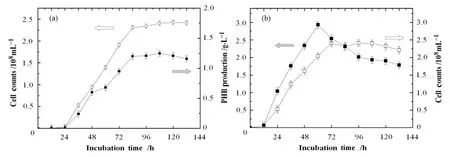
图1 Bacillus P-9菌株(a)及其G15诱变菌(b)的生长和PHB积累曲线Fig.1 Cell growth (□) and PHB production (■) curves of Bacillus P-9 strain (a) and the G15 mutant (b).
2.2 重离子辐照对菌株的影响
辐照剂量和致死率的关系(表1)表明,重离子辐照对BacillusP-9的致死率随剂量增加,5 Gy以上剂量的致死率上升趋缓,20 Gy时致死率达97.44%。一般而言,致死率大于90%的照射剂量常用作诱变育种的参考剂量[9]。由表1,辐照剂量在10–20 Gy的范围内,BacillusP-9的致死率都大于90%,因此,突变菌株的筛选应主要在此照射剂量范围内。

表1 重离子辐照对Bacillus P-9菌株生长的影响Table 1 Effect of 80 MeV/u 12C6+ irradiation on growth of Bacillus P-9.
2.3 PHB高产菌株的筛选
2.3.1 PHB高产菌株的初筛
辐照菌液经平板涂布培养后,根据菌落的大小、形状进行初步筛选,选出菌株用尼罗蓝染色作荧光显微镜观察,与原始菌株对比作进一步筛选。约从5000株菌株中筛选出18株生长与PHB积累较好的菌株,正突变率为 0.36%。由选出菌株的荧光照片(图2),筛选菌株的PHB颗粒明显多于出发菌株,颗粒的荧光强度也显著增强。选出菌株分别编号为G1、G2、G3、G4、…、G17、G18,接入斜面培养基培养,保存备用。
2.3.2 高产菌株的复筛
用摇瓶发酵法对原始菌株及上述 18株菌株进行培养,检测细胞内的PHB含量,最终筛选出编号为G15的菌株,其PHB产量最高,为2.93 g/L,这是出发菌株的1.5倍。
2.3.3 G15菌株的遗传稳定性
G15菌株进行稳定性研究表明(表2),连续传代3次,其PHB积累量仍保持在94.2%。

图2 荧光显微镜示菌体及PHB积累(1000×)Fig.2 Observation of the PHB accumulation under fluorescence microscope (1000×).

表2 G15遗传稳定性Table 2 The genetic stability of G15.
2.4 PHB定性分析
2.4.1 红外光谱分析
G15菌株产生的 PHB样品的红外光谱与标准品的相似(图3)。样品在波数1723 cm处有一强烈峰值,此为羧酸中羰基(c=0)的吸收峰,3436 cm处存在 O-H 伸缩振动,2976 cm–1、2935 cm–1、2874 cm–1处存在-CH3、-CH2、-CH振动,这些都是 PHB的特征峰;此外在1058–1287 cm间存在大量C-O振动,为聚酯的特征峰,红外光谱测定结果说明G15菌株胞内积累的聚合物为PHB。
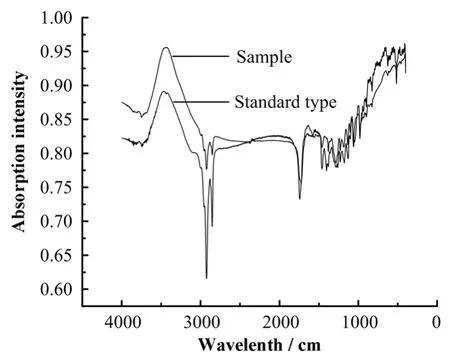
图3 红外吸收光谱Fig.3 Fourier transform infrared spectroscopy.
2.4.2 核磁共振检测
用核磁共振仪分析测定 PHB样品的碳链骨架结构,得到核磁共振碳谱,如图4(A)所示。4个主吸收峰分别位于 19.75、40.76、67.59、169.14,它们分别是由聚合物中的4种不同微电环境:-CH3、-CH2、-CH和C=O中的碳原子所产生的,77附近处的吸收峰是由溶剂CDCl3中的碳原子引起的,这一结果与 Jiang等[10]报道的基本一致。核磁共振氢谱如图4(B)所示,3个主吸收峰分别位于1.27、2.55和5.25,它们分别是由-CH3、-CH2和-CH中的氢原子震动引起的,其中-CH2中H周围的电子环境相对较为复杂,所以产生了较多的分裂,形成了多重峰(2.45、2.46、2.49、2.50、2.58、2.60、2.62、2.64),7.26处的吸收峰由溶剂 CDC13产生,这一结果与Quillaguaman等[11]报道的基本一致。核磁共振检测结果进一步说明胞内聚合物为PHB。

图4 核磁共振谱图谱 A:13C,B:1HFig.4 Nuclear magnetic resonance (NMR) spectroscopy.
3 讨论
重离子辐照诱变技术应用于微生物,微生物的突变率较高,性能改良的幅度较大,而且应用方便、迅速、经济,所以被广泛用于对多种生物的改良和优化。随着重离子辐照诱变技术在优良性状微生物菌种选育中的不断应用,已取得了丰硕成果。颉红梅等[12]用40Ar离子辐照庆大霉素产生菌绛红小单孢菌,所得突变株的正变率为 69.1%。利用重离子辐照技术选育优良性状的之江菌素产生菌,获得的新菌株比出发菌株效价提高75.3%[13]。我们利用重离子辐照技术对菌株BacillusP-9进行诱变选育,结果表明,重离子辐照诱变显著提高了供试菌株PHB的产量,其重离子的最佳诱变剂量为15 Gy,致死率在90%左右时诱变效果最佳,重离子辐照诱变育种效果显著,具有广阔的发展应用前景。
进一步工作将用不同能量的离子束辐照处理菌株,研究其作用效果及机理,以指导设计最佳辐照诱变方案,达到更好的诱变效果,为进一步开展同类工作提供理论依据。本实验所用菌为芽胞杆菌属菌株,其产生的 PHB没有生物毒性[14],可应用于医疗工业中,具有良好的研究和应用价值。期待进一步研究G15菌株的遗传稳定性及发酵条件,进行中试试验研究,尽快进入工业化生产阶段。
1 于慧敏, 沈忠耀. 生物化工, 2001, 8: 11–16 YU Huimin, SHEN Zhongyao. Biochemical, 2001, 8:11–16
2 唐掌雄, 刘志芳, 施巾帼, 等. 核技术, 2005, 28(1):30–33 TANG Zhangxiong, LIU Zhifang, SHI Jinguo,et al. Nucl Tech, 2005, 28(1): 30–33
3 李红玉, 李成华, 丁新春, 等. 辐射研究与辐射工艺学报, 2004, 22(1): 56–60 LI Hongyu, LI Chenghua, DING Xinchun,et al. J Radiat Res Radiat Process, 2004, 22(1): 56–60
4 杨 宇, 徐爱玲, 张燕飞, 等. 生命科学研究进展, 2006,12(4): 62–67 YANG Yu, XU Ailing, ZHANG Yanfei,et al. Life Sci Res,2006, 12(4): 62–67
5 Anthony G, Holt J G. Appl Environ Microbiol, 1982,44(1): 238–241
6 徐 浩, 江慧修, 周慧玲, 等. 微生物学报, 1991, 31(5):333–337 XU Hao, JIANG Huixiu, ZHOU Huilin,et al. Acto Microbiol Sin, 1991, 31(5): 333–337
7 徐爱玲, 历 丽, 张 帅, 等. 武汉大学学报(自然科学版), 2008, 54(6): 707–712 XU Ailing, LI Li, ZHANG Shuai,et al. J Wuhan Univ(Nat Sci Ed.), 2008, 54(6): 707–712
8 Purushothanman M, Anderson R K L, Narayana S,et al.Bioprocess and Biosystems Eng, 2001, 24: 131–136
9 彭仁旺, 管考梅, 黄秀梨. 微生物学通报, 1995, 22(4):197–199 PENG Renwang, GUAN Kaomei, HUANG Xiuli.Microbiol Tongbao, 1995, 22(4): 197–199
10 JIANG Yuji, SONG Xin, GONG Lei,et al. Enzyme and Microbial Technol, 2008, 42: 167–172
11 Jorge Quillaguaman, Osvaldo Delgado, Bo Mattiasson,et al. Enzyme and Microbial Technol, 2006, 38: 148–154
12 SANG Jinlong, ZHU Lihong. Bulletin of Science and Technology (in Chinese), 2002, 18(1): 63–66
13 XIE Hongmei, WEI Zengquan. Chin J Antibiotics (in Chinese), 1998, 23(6): 462–463
14 Valappil S P, Boccaccini A R, Bucke C,et al. Antonie Van Leeuwenhoek, 2007, 91: 1–17
