菜薹杂交种ISSR和SRAP的指纹图谱构建
2010-06-29冒维维孙敬东陈学好
冒维维,孙敬东,陈学好
(1.江苏泰州市作物栽培指导站,225300;2.扬州大学园艺与植物保护学院)
我国大面积栽培的蔬菜,大部分使用了杂种一代。菜薹属十字花科芸薹属作物,具有花期自交不亲和的特性,杂种一代的应用较为普遍。为了充分发挥杂种一代的优势,最根本的是要保持一代杂种的纯度。十字花科作物杂交制种过程中由于管理措施不当和自交不亲和等而常常产生自交种子,即假杂种,降低杂交种的纯度。采用传统的田间形态特征检测种子纯度,费工费时,且一些品种之间植物形态非常接近,很难鉴别。
DNA分子标记技术的出现,有效地提高了遗传分析的效率和准确性,已在遗传研究和育种实践中发挥了巨大作用。随着分子标记技术的日益成熟和普及,分子标记在品种指纹图谱绘制、品种纯度检测等方面也起到越来越重要的作用。迄今,已经有多种分子标记技术应用于多种作物的种子纯度鉴定,其中又以RAPD、ISSR、SRAP和AFLP等最为常见[1]。张增翠等[2]利用AFLP技术构建了不结球白菜矮抗6号的指纹图谱;尹贤贵等[3]利用RAPD技术构建了番茄品种渝粉109的指纹图谱;赵丽萍等[4]利用SRAP与AFLP技术分析了7个萝卜品种的指纹图谱;Zhao等[5]利用 ISSR标记构建了24个桑品种的指纹图谱。但到目前为止,尚未见ISSR和SRAP技术在构建菜薹指纹图谱方面的应用。本研究利用ISSR和SRAP标记技术对1份菜薹杂交组合进行分析,旨在鉴定出双亲及其杂种一代,作为鉴定杂种真伪及种子纯度的方法,并为开展分子标记辅助选择奠定基础。
1 材料与方法
1.1 试验材料
所用材料为菜薹杂交组合 T0601×CT07,其T0601为母本,CT07为父本。2006年9月播种于扬州帮达蔬菜研究所试验田,待幼苗长至5~6片真叶时取嫩叶提取基因组DNA。
1.2 试验方法
①DNA的提取及检测 采用改良过的CTAB法提取基因组DNA。
②PCR扩增及产物检测 ISSR扩增反应体系的总体积为 20 μL,包括 1×PCR buffer,模板 DNA 30 ng,Taq 酶 1 U,dNTP 250 μmol/L, 引 物 0.25 μmol/L,Mg2+2.5 mmol/L。
反应程序为94℃预变性5 min,94℃变性1 min,52℃退火 1 min,72℃延伸 1.5 min,循环 35 次,72℃延伸10 min,扩增产物4℃保存。PCR产物在1.5%琼脂糖凝胶中电泳 1 h,EB染色,Gel DocTM EQ 170-8060凝胶成像仪进行观察并拍照分析。
SRAP扩增反应体系的总体积为20 μL,包括1×PCR buffer, 模板 DNA 30 ng, Taq 酶 1 U、dNTP 250 μmol/L、上游引物 0.25 μmol/L、下游引物 0.25 μmol/L、Mg2+2.5 mmol/L。

图1 不同ISSR引物对供试材料的扩增结果
2 结果与分析
2.1 引物筛选
用100个ISSR引物和30对SRAP引物对供试材料进行PCR扩增,其中有42个ISSR引物和全部30对SRAP引物均能扩增出清晰的条带,但大多数引物的扩增结果在双亲及杂种之间是一致的,不能起到鉴别的作用。最终筛选出5个ISSR引物(UBC823、UBC843、UBC876、UBC880 和UBC890)和 3对 SRAP 引物(E4-M11、E7-M4和 E10-M8)可将双亲和F1清晰区分,且重复性好。
2.2 扩增结果分析
由图1,2可知,两种标记技术共8个(对)引物(UBC823、UBC843、UBC876、UBC880、UBC890、E4-M11、E7-M4和E10-M8)能在材料间表现出多态。引物UBC823在约1 400 bp、1 000 bp和800 bp处分别扩增出3条双亲的特异带,在F1中3条特异带也被扩增出来,表现为双亲间互补特征带;引物UBC843在约1 700 bp、1 500 bp和900 bp处扩增出3条双亲的互补特征带,在F1中3条特异带也均存在;引物UBC876在父本和F1中均约1 600 bp和600 bp处扩增出2条特征带,而在父本中又扩增出1条约1 500 bp的特异带区别于母本和F1;引物UBC880在父本和F1中均约1 700 bp和1 200 bp处扩增出2条特征带,而在F1中又扩增出1条约1 500 bp的特异带区别于其双亲;引物UBC890在父本和F1中均约800 bp处扩增出1条特征带,而在母本中又扩增出1条1 200 bp的特征带区别于父本和F1(图 1)。
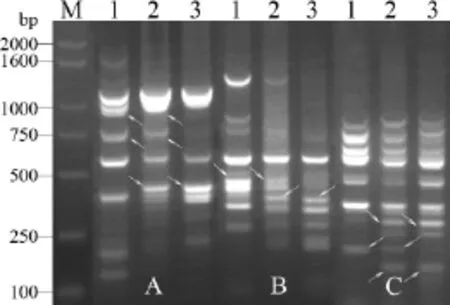
图2 不同SRAP引物对供试材料的扩增结果
图2表明,引物组合E4-M11在约900 bp、750 bp和450 bp处扩增出3条双亲的互补特征带,在F1中3条特异带也均存在;引物组合E7-M4在约450 bp和400 bp处扩增出3条双亲的互补特征带,在F1中3条特异带也均出现;引物组合E10-M8 在 300 bp、250 bp、200 bp 和 150 bp 之间扩增出4条双亲的互补特征带,在F1中4条特异带也被扩增出来。由此可见,8个(对)引物均能对供试材料的双亲和F1进行有效鉴别。
2.3 数字指纹的建立
根据上述两种分子标记指纹图谱,以1和0分别代表某个等位基因位点扩增DNA条带的有无,按照从上到下即由大片段向小片段的读带方向,将分子标记指纹图谱转换为由1和0组成的字符串,即构成数字指纹。为方便建立相应的数字指纹[6],可先依照分子标记指纹图谱绘制直观的线段示意图(图3),再根据示意图建立数字指纹(表1)。从表1可知,杂交种与亲本之间以及亲本相互之间的多态可以通过字符串的排列顺序而得到清楚的表达。
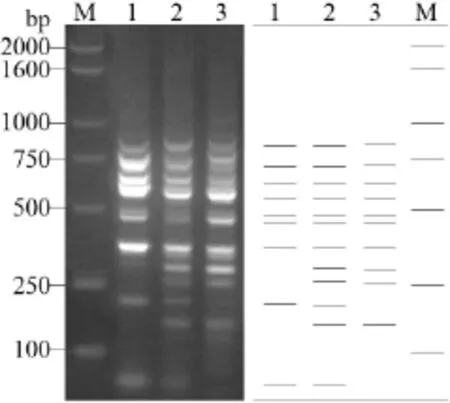
图3 E10-M8引物对供试材料的指纹图谱和指纹图谱线段示意图
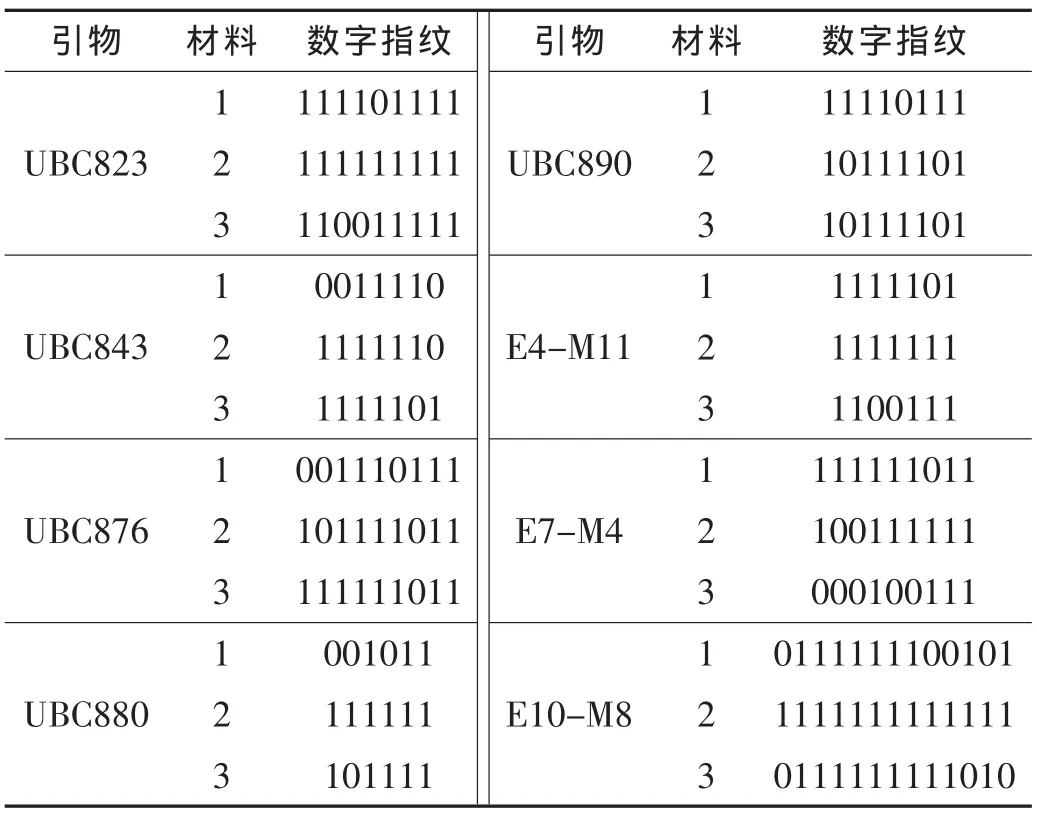
表1 分子标记指纹图谱的数字指纹
3 小结与讨论
DNA指纹图谱是建立在DNA分子标记技术基础上的,能够鉴别生物个体之间差异的DNA电泳图谱。这种电泳图谱多态性丰富,具有高度的个体特异性和环境稳定性,就像人的指纹一样,因而被称为“指纹图谱”[7]。指纹图谱是鉴别品种、品系(含杂交亲本、自交系)的有力工具,具有快速、准确等优点。因此指纹图谱技术非常适合于品种资源的鉴定工作。
ISSR和SRAP分子标记技术通常都是显性或共显性标记[8],所以父母本具有的特征带,在杂种F1代中通常也能表现出来,通过检测F1代是否出现双亲的特异带,即可进行杂种鉴定。本试验成功筛选出3个ISSR引物和3对SRAP引物,可扩增出供试材料双亲的互补特征带;另有2个ISSR引物,也可有效鉴别双亲及其杂种F1。因此,两种标记技术均适用于菜薹的指纹图谱构建,都能有效地鉴别双亲及其杂种F1,用于杂种纯度的鉴定。本研究利用两种标记技术已经初步建立了1份菜薹杂交组合的指纹图谱,并转化为数字指纹图谱,为今后菜薹杂交种子纯度鉴别,实现早期筛选淘汰,为提高育种效率提供了技术支撑,在分子水平上为新品种的知识产权保护提供了技术保障。
[1]王忠华.DNA指纹图谱技术及其在作物品种资源中的应用[J].分子植物育种,2006,4(3):425-430.
[2]张增翠,侯喜林.不结球白菜矮抗6号的AFLP指纹鉴定[J].江苏农业科学,2004(1):63-64.
[3]尹贤贵,潘光辉,杨琦凤,等.番茄品种渝粉109的DNA指纹图谱构建[J].西南农业学报,2007,20(5):1 064-1 066.
[4]赵丽萍,柳李旺,龚义勤,等.萝卜品种指纹图谱SRAP与AFLP 分析[J].植物研究,2007,27(6):687-694,714.
[5]Zhao W G,Miao X X,Zang B,et al.Construction of fingerprinting and genetic diversity of mulberry cultivars in china by ISSR markers[J].Acta Genetica Sinica,2006,33(9):851-860.
[6]刘冲,王曙霞,任云英,等.“夏光”、“早夏 16”甘蓝杂交种DNA 指纹图谱的构建[J].上海农业学报,2006,22(1):31-33.
[7]李长有.DNA指纹技术的研究进展及应用[J].吉林师范大学学报:自然科学版,2004,25(2):56-58.
[8]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
